链脲佐菌素诱导树鼩2型糖尿病
2013-09-20吴晓云李昀海张林强廖莎莎
吴晓云,李昀海,常 青,张林强,廖莎莎,梁 斌,2,3,*
1. 中国科学院和云南省动物模型与人类疾病机理重点实验室, 中国科学院昆明动物研究所, 云南 昆明 650223;
2. 中国科学院昆明灵长类研究中心,云南 昆明 650223;
3. 中国科学院树鼩繁殖基地,云南 昆明 650223
糖尿病是以高血糖为主要标志的代谢性疾病,由于遗传因素、环境因素以及两者之间的相互作用等,将出现胰岛素抵抗和胰岛β细胞功能失常引起的相对胰岛素不足。目前,全世界糖尿病患者~2.85亿,未来 20 a的发病率将增长 1倍 (Shaw et al,2010)。我国糖尿病患者已达9 240万,糖尿病前期患者1.48亿,为全球糖尿病患者最多的国家 (Yang et al, 2010)。据中华医学会糖尿病分会、国际糖尿病联合会在 2010年联合国糖尿病日发布的一项糖尿病对社会经济影响的研究结果显示,我国糖尿病导致的直接医疗开支占全国医疗总开支的13%,达1734亿人民币。显然,2型糖尿病患病率的快速增长不仅严重危害我国以及全世界人民的生命健康,也给个人和国家带来了巨大的经济损失。
糖尿病主要分为 1型 (胰岛素依赖型)和 2型(非胰岛素依赖型)。一般认为,1型糖尿病源于自身免疫系统紊乱,即胰岛内分泌胰岛素的β细胞被体内免疫系统攻击而凋亡,导致胰岛素缺乏。1型糖尿病发病较早 (大多<16 a),起病急且症状明显,多见消瘦及酮症,需依赖胰岛素治疗,且易出现酮症酸中毒等急性并发症。2型糖尿病则是一种典型的代谢紊乱,为糖尿病的最主要类型 (占患者的90%),以出现胰岛素抵抗和胰岛β细胞功能失常引起的相对胰岛素不足为特征。2型糖尿病发病较晚(大多>40 a),起病缓,多见超重和肥胖,无酮症,不依赖于胰岛素治疗,但易出现循环系统并发症,且病因复杂,涉及各种遗传因素、环境因素以及两者之间的相互作用等,具体的致病机理至今尚不清楚。
通过建立动物模型来研究2型糖尿病的发病机制是预防和治疗糖尿病的有效途径。目前,链脲佐菌素 (streptozotocin,STZ)被广泛地应用于创建糖尿病动物模型。STZ是结构类似于葡萄糖和N-乙酰氨基葡萄糖 (N-acetyl glucosamine,GlcNAc)的抗生素,通过GLUT 2转运到胰腺β细胞后,可使DNA断裂引起β细胞凋亡,从而诱发高血糖。根据STZ注射剂量的大小以及注射次数的多少可以创建不同类型的糖尿病动物模型 (Deeds et al, 2011; Junod et al, 1967; Kuttler & Schneider, 1982; Rerup, 1970)。在啮齿类和非人灵长类动物中,可分别采用一次性大剂量和多次小剂量的注射方式创建类似1型和2型糖尿病的动物模型 (Erdal et al, 2011; Junod et al,1969; Kavanagh et al, 2011; Koulmanda et al, 2003;Nain et al, 2012; Ventura-Sobrevilla et al, 2011; Wei et al, 2011; Wu et al, 2009)。但由于种属差异性,啮齿类动物 (大、小鼠)糖尿病模型往往仅吻合人类糖尿病的部分病理过程和特征 (Srinivasan & Ramarao,2007),而尽管非人灵长类动物糖尿病模型的血糖规律及病理特征均与人类糖尿病患者的临床特征最为相似 (Wagner et al, 2006),但却受限于伦理、资源稀缺、遗传操作困难、成本高及周期长等,很难得到广泛应用。因此,需要去寻找一种适用于糖尿病研究的动物模型。
树鼩 (Tupaia belangeri chinensis)隶属于攀鼩目 (Scandentia)树鼩科 (Tupaiinae),是灵长类动物的近亲。Rabb et al (1966)在两只菲律宾树鼩(Urogale everetti)中观察到自发糖尿病,这些树鼩的表型,如酮症、脱发及白内障等均与人类糖尿病表型一致,且病理学检查显示其胰腺小岛的β细胞缺失,被纤维细胞代替,与人类糖尿病发病机理一致。Ishiko et al (1997)和Xian et al (2000)初步报道了利用不同浓度的STZ诱导树鼩糖尿病。然而,菲律宾树鼩和树鼩分属两个属,物种间存在较大差异(Fuchs,1999)。STZ注射虽然可以诱导树鼩糖尿病,但由于所用STZ剂量较高,导致糖尿病发病症状类似于1型糖尿病。因此,本文拟通过注射低剂量STZ来创建树鼩2型糖尿病动物模型,以期为研究2型糖尿病发病机理提供新的动物模型。
1 材料和方法
1.1 实验动物
24只健康成年雄性树鼩,体重121~160 g,均来自中国科学院昆明动物研究所动物实验中心。动物单笼饲养于 12 h人工光照(光照时间08:00—20:00)的动物房中,室温(25±3) ℃,湿度40%~60%,自由饮食饮水,每天清理动物笼舍1次。实验所用的树鼩饲料来自昆明医科大学实验动物中心,含粗蛋白22.1%,粗脂肪6%,总热量~4 000 kcal/kg (16 747 kJ/kg)。所有动物在实验前适应饲养>6周。本实验方案获得了中国科学院昆明动物研究所实验动物伦理委员会批准 (批准号:SYBW20110101-1)。
1.2 实验器材及材料
血糖检测使用罗氏Accu-Chek Performa Blood Glucose Meter血糖测试仪;STZ购自Sigma公司(S0130);普通胰岛素购自江苏万邦生化医药股份有限公司;50%葡萄糖注射液购自昆明南疆制药有限公司。
1.3 动物分组及造模
动物随机分为4组,每组6只 (表1)。 A-con组:分别在第1天和第3天腹腔注射0.1 mol/L柠檬酸缓冲液 (pH 4.2~4.5),注射时,将动物装入不透光的布袋子中,待其安静20 min后给予注射和血糖监测。A-60组:2~3次腹腔注射60 mg/kg的STZ(STZ溶于0.1 mol/L的柠檬酸缓冲液中,pH 4.2~4.5,新鲜配制的STZ 溶液需在15 min内用完),第一次注射后,每天监测血糖值,如动物空腹血糖值≤7.0 mmol/L,再补充注射,其中4只动物各注射3次 (分别在第1天,第3天和第4天),另两只动物各注射两次 (第1天和第3天)。A-70组:2~3次腹腔注射70 mg/kg的STZ;第一次注射后,每天监测血糖值,如动物空腹血糖值≤7.0 mmol/L,再补充注射。其中4只动物注射各3次 (第1天、第3天和第5天),另两只动物各注射两次 (第1天和第3天)。A-80组:两次腹腔注射80 mg/kg的STZ,第一次注射后,每天监测血糖值,如动物空腹血糖值≤7.0 mmol/L,第4天补充注射1次。动物出现高血糖后,对于空腹血糖浓度>20.0 mmol/L的动物每天给予普通胰岛素注射1次,胰岛素注射量从最初的1 U/kg逐渐增加到8 U/kg。由于A-60组中的成模动物在第9周时出现意外死亡和转阴,实验仅持续9周,另两组实验持续16周。

表1 不同剂量STZ组动物成模率、死亡率及转阴率比较Table 1 Success, mortality, and cure rates of diabetic tree shrews dosed with different concentrations of Streptozotocin
1.4 指标检测
所有动物在造模后每周测量空腹体重和空腹血糖各1次。测量前过夜禁食,所有动物分别装入布袋中称量体重,并从尾静脉采血一滴,使用血糖仪测量血糖。另外,分别于造模前、后的每4周从股静脉采血~1 mL,检测空腹状态下糖化血红蛋白(HbA1c)、甘油三酯(TG)及总胆固醇(TCHOL)等生化指标。在第8周时采集动物尿液3~5 mL,检测尿糖、酮体、尿微量白蛋白和尿肌酐等。所有检测均由云南省第一人民医院雅培Ci16200全自动生化分析仪完成。
1.5 口服葡萄糖耐量试验
于成模后第4周和第10周进行口服葡萄糖耐量实验。所有动物实验前禁食12 h,测量空腹体重和空腹血糖。根据每只动物的体重分别饲喂4 mg/kg的葡萄糖,于饲喂后20、40、60、90、120及180 min分别从尾静脉采血一滴测定血糖。
1.6 胰岛素耐量试验
于成模后第5周进行胰岛素耐量实验。动物未禁食,测量体重及血糖。根据体重注射1 U/kg的普通胰岛素,测量注射后15、30、45、60及120 min的血糖值,并以0 min血糖值为基准,分别计算15、30、45、60及120 min的血糖值与其的比值,用以衡量血糖下降速度。
1.7 数据分析
利用Excel分析数据。所有数据以mean±SE表示,组间比较使用t-test,P<0.05为差异显著。
2 结果
2.1 各组动物成模情况
各组树鼩是否形成稳定的糖尿病以连续4周空腹血糖值≥7.0 mmol/L 或糖化血红蛋白(HbA1c)≥6.5%为标准(中华医学会糖尿病学分会,2011)。随着 STZ注射剂量的加大,动物成模率和死亡率都有所增加 (表1)。注射STZ 60、70及80 mg/kg的动物成模率分别为66.7%、66.7%和100%,死亡率分别为16.7%、16.7%和33.3%。60 mg/kg STZ动物成模后,第4周的转阴率高达50%,而70和80 mg/kg STZ动物的转阴率为0 (表1)。
2.2 STZ注射后各组动物的体重和血糖变化
A-con组动物的平均体重和平均空腹血糖值维持在稳定水平,未出现明显变化 (图1)。其他3组动物在分别注射不同剂量 (60、70和80 mg/kg)STZ一周后,体重稍下降,但与注射前相比无显著差异(P>0.05),且在随后的 15周内体重恢复到注射前水平。其中,A-80组动物的平均体重还出现少许增长,虽在第16周有所下降,但与实验前0周相比无显著差异 (P>0.05)(图 1A)。注射不同剂量 STZ的 3组动物的平均空腹血糖在注射一周后大幅上升,其中,A-60组动物在注射后第8周的平均空腹血糖值为(14.23±4.15) mmol/L,A-70和A-80组动物在注射后第 16周的平均空腹血糖值分别为(15.10±5.33)和(16.54±4.95) mmol/L,与对照组相比均显著升高(P<0.0001)(图1B)。
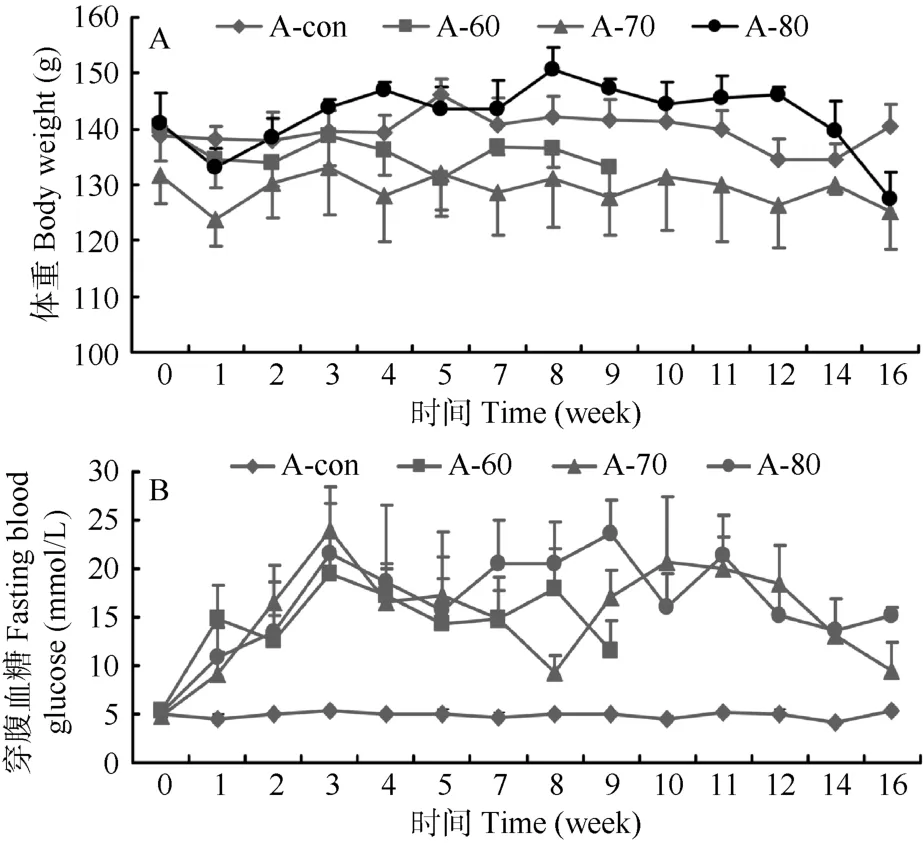
图1 各组树鼩体重(A)和空腹血糖(B)变化趋势Figure 1 Changes in body weight (A) and fasting blood glucose (B) in four groups of tree shrew
2.3 口服葡萄糖耐量试验和胰岛素耐量试验
第4周口服葡萄糖耐量试验显示,A-60、A-70和A-80动物在饲喂葡萄糖后的20、40、60及90 min出现明显的高血糖,远高于A-con组动物,且A-con组动物的口服葡萄糖耐量峰值出现在 20 min,而A-60、A-70和A-80组动物的波峰延迟,均出现在40 min (图2A)。另外,A-60、A-70及A-80组的糖耐量曲线下面积均显著高于A-con组 (依次分别为(74.43±12.18)、 (76.93±13.67)、 (77.77±14.38)和(46.57±3.09),P<0.05) (图 2B),各组糖耐量均显著受损。第10周时,A-60组成模动物意外死亡,转阴动物的口服葡萄糖耐量曲线仍显示不正常,虽然其在20、40及60 min的血糖值均低于A-con组动物的血糖值,但血糖持续上升到 90 min才出现峰值。A-70和A-80组动物在各个时间点的血糖值均显著高于对照组和A-60组,而A-80组动物的峰值仍出现在 40 min。糖耐量曲线下面积也显示 A-70和A-80组显著高于A-con和A-60组(依次分别为(130.4±24.32)、 (130.55±4.76)、 (67.33±6.65)和(61.58±1.81),P<0.05),糖耐量显著受损。
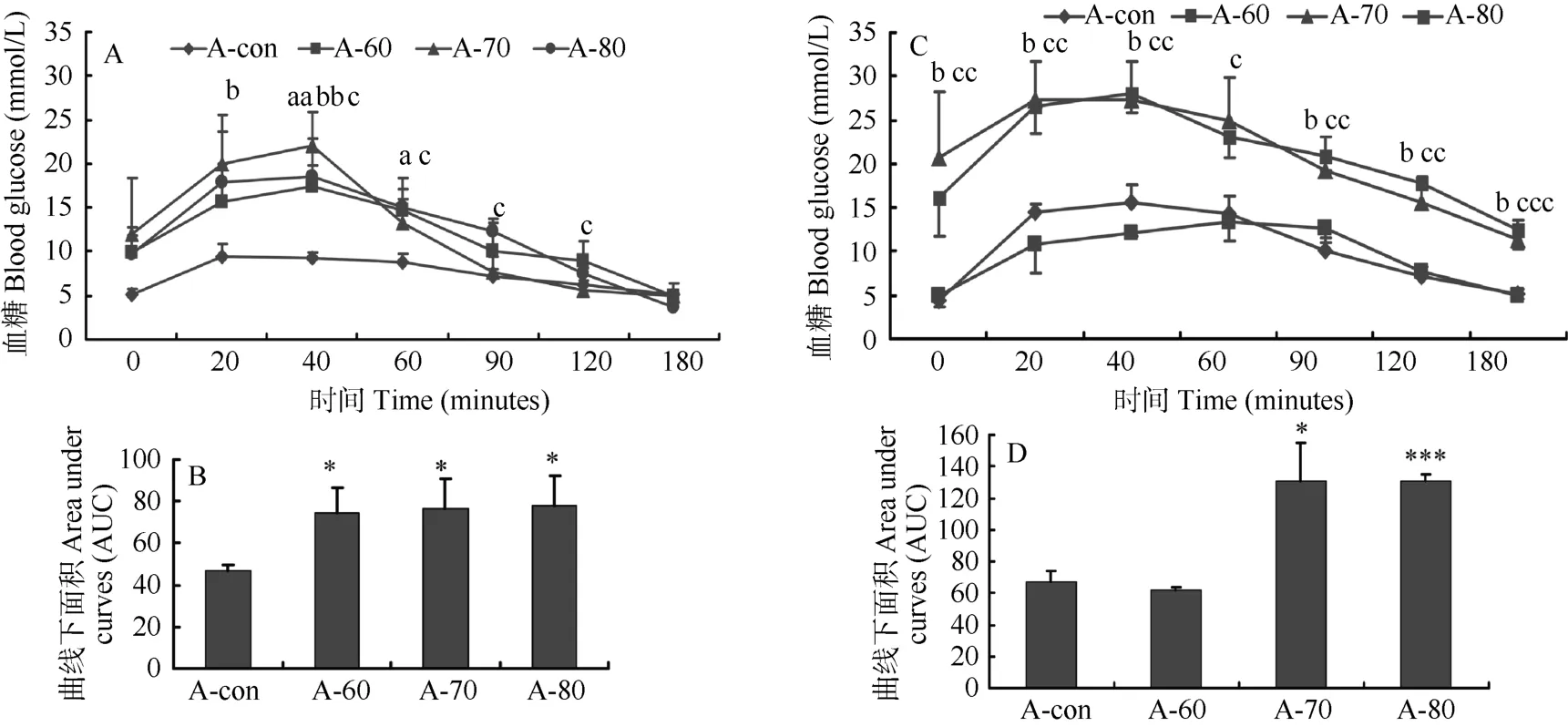
图2 第4周(A, B)和第10周 (C, D) 时的各组口服糖耐量试验曲线(A, C)及曲线下面积(B, D)Figure 2 Oral glucose tolerance test curve (A) and areas under the curve (B) in four groups of tree shrew
在胰岛素耐量实验中,A-60和A-70动物的血糖下降幅度虽高于对照组,但均不显著(P>0.05),A-80动物的血糖下降幅度在30、60及90 min显著高于对照组 (P<0.05)(图 3),表现一定程度的胰岛素分泌不足。

图3 第5周时的各组胰岛素耐量曲线Figure 3 Insulin tolerance test curve for four groups of treeshrew
2.4 血液生理生化指标
2.4.1 糖、脂及胆固醇代谢变化
A-con组动物的糖化血红蛋白、甘油三酯和总胆固醇水平均无显著变化(表2)。A-60、A-70和A-80组的糖化血红蛋白含量在STZ注射后第4周、第8周和第16周与注射前及A-con组相比均显著升高(P<0.05),A-70和A-80组的该指标增加2~3倍。A-60和A-70组甘油三酯的含量在STZ注射后第4周与注射前相比均显著升高[分别为(0.87±0.33)mmol/L和 (0.73±0.24) mmol/L,P<0.05],而在第8周、第12周和第16周则均无显著变化 (P<0.05)。A-70组甘油三酯的含量在第 16周显著下降[(0.35±0.14) mmol/L,P<0.05]。相比注射前的 A-con组,A-80组甘油三酯的含量在第4周、第12周和第16周均略有升高,但变化不显著,而在第8周时显著升高[(0.85±0.35)mmol/L,P<0.05]。
相比A-con组及注射前,A-60组动物的总胆固醇含量在STZ注射后第4周和第8周均无显著变化。A-70组的总胆固醇含量仅在STZ注射后第 4周相对 A-con组显著增高[(2.35±0.55) mmol/L,P<0.05],而在第8周、第12周和第16周均无显著变化。A-80组的总胆固醇含量在STZ注射后,相对A-con和注射前均有所升高,但仅在第4周时具显著水平[(2.19±0.12) mmol/L,P<0.05](表 2)。
2.4.2 肾功能分析
血尿素氮含量是反映肾功能的指标之一。尿素氮含量在注射不同剂量的STZ后均大幅升高。A-60组尿素氮平均值在第4周和第8周时都较注射前升高~6 mol/L,在第 4周时显著升高 [(10.98±4.39)mmol/L,P<0.05]。A-70和A-80组动物在STZ注射后第16周,尿素氮含量较注射前显著升高2~3倍 (P<0.05)(表 2)。

表2 STZ诱导造模各时期血液生理生化指标检测Table 2 Comparison of plasma chemical indexes in tree shrews induced by different doses of STZ
另外,在我们分别取第8周时对照组和成模动物尿液,检测其是否出现糖尿病肾病并发症 (表3)。尿糖含量在成模动物中均为“++++”,而A-con组动物没有检测到尿糖。在所有动物中均未检测到酮体,表明树鼩糖尿病并非1型糖尿病。成模组尿微量白蛋白含量为对照组的~3倍,而成模组和对照组的尿肌酐无显著差异 (P<0.05)。成模组尿微量白蛋白/尿肌酐比值为对照组的~5倍。

表3 成模动物尿液指标检测Table 3 Comparison of urine chemical indexes between control and diabetic tree shrews
2.4.3 乳酸及渗透压变化
为检验动物在注射 STZ后是否出现糖尿病乳酸中毒和高血糖高渗,我们检测了乳酸、血钠和血钾含量 (表2)。这3个指标在对照组和STZ注射组均呈现相同的趋势,即对照组及STZ组乳酸含量降低,各组血钠值均升高,血钾值均降低。
3 讨论
本实验发现,多次小剂量STZ (60~80 mg/kg)注射可诱导树鼩出现明显的糖尿病症状。成模动物均持续9~16周的高血糖,其糖化血红蛋白显著升高,且口服葡萄糖耐量明显受损 (表 2,图 1,图2)。该结果与前人使用一次性大剂量 STZ (300 mg/kg) (Ishiko et al,1997)和一次性注射 80、100、120及 150 mg/kg STZ (Xian et al,2000)的结果基本一致。但是,Xian et al (2000)注射80、100及120 mg/kg STZ不能建立长期稳定的模型,不成模率和转阴率较高,而150 mg/kg STZ则造成动物出现典型的“三多一少”症状。Ishiko et al (1997)使用 300 mg/kg的剂量则可以在2周内诱导动物出现白内障。这些研究结果表明树鼩所出现的糖尿病症状更类似于1型糖尿病。Li (2010)曾分别在第1天、第7天和第28天注射120 mg/kg STZ,诱导树鼩出现2型糖尿病症状。然而,我们前期的探索实验中曾经使用高剂量STZ (120 mg/kg)注射树鼩,在两周内由于血糖过高导致个体全部死亡。目前并不清楚是什么原因导致不同研究人员的实验结果出现显著差别。
本研究使用多次小剂量 STZ注射创建的树鼩糖尿病发病症状更类似2型糖尿病。前人经验表明多次小剂量STZ注射可以部分破坏胰岛β细胞,并引起巨噬细胞和淋巴细胞浸润等炎症反应,最终导致胰岛素分泌不足 (Kolb & Kröncke, 1993)。因此,糖耐量试验和胰岛素耐量试验结果分别显示树鼩注射 STZ后出现糖耐受受损和胰岛素相对分泌不足(图 2,图 3)。树鼩注射 STZ后,虽出现多饮、多食和多尿症状,但是,除A-80组动物在第16周时出现体重下降,动物在整个实验过程中,体重均维持稳定 (图1A)。该结果与STZ诱导CD1小鼠的结果一致 (Ventura-Sobrevilla et al, 2011)。另外,尿液中是否存在酮体也是区别1型和2型糖尿病的重要指标 (中华医学会糖尿病学分会, 2011)。在本实验中,STZ组树鼩的尿液检测分析均未出现酮体阳性,而且,其乳酸、血钠及血钾水平与同时期对照组相比亦未显著升高,且成模动物未出现明显的血糖高渗状态和乳酸性中毒 (表2) 症状。这些结果均表明多次小剂量STZ诱导的树鼩糖尿病症状与1型糖尿病不相似,而更类似于2型糖尿病。
STZ注射后,A-70和A-80组动物的甘油三酯和总胆固醇含量均出现不同程度的升高,A-60组仅甘油三酯含量升高 (表2)。临床上,糖尿病患者多出现高甘油三酯血症及胆固醇升高等脂代谢紊乱,从而增加患心脑血管疾病的危险 (Shepherd,1994)。高血糖引起血液中甘油三酯和胆固醇含量升高的一个主要原因是由于脂蛋白酯酶——水解甘油三酯的酶调控水平发生变化(Goldberg, 2001)。胰岛素可以激活脂蛋白酯酶,若出现胰岛素抵抗和胰岛素分泌缺乏则会减少脂蛋白酯酶的激活,从而引起血液中甘油三酯含量升高,如果增加胰岛素敏感性或给予外源胰岛素注射,甘油三酯和胆固醇含量则会随之下降 (Goldberg, 2001; Taskinen & Nikkila,1979)。胰岛素耐量试验显示树鼩注射 STZ后胰岛素相对分泌不足(图3),提示这些树鼩的脂代谢出现紊乱。虽然有必要进一步检测各组动物脂蛋白酶活性的变化,但目前受检测技术的阻碍,暂时不能检测树鼩脂蛋白酶活性。
本实验成模动物肾脏功能明显受损 (表 2,表3)。尿素氮及微量白蛋白尿检测是糖尿病肾病早期诊断的公认指标。本研究使用尿蛋白/肌酐比值来判断树鼩是否出现糖尿病肾病。我们发现成模动物的尿蛋白/肌酐比值显著高于对照组动物,且各组动物的血尿素氮相对注射前均提高 3~5倍。同时,肾脏病理切片也显示部分成模动物出现轻微肾小球病变(结果未显示)。这些结果都提示STZ诱导的树鼩糖尿病模型表现明显的肾功能受损。该现象也见于 STZ诱导的非人灵长类和啮齿类动物糖尿病模型 (Kramer et al, 2009; Palm et al, 2004)。由于STZ会对肾脏产生毒害 (Weiss, 1982),那么,糖尿病动物模型的肾脏损害应归因于 STZ的毒性还是长期高血糖的作用。Palm et al (2004)指出STZ诱导的糖尿病动物模型出现的尿蛋白渗漏部分归因于 STZ的直接毒性,部分归因于长期的高血糖状态,而Zafar et al (2009)分别对STZ诱导第2周、第4周和第8周的糖尿病大鼠的肾脏切片的观察则认为其肾脏损伤是由于 STZ诱发的严重高血糖所导致。另外,也有报道称通过胰岛素治疗可以区分STZ损害和高血糖引起的肾功能受损 (Rasch, 1979,1980)。本实验中,使用胰岛素控制血糖的树鼩的尿微量白蛋白含量远低于未使用胰岛素控制的树鼩 (结果未显示),但与对照组相比仍显著升高 (表3)。然而,由于我们给予胰岛素的注射量仅用于降低动物的死亡率,并不足以控制血糖,因此,给予胰岛素控制的动物在第 16周时,其血糖和糖化血红蛋白含量并未显著降低。因此,本实验中树鼩出现的肾脏损害是由高血糖或高血糖和 STZ的共同作用导致仍需进一步研究。
由于STZ主要作用于胰岛β细胞,因此,STZ诱导2型糖尿病的机理是使动物胰岛β细胞部分凋亡而引起胰岛素分泌相对不足。如果胰岛β细胞遭到大量破坏,胰岛素严重分泌不足则会使动物出现类似1型糖尿病的症状,甚至造成死亡。并且,不同种或不同遗传背景的动物使用 STZ的剂量也大不相同 (Junod et al, 1969)。因此,合适的STZ注射剂量是创建不同类型糖尿病的关键。本研究采用多次小剂量 (60、70及80 mg/kg)注射STZ诱导树鼩糖尿病,由于各组造模动物的生理生化指标、糖耐量和胰岛素耐量曲线等均无明显差异,因此,可根据其成模率、发病症状及成模稳定性来判断适合造模的STZ剂量,且由于各组成模动物的发病特征表现一致,因此,我们通过成模率和成模稳定性来判断适用于创建类似 2型糖尿病树鼩模型的剂量。A-60组动物通过2~3次注射60 mg/kg的STZ后,成模率虽达到 66.7%,但在第 8周时转阴率高达50%,高血糖症状不能长期稳定维持。A-70和A-80组动物的成模率分别为66.7%和100%,但没有动物转阴,且能维持 16周的高血糖症状,A-70组有66.7%的动物需要注射3次STZ才能成模,而A-80组动物仅需两次注射即可成模。因此,两次注射80 mg/kg的STZ是建立树鼩糖尿病及并发症模型的较理想的造模方法。
Chinese Diabetes Society. 2011. Chinese Guideline for Type 2 Diabetes.Beijing: Peking University Medical Press. [中华医学会糖尿病学分会.2011. 中国2型糖尿病防治指南. 北京: 北京大学医学出版社.]
Deeds MC, Anderson JM, Armstrong AS, Gastineau DA, Hiddinga HJ,Jahangir A, Eberhardt NL, Kudva YC. 2011. Single dose streptozotocin-induced diabetes: considerations for study design in islet transplantation models. Laboratory Animals, 45(3): 131-140.
Erdal N, Gurgul S, Kavak S, Yildiz A, Emre M. 2011. Deterioration of bone quality by streptozotocin (STZ)-induced type 2 diabetes mellitus in rats.Biological Trace Element Research, 140(3): 342-353.
Fuchs E. 1999. Tree shrews. In: Poole T, editor. UFAW handbook on the care and management of laboratory animals, vol. 1,7th ed. Terrestrial vertebrates. Oxford: Blackwell. 235–245.
Goldberg IJ. 2001. Clinical review 124: Diabetic dyslipidemia: causes and consequences. Journal of Clinical Endocrinology and Metabolism, 86(3):965-971.
Ishiko S, Yoshida A, Mori F, Abiko T, Kitaya N, Kojima M, Saito K. 1997.Early ocular changes in a tree shrew model of diabetes. Nippon Ganka Gakkai Zasshi, 101(1): 19-23.
Junod A, Lambert AE, Stauffacher W, Renold AE. 1969. Diabetogenic action of streptozotocin: relationship of dose to metabolic response. Journal of Clinical Investigation, 48(11): 2129-2139.
Junod A, Lambert AE, Orci L, Pictet R, Gonet AE, Renold AE. 1967.Studies of the diabetogenic action of streptozotocin. Proceedings of the Society for Experimental Biology and Medicine, 126(1): 201-205.
Kavanagh K, Flynn DM, Nelson C, Zhang L, Wagner JD. 2011.Characterization and validation of a streptozotocin-induced diabetes model in the vervet monkey. Journal of Pharmacological and Toxicological Methods, 63(3): 296-303.
Kolb H, Kröncke KD. 1993. IDDM: lessons from the low-dose streptozotocin model in mice. Diabetes Reviews, 1: 116-126.
Koulmanda M, Qipo A, Chebrolu S, O'Neil J, Auchincloss H, Smith RN.2003. The effect of low versus high dose of streptozotocin in cynomolgus monkeys (Macaca fascilularis). American Journal of Transplantation, 3(3):267-272.
Kramer J, Moeller EL, Hachey A, Mansfield KG, Wachtman LM. 2009.Differential expression of GLUT2 in pancreatic islets and kidneys of New and Old World nonhuman primates. American Journal of Physiology Regulatory Integrative and Comparative Physiology, 296(3): R786-R793.Kuttler B, Schneider E. 1982. Diabetes mellitus in mice induced by multiple subdiabetogenic doses of streptozotocin: age and sex dependence. Acta Biologica et Medica Germanica, 41(12): 1199-1202.
Li HY. 2010. A Study on Artificial Induced Type 2 Diabetes Mellitus Animal Models in Tree Shrews. Mastre's Degree thesis, Chinese Academy of Medical Sciences, Peking Union Medical College. [李海燕. 2010. 人工诱导树鼩 2型糖尿病动物模型的研究. 硕士学位论文, 中国医学科学院,北京协和医学院.]
Nain P, Saini V, Sharma S, Nain J. 2012. Antidiabetic and antioxidant potential of Emblica officinalis Gaertn. leaves extract in streptozotocin-induced type-2 diabetes mellitus (T2DM) rats. Journal of Ethnopharmacology, 142(1): 65-71.
Palm F, Ortsäter H, Hansell P, Liss P, Carlsson PO. 2004. Differentiating between effects of streptozotocin per se and subsequent hyperglycemia on renal function and metabolism in the streptozotocin-diabetic rat model.Diabetes Metabolism Research and Reviews, 20(6): 452-459.
Rabb GB, Getty RE, Williamson WM, Lombard LS. 1966. Spontaneous diabetes mellitus in tree shrews, Urogale everetti. Diabetes, 15(5): 327-330.Rasch R. 1979. Prevention of diabetic glomerulopathy in streptozotocin diabetic rats by insulin treatment. Kidney size and glomerular volume.Diabetologia, 16(2): 125-128.
Rasch R. 1980. Prevention of diabetic glomerulopathy in streptozotocin diabetic rats by insulin treatment. Albumin excretion. Diabetologia, 18(5):413-416.
Rerup CC. 1970. Drugs producing diabetes through damage of the insulin secreting cells. Pharmacological Reviews, 22(4): 485-518.
Shaw JE, Sicree RA, Zimmet PZ. 2010. Global estimates of the prevalence of diabetes for 2010 and 2030. Diabetes Research and Clinical Practice,87(1): 4-14.
Shepherd J. 1994. Diabetic dyslipidemia andatherosclerosis. Schweizerische Medizinische Wochenschrift, 124(44): 1933-1937.
Srinivasan,K., Ramarao, P. 2007. Animal models in type 2 diabetes research: An overview.Indian Journal of Medical Research. 125: 451-472.
Taskinen MR, Nikkila EA. 1979. Lipoprotein lipase activity of adipose tissue and skeletal muscle in insulin-deficient human diabetes. Diabetologia,17(6): 351-356.
Ventura-Sobrevilla J, Boone-Villa VD, Aguilar CN, Román-Ramos R,Vega-Avila E, Campos-Sepulveda E, Alarcon-Aguilar F. 2011. Effect of varying dose and administration of streptozotocin on blood sugar in male CD1 mice. Proceedings of the Western Pharmacology Society, 54: 5-9.
Wagner, J.D., Kavanagh, K., Ward, G.M., Auerbach, B.J. et al. 2006. Old world nonhuman primates models of type 2 diabetes mellitus. ILAR Journal,47(3): 259-71.
Wei LL, Lu YR, He SR, Jin X, Zeng L, Zhang S, Chen YN, Tian B, Mai G,Yang G, Zhang J, Wang L, Li HX, Markmann JF, Cheng JQ, Deng SP. 2011.Induction of diabetes with signs of autoimmunity in primates by the injection of multiple-low-dose streptozotocin. Biochemical and Biophysical Research Communications, 412(2): 373-378.
Weiss RB. 1982. Streptozotocin: a review of its pharmacology, efficacy, and toxicity. Cancer Treatment Report, 66(3): 427-438.
Wu D, Zou C, Yue F, Li X, Li S, Zhang YA. 2009. The effect of long-term streptozotocin-induced diabetes mellitus (STZ-DM) on cynomolgus(Macaca fascicularis) monkeys. Journal of Medical Primatology, 38(1):15-22.
Xian S, Huang S, Su JJ, Qin YF, Ou C, Luo ZJ, Wei MY. 2000. A study on experimental diabetes animal models in tree shrews induced by streptozotocin. Journal of Guangxi Medical University, 17(6): 945-949. [冼苏, 黄松, 苏建家, 秦映芬, 欧超, 罗佐杰, 韦敏怡. 2000. 链脲佐菌素诱导树鼩糖尿病动物模型研究. 广西医科大学学报, 17(6): 945-949.]
Yang SH, Dou KF, Song WJ. 2010. Prevalence of diabetes among men and women in China. New England Journal of Medicine, 362(25): 2425-2426.Zafar M, Naqvi N, Ahmed M, Kaimkhani ZA. 2009. Altered kidney morphology and enzymes in streptozotocin induced diabetic rats.International Journal of Morphology, 27(3): 783-790.
