丁苯酞对Aβ1-42致AD大鼠海马p38 MAPK表达的影响
2013-09-20张会凯张晓炜翟留玉郭晓光张国华蒋国卿
张会凯, 张晓炜, 王 珊, 翟留玉, 郭晓光, 张国华, 蒋国卿
阿尔茨海默病(Alzheimer’s disease,AD)是老年人常见的神经系统变性疾病,临床表现为进行性认知功能障碍、记忆力减退及行为异常等,老年斑、神经纤维缠结和神经元减少是AD的主要病理改变。p38 MAPK信号通路可由紫外线、渗透压变化、细胞因子和生理应激等激活,在应激反应如炎症、细胞凋亡中发挥重要作用[1],因此抑制p38 MAPK信号通路的活性、抑制炎症因子的过度表达、降低tau蛋白的过度磷酸化有可能成为治疗AD的有效方法。本研究通过观察丁苯酞对AD模型大鼠行为学改变及大鼠海马组织p38 MAPK、tau蛋白的表达的影响,探讨其对AD的治疗作用及机制。
1 材料与方法
1.1 实验动物和分组 采用健康清洁级雄性SD大鼠,体重为250±50g,月龄4个月,由河北医科大学动物实验中心提供。按随机数字表法随机分为空白组、模型组、丁苯酞低剂量组和丁苯酞高剂量组,每组8只。所有大鼠均在通风、避光、自由进食的条件下饲养。
1.2 动物模型的制作 10%水合氯醛(0.4 ml/100g)腹腔注射麻醉后,固定于大鼠大脑立体定位仪上,参照包新民《大鼠脑立体定位图谱》定位,采用微量注射器双侧海马缓慢注射凝聚态Aβ1-42各5μl(1μg/μl)诱导 AD 模型。
1.3 主要药物和试剂 丁苯酞由石药集团恩必普药业公司提供(批号118120213),用食用麻油稀释成8mg/ml的溶液,于4℃冰箱保存备用,根据人和动物按体表面积折算的等效剂量[2],高剂量组按80mg/kg灌胃、低剂量组按40mg/kg灌胃,空白组、模型组均给以等体积的食用麻油灌胃,每日2次,所有动物均在造模2w后开始药物干预,药物干预共4w。
Aβ1-42(美国Sigma公司),β-actin单克隆抗体(美国Sigma公司),tau单克隆抗体(美国Bioworld公司)及P-tau蛋白单克隆抗体(美国Bioworld公司),p38 MAPK单克隆抗体(美国Cell Signaling公司)及磷酸化P38MAPK单克隆抗体(美国Cell Signaling公司)。
1.4 观察指标
1.4.1 实验动物行为学检测 Morris水迷宫[3]是一个直径为200cm、深60cm的圆形水箱,平均分成4个象限,水面下2cm处有一个直径为9cm的平台,平台位于其中1个象限的中心。造模1w后及药物干预4w后分别进行水迷宫实验,前5d进行定位航行实验,记录大鼠从4个不同象限入水至爬上平台的时间(s),即逃避潜伏期,如果在120s内未能发现平台,将其引至平台停留10s,这个象限记为120s,上午和下午各进行1次,每日2次4个象限的平均值记为大鼠当日的结果。第6天撤除平台,记录60s内大鼠游过原平台的次数,每日2次,取2次的平均值作为大鼠游过平台的次数。
1.4.2 大鼠脑片HE染色 10%水合氯醛腹腔注射麻醉,暴露心脏,经心尖处穿刺至升主动脉,同时剪开右心耳,0.01mol PBS灌注至流出液为澄清时改为4%多聚甲醛灌注约30min,迅速断头取脑,于4%多聚甲醛中固定24h,常规冠状切片,厚度为10μm,经苏木色精染液,伊红染液,酒精梯度脱水,二甲苯透明,中性树胶封片。
1.4.3 p38 MAPK的表达 10%水合氯醛腹腔注射麻醉后,断头低温分离海马组织,微波匀浆,低温10000转/分离心,取上清即为全蛋白提取物,BCA法测蛋白浓度,经10%SDS-PAGE凝胶电泳,转印至 PVDF膜上,封闭后分别用 β-actin、tau、P-tau、p38 MAPK及P-p38 MAPK抗体4℃水平摇床过夜,二抗室温下摇床孵育1h,洗膜后利用Gel Doc凝胶成像系统扫膜分析得出 β-actin、tau、P-tau、p38 MAPK及P-p38 MAPK的灰度值,计算出P-tau与tau、P-p38 MAPK与p38 MAPK灰度值的比值表示P-tau、P-p38 MAPK 水平;tau、p38 MAPK 与相应的β-actin灰度值的比值表示tau、p38 MAPK水平。
1.4.4 统计学处理 应用SPSS13.0统计软件处理,数据均以均数±标准差(±s)表示,各组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用LSD-t检验。非正态或方差不齐者各组间比较采用Kruskal-Wallis H检验,组间两两比较采用Games-Howell检验。检验水准:α<0.05。
2 结果
2.1 行为学检测结果 造模1w后,4组大鼠逃避潜伏期、穿越平台次数不同(P<0.05)。与空白组比较,模型组和丁苯酞低、高剂量组逃避潜伏期时间明显延长(P<0.05),穿越平台次数明显减少(P<0.05)。药物干预4w后,4组大鼠逃避潜伏期、穿越平台次数不同(P<0.05)。与模型组比较,丁苯酞低、高剂量组逃避潜伏期时间缩短(P<0.05),穿越平台次数增多(P<0.05);与低剂量组比较,高剂量组逃避潜伏期时间缩短(P<0.05),穿越平台次数增多(P<0.05)(见表1)。
2.2 大鼠海马组织tau蛋白、p38 MAPK蛋白的表达 tau、p38 MAPK在4组大鼠中表达水平无明显变化(P >0.05),P-tau、P-p38 MAPK 在 4组大鼠中表达水平不同(P<0.05)。与空白组比较,模型组和丁苯酞低、高剂量组P-tau、P-p38 MAPK表达升高(P<0.05)。与模型组比较,丁苯酞低、高剂量组P-tau、P-p38 MAPK 表达降低(P <0.05)。与低剂量组比较,高剂量组P-tau、P-p38 MAPK表达明显降低(P <0.05)(见表2、图1)。
2.3 大鼠海马组织CA1区HE染色(100倍)空白组大鼠海马CA1区锥体细胞排列紧密规则,未见明显的细胞坏死;模型组大鼠海马CA1区锥体细胞明显疏松,层次模糊,大量神经细胞死亡;丁苯酞低剂量组可见部分锥体细胞坏死,排列比较规则;丁苯酞高剂量组锥体细胞坏死较少,排列基本规则(见图2)。
表1 药物干预前、干预4w后Morris水迷宫试验结果(±s)

表1 药物干预前、干预4w后Morris水迷宫试验结果(±s)
与空白组比较*P<0.05;与模型组比较#P<0.05;与低剂量组比较△P<0.05
组别 例数 药物干预前逃避潜伏期(s)穿越平台次数药物干预4w后逃避潜伏期(s)穿越平台次数空白组模型组低剂量组高剂量组8 8 8 8 43.940 ±4.032 80.380 ±6.775*77.380 ±6.510*78.680 ±8.878*5.550 ±1.141 3.900 ±0.907*4.150 ±0.784*3.850 ±1.001*46.349 ±5.227 83.337 ±6.009 65.720 ±6.307#50.367 ±7.301#△5.783 ±1.302 3.747 ±0.874 4.551 ±0.820#5.347 ±0.960#△
表2 大鼠海马tau、p38 MAPK灰度比值(±s)
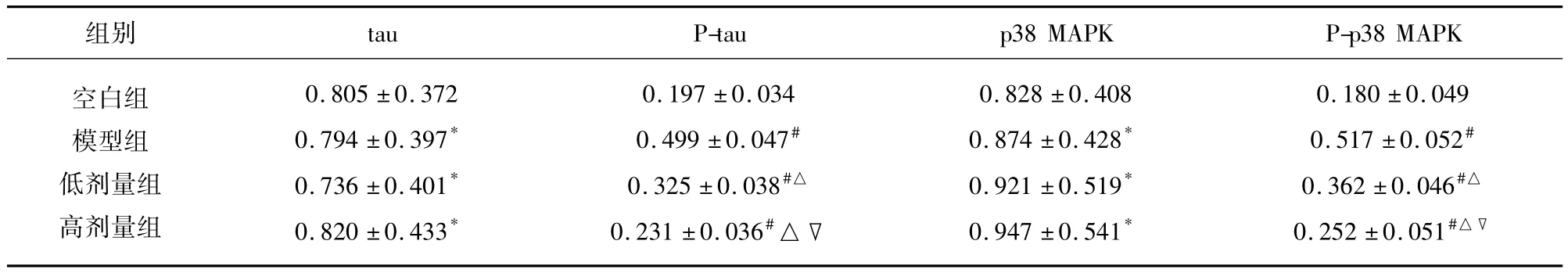
表2 大鼠海马tau、p38 MAPK灰度比值(±s)
与空白组比较*P >0.05,#P <0.05;与模型组比较△P <0.05;与低剂量组比较▽P <0.05
组别tau P-tau p38 MAPK P-p38 MAPK空白组模型组低剂量组高剂量组0.805 ±0.372 0.794 ±0.397*0.736 ±0.401*0.820 ±0.433*0.197 ±0.034 0.499 ±0.047#0.325 ±0.038#△0.231 ±0.036#△▽0.828 ±0.408 0.874 ±0.428*0.921 ±0.519*0.947 ±0.541*0.180 ±0.049 0.517 ±0.052#0.362 ±0.046#△0.252 ±0.051#△▽

图1 丁苯酞对tau、p38 MAPK表达的影响
3 讨论
p38 MAPK信号通路是MAPK通路的一个重要分支,通过参与炎症反应、tau蛋白过磷酸化、促神经元凋亡等与其他信号传递途径共同介导细胞应激诱发的基因表达和酶活性改变,在AD发病、进展中发挥重要作用[4]。Cui L[5]等发现脑缺血大鼠海马组织p38 MAPK明显升高,并且有大量神经细胞凋亡,通过抑制p38 MAPK通路,缺血大鼠区神经元凋亡明显减少。老年斑和神经原纤维缠结是AD的两大特征性损害,越来越多的研究证实,Aβ在体内外诱导tau蛋白过度磷酸化,破坏微管结构及稳定性,损伤轴突转运,最终引起神经元死亡[6]。
丁苯酞能够改善微循环、维护线粒体的结构和功能、降低脑缺血皮层calcineurin和calpain的活性,从而阻止神经细胞凋亡的启动,减轻脑缺血对AD发展的推动作用,改善AD大鼠的认知功能[7]。在实验中丁苯酞低、高剂量组P-p38 MAPK的表达比模型组明显降低,并且呈现出剂量相关性,随着丁苯酞剂量的加大,表达随之降低,表明丁苯酞明显抑制了p38 MAPK的活性。长期慢性缺血缺氧导致大量炎症因子产生,p38 MAPK被磷酸化,移位入核作用到相应的目标,激活下游多种转录调节因子,调节基因转录,诱导Bax转位,介导caspase-3活化,上调TNF-α的表达,促使细胞凋亡[8]。另外磷酸活化的p38 MAPK进一步使IL-1、TNF-α等炎症因子活化,直接损伤神经元,而炎性因子反过来又强烈激活 p38 MAPK通路,形成一个逐渐增强的炎症正反馈途径[9]。现已证明:老年斑的核心成分就是 Aβ。AD患者脑部存在慢性低灌注,长期缺血缺氧、线粒体发生功能障碍、促进炎症因子的释放、引起内质网损伤、诱导β淀粉样蛋白的异常形成。随着β淀粉样蛋白沉积量的增加,iNOS表达增高,p38 MAPK被磷酸活化,引起NO的高表达[10]。另外,大量活化的NF-κB,上调COX-2的表达,导致突触减少、神经元缺损、诱导海马神经元的凋亡,最终导致记忆及认知功能障碍[11]。实验中还发现:模型组P-tau表达最高,低剂量组较模型组降低,高剂量组下降最明显,随着药物剂量的增加表达逐渐下降。相关研究发现Aβ可通过GSK-3β途径增加tau蛋白异常磷酸化,从而引起tau蛋白介导的神经退行性变。此外tau蛋白的过磷酸化是由蛋白激酶完成的,而MAPK是调节tau蛋白过度磷酸化的关键性激酶之一。p38 MAPK是MAPK的重要家族组成部分[12],因此p38 MAPK信号转导途径可能参与了早期SP的形成,Aβ在大脑中的过量生成和聚集,使p38 MAPK磷酸化,进一步促进tau的过磷酸化,继而出现中枢整合功能异常。
通过抑制p38 MAPK的活性,一方面抑制其对促炎信号的转导作用;另一方面抑制其作为炎性细胞因子的下游信号中继而介导的炎症引发的有害效应,减轻小胶质细胞引起的炎性反应,降低tau蛋白的异常磷酸化及IL-1、TNF-α等炎症因子的表达,从而发挥其改善AD大鼠学习记忆能力的作用[13]。因此,丁苯酞可能会成为临床治疗AD的新药物,可以通过抑制p38 MAPK的活性来减轻Aβ诱导的tau蛋白过度磷酸化,但是具体通过何种途径抑制 p38 MAPK的活性从而减轻tau蛋白磷酸化。目前尚不清楚,具体机制还需要更深入的研究。

图2 大鼠海马组织CA1区HE染色(100倍)
[1]Ando K,Uemura K,Kuzuya A,etal.N-cadherin regulates p38 MAPK signaling via association with JNK-associated leucine zipper protein:implications for neurodegeneration in Alzheimer disease[J].J Biol Chem,2011,286(9):7619-7628.
[2]赵 伟,孙国志.不同种实验动物间用药量换算[J].实验动物,2010,5:52-53.
[3]Morris R.Development of a water-maze procedure for studying spatial learning in the rat[J].JNeurosci Methods,1984,11(1):47-60.
[4]Liu XP,Zheng HY,Qu M,etal.Upregulation of astrocytes protein phosphatase-2A stimulates astrocytes migration via inhibiting p38 MAPK in tg2576 mice[J].Glia,2012,60(9):1279-1288.
[5]Cui L,Zhang X,Yang R,etal.Neuroprotection of early and short-time applying atorvastatin in the acute phase of cerebral ischemia:downregulated 12/15-LOX,p38 MAPK and cPLA2 expression,ameliorated BBB permeability[J].Brain Res,2010,1325:164-173.
[6]Philip JDolan,Gail VW Johnson.The role of tau kinases in Alzheime’s disease[J].Curr Opin Drug Discov Devel,2010,13(5):595-603.
[7]Maddahi A,Edvinsson L.Cerebral ischemia induces microvascular pro-inflammatory cytokine expression via the MEK/ERK pathway[J].JNeuroinflammation,2010,7:14.
[8]Jong-Hoon Lim,Jae-Suk Woo,Yung-Woo Shin.cilostazol protects endothelial cells against lipopolysaccharide-induced apoptosis through ERK1/2-and p38 MAPK-dependent pathways[J].Korean J Intern Med,2009,24(2):113-122.
[9]Alma Sanchez,Debjani Tripathy,Xiangling Yin,etal.p38 MAPK:A mediator of hypoxia-induced cerebrovascular inflammation [J].J Alzheimer's Dis,2012,32(3):587-597.
[10]Medeiros R,Prediger RS,Passos GF,etal.Connecting TNF-alpha signaling pathways to iNOS expression in a mouse model of Alzheimer's disease:relevance for the behavioral and synaptic deficits induce by amyloid beta protein[J].JNeurosic,2007,27(20):5394-5404.
[11]张桂莲,姚 丽,杜 赟.p38 MAPK在Aβ25-35诱导AD大鼠海马CA1区表达的研究[J].南方医科大学学报,2008,28(7):1176-1179.
[12]宋锦秋,陈小春,张 静,等.人参皂苷Rbl通过JNK/p38 MAPK途径减轻Aβ25-35诱导的胎鼠皮层神经元tau蛋白过度磷酸化[J].药学学报,2008,43(1):29-34.
[13]侯德仁,田 怡,周 军.丁苯酞对阿尔茨海默病模型大鼠p38及ERK表达的影响及意义[J].南方医科大学学报,2009,29(8):1592-1595.
