大鼠脑出血周边组织caspase-3表达和细胞凋亡的变化及促红细胞生成素的影响
2013-08-11李丛言关雪莲侯丽淳
韩 凤, 李丛言, 关雪莲, 侯丽淳, 杨 慧
脑出血(intracerebral hemorrhage,ICH)是神经科常见病,致残率和死亡率高,严重地影响着人类健康。目前仍缺少有效的治疗手段,出血性脑损伤不仅由于血肿的占位效应及血肿对周边组织的直接破坏,继发性损伤也是出血性脑损伤的主要原因。近期研究认为细胞凋亡是出血性颅脑损伤的重要机制之一[1],本研究探讨促红细胞生成素(EPO)对大鼠脑出血周边组织caspase-3表达及细胞凋亡的影响,为EPO治疗脑出血提供新的依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 Wistar大鼠112只,雌雄不限,体重200~250g,由佳木斯大学实验动物中心提供,实验动物被随机分为脑出血组、脑出血+EPO干预组各56只,两组分别分为出血前、出血后4h、6h、12h、24h、72h、7d 这 7 个时间点,每时间点各 8只。
1.1.2 实验药品及试剂 原位凋亡检测试剂盒购自武汉博士德生物工程有限公司。促红细胞生成素购自山东阿华生物药业有限公司。其它试剂为实验室常用分析纯试剂。
1.2 方法
1.2.1 动物模型的制备及给药方法 采用立体定向自体血脑内注入法,按照包新民的《大鼠脑立体定位图谱》[2]进行定位,参照牛国忠[3]报导的方法及Deinsberger W等[4]的方法改进。Wistar大鼠均经10%水合氯醛(350mg/kg)腹腔注射麻醉,大鼠俯卧固定于立体定位仪上,头顶部剃毛消毒后正中矢状切开,切口长约1.5cm,钝性分离出前囟,在前囟后1mm,右旁4mm处用牙科钻钻一直径约1mm小孔。脑出血组大鼠,距鼠尾末端约2cm处剪断,取尾血50μl,将微量注射器推进至已钻孔内,进针5.5mm(相当于尾状核部)后先注入10μl,停针2min后注入剩余40μl血液,2min后退针1.5mm停留7min之后缓慢将针完全退出。缝合皮肤,回笼饲养。脑出血前组只进针不注血。脑出血加EPO干预组与脑出血组前述操作相同,并于术后即刻、1h、3h、24h、48h、72h 分别腹腔注射 EPO3000U/kg,脑出血组、出血前组注射等量生理盐水。大鼠清醒后无偏瘫体征,或血液沿针道返流,或血液进入脑室者弃用。
1.2.2 caspase-3免疫组织化学染色 严格按照说明书步骤进行,在高倍光镜下(×400),每张切片计数血肿周边不重叠5个视野阳性细胞数,计算平均值。
1.2.3 凋亡细胞的原位检测 TUNEL染色程序按试剂盒内的说明操作,细胞计数,高倍镜下(10×40)每片在血肿周边区、阳性细胞染色区随机选取2个视野,计算每个视野下阳性细胞数,取平均值。
2 结果
2.1 脑出血周边组织caspase-3表达的变化脑出血后4h起,出血周边脑组织caspase-3表达明显增高(P<0.01),24h达高峰,治疗组 caspase-3表达4h起也明显增高(P<0.01),24h达高峰,治疗组各时间点caspase-3表达明显低于脑出血组(P<0.01)(见表1)。
2.2 脑出血各组凋亡细胞计数 脑出血后12h起,出血周边脑组织凋亡细胞数明显增高(P<0.01),72h达高峰,治疗组凋亡细胞数12h起也明显增高(P <0.01),72h达高峰,治疗组 12h、24h、72h、7d凋亡细胞数明显低于脑出血组(P<0.01)(见表2)。
表1 脑出血后不同时间点caspase-3阳性细胞数表达的变化(个,;n=8)
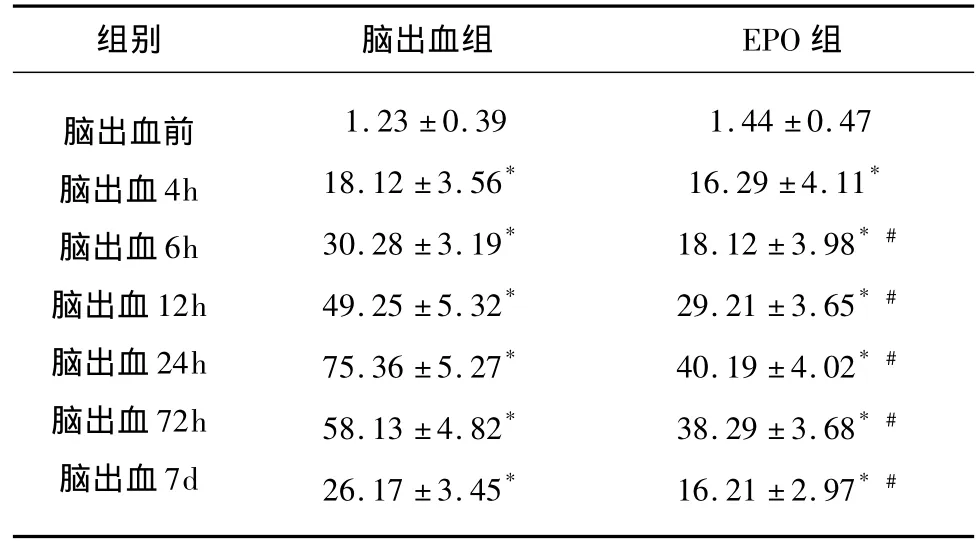
表1 脑出血后不同时间点caspase-3阳性细胞数表达的变化(个,;n=8)
与脑出血前比较*P<0.05;与脑出血对应时间点比较#P<0.05
组别 脑出血组 EPO组脑出血前脑出血4h脑出血6h脑出血12h脑出血24h脑出血72h脑出血7d 1.23 ±0.39 18.12 ±3.56*30.28 ±3.19*49.25 ±5.32*75.36 ±5.27*58.13 ±4.82*26.17 ±3.45*1.44 ±0.47 16.29 ±4.11*18.12 ±3.98*#29.21 ±3.65*#40.19 ±4.02*#38.29 ±3.68*#16.21 ±2.97*#
表2 脑出血后不同时间点凋亡细胞数变化(;n=8)
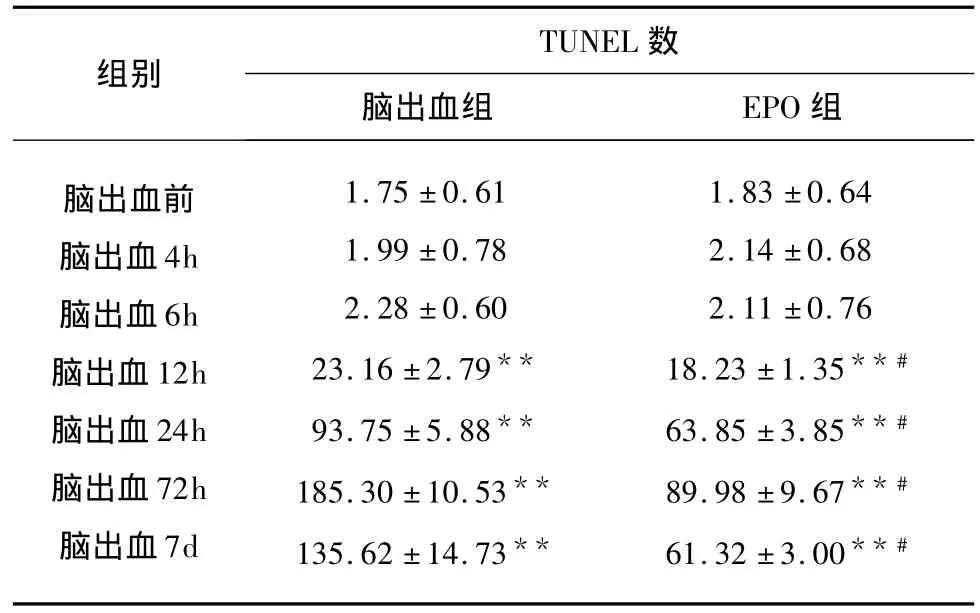
表2 脑出血后不同时间点凋亡细胞数变化(;n=8)
与脑出血前比较*P<0.05,**P<0.01;与脑出血对应时间点比较#P <0.01
TUNEL 数组别脑出血组 EPO组脑出血前脑出血4h脑出血6h脑出血12h脑出血24h脑出血72h脑出血7d 1.75 ±0.61 1.99 ±0.78 2.28 ±0.60 23.16 ±2.79**93.75 ±5.88**185.30 ±10.53**135.62 ±14.73**1.83 ±0.64 2.14 ±0.68 2.11 ±0.76 18.23 ±1.35**#63.85 ±3.85**#89.98 ±9.67**#61.32 ±3.00**#
3 讨论
脑出血是指原发性非外伤性脑实质内出血,是临床常见病,目前仍没有切实有效的治疗手段,出血性脑损伤不仅由于血肿的占位效应及血肿对周边组织的直接破坏,继发性损伤也是出血性脑损伤的主要原因。近期研究认为细胞凋亡机制参与了脑出血的继发性损伤,此机制为脑出血的防治提供了可能的新手段。神经细胞凋亡是脑出血后致残的重要原因,因此抑制脑出血周边组织细胞凋亡的机制可能成为治疗脑出血的新靶点。
细胞凋亡是由各种凋亡刺激信号始动,受细胞内源性基因、酶类和信号传导途径等调控的“瀑布式”激活过程。近来凋亡机制的研究发现,caspase家族在凋亡过程中起重要作用,凋亡的最后过程是通过caspase的激活而实现的。细胞凋亡过程受多种基因的调控,caspase是一类天冬氨酸特异性的半胱氨酸蛋白水解酶,而caspase-3是caspase家族中最重要的成员之一,是凋亡信号传导途径中重要的调控基因[5,6]。caspase-3为凋亡级联反应的终末执行酶,它的激活是细胞凋亡的最终共同途径,caspase-3可以通过裂解DNA修复蛋白或者直接破坏蛋白质、核酸和胞膜的结构,使细胞发生凋亡。正常情况下caspase酶原没有活性,必须通过激活,才能诱导凋亡。出血后启动凋亡级联反应的关键因素还没有确定。有作者认为脑出血的邻近组织受轻微缺血影响[7],大量激活的血液成分在出血后涌入大脑,其中细胞因子被活化后可导致信号转导介导凋亡[8]。促红细胞生成素是一种主要产生于肾脏的细胞因子,主要用于治疗贫血,EPO在缺血性脑血管疾病病理过程中具有保护作用。
EPO是一种多功能营养因子及神经保护因子,功能性的EPO受体在多种组织和器官中都有表达。近年来发现应用EPO能减少神经细胞凋亡,对缺血性脑损伤有保护作用[9~11]。外源性的EPO在脑缺血损伤下可以透过血脑屏障对抗缺血后的神经凋亡起到脑保护作用[12,13]。EPO 对脑出血的研究目前尚少报导。
本研究采用分组、药物干预及多时间点检测caspase-3及凋亡细胞来探讨EPO对脑出血的治疗提供实验依据。本实验发现大鼠脑出血后,大鼠脑出血周边组织caspase-3表达4h开始升高(P<0.01),大约24h左右caspase-3表达达峰值。大鼠脑出血周边组织6h出现凋亡细胞,12h上升显著(P<0.01),3d凋亡细胞达峰值,7d时仍存在较多凋亡细胞。EPO干预后,caspase-3表达及凋亡细胞与脑出血组对应时间点比较显著下降(P<0.01)。实验提示EPO能抑制caspase-3在脑出血后的表达,提示EPO通过抑制caspase-3的表达,抑制了脑出血后神经细胞的凋亡,减少受损神经细胞的死亡,促进神经细胞损伤后的恢复与存活,改善脑出血的预后,对脑出血后脑损伤有保护作用。
[1]Zhang XQ,Zhang ZM,Yin XL,et al.Exploring the optimal operation time for patients with hypertensive intracerebral hemorrhage:tracking the expression and progress of cell apoptosis of prehematomal brain tissues[J].Chin Med J,2010,123(10):1246 -1250.
[2]包新民,舒斯云.大鼠脑立体定位图谱[M].北京:人民卫生出版社,1991:28 -46.
[3]牛国忠,顾小林,华 洁,等.亚低温治疗实验性大鼠脑出血的保护作用研究[J].中华神经外科杂志,1999,15:288 -290.
[4]Deinsberg W,Vogel J,Kuschinsky W,et al.Experimental intracerebral hemorrhage:description of a double injection model in rats[J].Neurol Res,1996,18:475 -477.
[5]Markus HS.Cerebral perfusion and stroke[J].J Neurol Neurosurg Psychiatry,2004,5:353 -361.
[6]Memezawa H,Smith ML,Siesjo BK,et al.Penumbral tissues salvaged by reprefusion following middle cerebral artery occlusion in rats[J].Stroke,1992,23(4):552 -559.
[7]Jenkins A,Mendelow AD,Graham DI,et al.Experimental intracerebral hemotoma,the role of blood constituents in early ischemia[J].J Neurosurg,1990,4:45 -49.
[8]Mac Manus JP,Linik MD.Gene expression induced by cerebral ischemic:an apoptotic perspective [J].J Cereb Blood Flow Metab,1997,17:815.
[9]Siren AL,Fratelli M,Brines M,et al.Erythropoietin prevents neuronal apoptosis after cerebral ischemia and metabolic stress[J].Proc Natl Acad Sci USA,2001,98(7):4044 -4049.
[10]Sekiguchi Y,Kikuchi S,Myers RR,et al.Erythropoietin inhibits spinal neuronal apoptosis and pain following nerve root crush[J].Spine,2003,28(23):2577 -2584.
[11]Aydin A,Genc K,Akhisaroglu M,et al.Erythropoietin exerts neuroprotective effect in neonatal rat model of hypoxic-ischemic brain injury[J].Brain Dev,2003,25(7):494 -498.
[12]Juul SE,Anderson DK,Li Y,et al.Erythropoietin and erythropoietin receptor in the developing human central nervous system[J].Pediatr Res,1998,43(1):40 -49.
[13]Brines ML,Ghezzi P,Keenan S.Erythropoietin crosses the bloodbrain barrier to protect against experimental brain injury[J].Proc Natl Acad Sci USA,2000,97(19):10526 -10531.
