胎猪BMSC体外构建软骨的实验研究
2013-09-20刘李娜何爱娟周广东曹卫刚
刘李娜 何爱娟 周广东 曹卫刚
骨髓间充质干细胞 (Bone marrow mesenchymal stem cells,BMSCs)作为良好的软骨组织工程种子细胞来源,已被广泛认可[1]。与脂肪间充质干细胞、胚胎干细胞和脐带干细胞等相比,BMSCs具有来源广泛、体外扩增能力强、成软骨分化能力高[2-4]、异体移植免疫原性低[5]及伦理接受度高等优点。随着软骨体外构建技术的不断成熟,现在已经能利用BMSCs在体外构建出成熟的组织工程软骨[6]。但是,自体组织工程软骨构建周期长、种子细胞来源有限,难以使组织工程软骨的构建实现规模化、产品化。寻找合适的种子细胞是构建异体组织工程软骨的重要问题。根据年龄不同,BMSCs可分为成年期BMSCs、新生期BMSCs和胎龄期BMSCs。其中,成年期BMSCs已被证实可以作为软骨再生的种子细胞[1],但是作为异体移植软骨种子细胞来源,胎龄期BMSCs扩增能力更好,免疫原性更低[7]。为此,我们选取上海白猪为动物模型,通过比较胎猪BMSCs和成年猪BMSCs的细胞形态学、三向诱导能力及三维成软骨能力,进一步评估利用胎猪BMSCs作为软骨再生种子细胞来源修复异体软骨缺损的可行性。
1 材料和方法
1.1 主要试剂
高糖DMEM、低糖DMEM、胎牛血清、胰酶、三抗(Hyclone公司,美国);地塞米松、胰岛素、牛血清白蛋白、L-谷氨酰胺、维生素C、油红O染料(Sigma公司,美国);转化生长因子-β(TGF-β)、胰岛素样生长因子(IGF)、碱性成纤维细胞生长因子(bFGF)、胰岛素转铁蛋白亚硒酸 (ITS)(R&D公司,美国);PGA(国睿生命科技有限公司,中国)。
1.2 实验方法
1.2.1 胎猪BMSCs、成年猪BMSCs的分离与培养
胎猪BMSCs的分离与培养[8]:孕猪(孕期70 d)肌肉注射氯胺酮麻醉,建立静脉通道,按常规开腹手术准备,左侧卧位,沿最后一肋下方10 cm处平肋弓作10 cm切口,取出子宫,切开,暴露胎猪,迅速结扎脐带后置入75%乙醇,浸泡30 min,在超净台铺无菌手术巾,取出胎猪四肢长骨,用血管钳钳碎长骨,用含10%胎牛血清的低糖DMEM冲洗,将冲洗出的骨髓液接种于10 cm2培养皿,置入37℃、5%CO2培养箱中培养24~72 h,弃悬浮细胞,加入含5 ng/mL bFGF的新鲜培养基继续培养,每3天换液一次,待细胞长至80%融合后,用0.25%的胰酶消化并传代。
成年猪BMSCs的分离与培养[9-10]:成年猪肌注氯胺酮麻醉后,于髂前上棘处剃毛、消毒铺巾,以肝素润湿骨穿针后穿刺,每只猪抽取10~15 mL骨髓液。骨髓液中加入20 mL低糖DMEM,1 800 r/min离心8 min,弃上层脂肪悬液,以每皿2 mL接种于10 cm2培养皿中,置入37℃、5%CO2培养箱中培养。5 d后吸去原培养液,用无菌PBS缓冲液冲洗,尽量洗去培养液中的血细胞,观察细胞生长状况。加入含5 ng/mL bFGF的新鲜培养基继续培养,每3天换液一次,待细胞长至80%融合后,用0.25%的胰酶消化并传代。
1.2.2 绘制细胞增殖曲线
取第3代胎猪 BMSCs、成年猪 BMSCs,胰酶消化,制备成单细胞悬液,以5 000个/孔的细胞密度接种于96孔板。于接种后1~7 d,每孔加入10 μL CCK-8试剂,轻轻混匀后置37℃、5%CO2细胞培养箱中培养4 h。应用酶标仪检测450 nm每组OD值,每天测得数据取3孔平均值,统计分析,绘制增殖曲线。
1.2.3 胎猪BMSCs、成年猪BMSCs多向分化比较
1.2.3.1 成脂肪分化及检测
取第3代胎猪BMSCs和成年猪BMSCs的细胞在6孔板中培养2 d,待细胞融合80%左右后,加入成脂诱导培养液(含10%胎牛血清,2 nM谷氨酰胺,0.5 mM 异丁基甲基黄嘌呤,1 μM 地塞米松,10 μM胰岛素和200 μM吲哚美辛的高糖DMEM培养液),每3天换液一次,以普通培养液为对照组。诱导3周后行油红染色。
1.2.3.2 成骨分化及检测
取第3代胎猪BMSCs和成年猪BMSCs的细胞在6孔板中培养2 d,待细胞融合80%左右后,加入成骨诱导培养液(含10%胎牛血清,2 mM谷氨酰胺,10 mg/L 维生素 C,2.16 g/L β-磷酸甘油,40 ng/mL地塞米松的低糖DMEM培养液),每3天换液一次,以普通培养液为对照组。诱导3周后行茜素红染色。
1.2.3.3 成软骨分化及检测
取第3代胎猪和成年猪BMSCs各0.4×106个细胞在离心管中离心形成pellet后,加入成软骨诱导培养液 (含2 mM谷氨酰胺,10 ng/mL转化生长因子-1,4 mM HCl,1%BSA,50 ng/mL 胰岛素生长因子-1,40 ng/mL 地塞米松,50 μg/mL 维生素 C,40 μg/mL Proline,1×ITS的高糖DMEM培养液),每3天换液一次,以普通培养液作为对照组。诱导3周后行Ⅱ型胶原免疫组织化学染色。
1.2.4 组织工程软骨的体外构建
1.2.4.1 支架材料的准备
取14 mg PGA加入2 mL针筒中加压塑形,滴加1%的PLA定型,75%乙醇浸泡,无菌PBS冲洗3次,吸去PBS,加培养液预培养12 h。
1.2.4.2 接种种子细胞及成软骨诱导
取第4代胎猪和成年猪BMSCs以1×108cells/mL的浓度接种于无菌PGA/PLA支架材料上,接种后4 h用含10%胎牛血清的低糖DMEM培养液培养,48 h后换软骨诱导液培养。体外诱导8周后,取材。
1.2.5 组织工程软骨的评价
1.2.5.1 大体观察
观察取材标本的大小、形状、质地和色泽。
1.2.5.2 组织学检测
取材,4%多聚甲醛固定24 h,脱水,石蜡包埋,切片,HE、Safranine-O染色及Ⅱ型胶原免疫组化染色,观察标本的组织结构、软骨基质着色及Ⅱ型胶原表达情况。
1.2.5.3 GAG含量测定
Alcian Blue法检测构建的软骨组织中GAG的含量。
1.2.5.4 总胶原含量测定
利用羟脯氨酸试剂盒检测构建软骨组织中总胶原的含量。
1.3 统计分析
计数资料均以均数±标准差表示。采用SPSS 19.0统计软件包进行分析,采用单因素方差分析,P<0.05为差异具有统计学意义。
2 结果
2.1 细胞形态学观察
镜下显示BMSCs呈梭形、三角形,胞质圆润透亮,呈集落样贴壁生长。与成年猪BMSCs相比,胎猪BMSCs细胞形态比较狭长,细胞核较大,生长速率较快,传代后形态无明显改变(图1)。
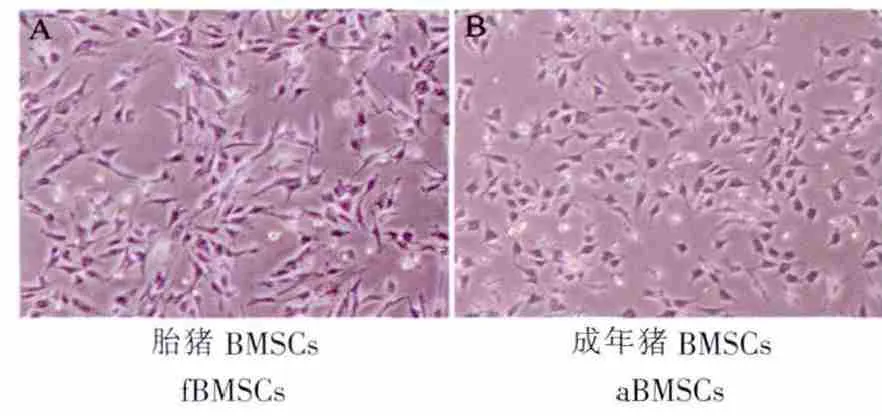
图1 体外培养的BMSCs细胞形态(第3代,100×)Fig.1 The morphology of the tissue engineered cartilage in vitro(P3,100×)
2.2 细胞增殖曲线
细胞增殖曲线显示,传代培养的潜伏期约为24~36 h,传代培养细胞的对数增殖期约为2~3 d,对数增殖期后第5天进入平台期。胎猪BMSCs和成年猪BMSCs倍增时间分别为30 h和60 h。细胞每传一代,细胞数增长2倍。从生长曲线中可以看出,胎猪BMSCs的增殖速度明显快于成年猪BMSCs(图2)。

图2 胎猪BMSCs和成年猪BMSCs增殖曲线Fig.2 The growth curve of fetal pig BMSCs and adult pig BMSCs
2.3 胎猪BMSCs、成年猪BMSCs三向诱导对比
成骨诱导21 d后茜素红染色,胎猪BMSCs镜下可见大块深染钙结节分布,体积、数量明显高于成年猪BMSCs。成脂诱导21 d后Safranine-O染色,胎猪BMSCs细胞中可见大量密集圆泡样脂滴,含有脂滴的细胞数目和脂滴体积明显高于成年猪BMSCs。成软骨诱导21 d后行Ⅱ型胶原染色,胎猪BMSCs诱导成pellet和成年猪BMSCs成pellet相比,组织学无明显差别(图3)。

图3 BMSCs成骨、成脂和成软骨三向诱导Fig.3 The osteogenic,adipogenic and chondrogenic differentiation of BMSCs

图4 体外构建组织工程软骨大体观Fig.4 The gross observation of the tissue engineered cartilage in vitro
2.4 体外构建组织工程软骨大体观
体外经过8周的成软骨诱导,新生软骨均呈乳白色,有一定弹性及韧性,大小和支架材料接近,未见回缩。胎猪BMSCs构建的软骨与成年猪BMSCs相比,软骨弹性更好,中空现象不明显(图4)。
2.5 体外构建组织工程软骨组织学检测
2.5.1 HE染色
胎猪BMSCs构建的软骨陷窝结构比较多见,内有细胞核,核大多位于陷窝中央,核仁明显,周围有蓝染的细胞外基质沉积,中空现象不明显。成年猪BMSCs的陷窝结构比较幼稚,并可见较多的散在残留的未降解的PGA纤维纵横排列在许多陷窝之间,中空现象明显(图5)。

图5 体外构建软骨(8周)组织学和免疫组化染色(40×)Fig.5 The histology and immunohistochemistry staining of the tissue engineered cartilage in vitro(8 weeks)(40×)
2.5.2 Safranin-O 染色
胎猪BMSCs和成年猪BMSCs构建的软骨均产生了富含GAG的细胞外基质,胎猪BMSCs构建的软骨比成年猪BMSCs具有更强烈的GAG表达,在中心区域尤为明显(图6)。

图6 体外构建软骨(8周)总胶原含量及GAG含量Fig.6 The total collagen content and GAG content of the tissue engineered cartilage in vitro(8 weeks)
2.5.3 Ⅱ型胶原免疫组化
两组软骨中Ⅱ型胶原的聚集、分布与aggrecan相似,成年猪BMSCs构建的软骨在组织的外周区域Ⅱ型胶原高度表达,而胎猪BMSCs具有更均质和强烈的表达(图5)。体外GAG检测表示,胎猪BMSCs和成年猪BMSCs均产生了含Ⅱ型胶原和aggrecan的软骨细胞样的ECM,但是胎猪BMSCs比成年猪BMSCs具有更多的ECM分泌和更加均一的分布。
2.6 体外构建组织工程软骨定量测定结果比较
体外诱导8周,胎猪BMSCs和成年猪BMSCs构建软骨的平均GAG含量分别为(40.37±3.24)mg/g和 (26.58±2.67)mg/g,成年猪BMSCs构建的软骨GAG含量仅达到胎猪BMSCs构建的软骨GAG含量的65.8%,两组间存在显著差异(P<0.01)。两组标本平均总胶原含量分别为 (2.07±0.16)mg/g和(1.15±0.20) mg/g, 成年猪 BMSCs构建的软骨总胶原含量仅达到胎猪BMSCs构建的软骨总胶原含量的 55.6%,两组间存在显著差异(P<0.01)(图 6)。
3 讨论
组织工程技术的兴起为软骨缺损修复提供了新的治疗途径。BMSCs是目前软骨构建的最佳种子细胞之一,在关节软骨缺损的修复中已经取得了积极的进展[11-12]。但是,自体来源的BMSCs来源有限、体外构建时间长,难以满足软骨构建产品化的需求。因此,寻找合适的种子细胞是组织工程软骨产品化的首要问题。研究发现,BMSCs具有免疫调节功能[13],而胚胎来源的BMSCs和成体BMSCs相比,具有体外扩能增力强、免疫原性低[7]等特点,成为潜在的同种异体再生软骨的种子细胞。然而,胚胎来源的BMSCs目前尚缺乏较为系统的研究。本研究拟通过对胎猪BMSCs和成年猪BMSCs体外构建软骨能力进行系统比较,初步探讨胚胎BMSCs构建软骨组织的可行性和可能存在的优势。
在形态上,BMSCs可贴壁生长,以梭形的成纤维样细胞为主,有研究发现BMSCs在体外培养过程中多次传代后细胞为长梭形,核异染色质减少,核仁明显,胞浆中可见粗面内质网,分泌活跃,表明其可能为一种自我更新能力已经很弱的终末分化细胞[14]。然而,我们的研究发现,胎猪BMSCs增殖速度快,不易老化,并且细胞贴壁形态至第3代未发生改变,保持梭形或倒三角形,细胞均匀透亮,提示胎猪BMSCs能够体外维持自身生长特性。
三向诱导和体外三维软骨构建结果提示,胎猪BMSCs比成年猪BMSCs有更好的干细胞特性,其成骨和成脂肪能力均强于成年猪BMSCs,是组织工程骨、软骨和脂肪良好的种子来源。
胎猪BMSCs和成年猪BMSCs诱导成pellet的组织学结果,没有明显差别,但是两种细胞体外三维构建软骨的组织学和定量结果则有明显差别。胎猪BMSCs构建的软骨明显优于成年猪BMSCs构建的软骨,胎猪BMSCs作为种子细胞体外构建的软骨更加均质,中空现象不明显,细胞外基质更加丰富。可能的原因有:①胎龄间充质干细胞特性更好,成软骨能力更强;②胎龄BMSCs生成软骨的速度快于成年BMSCs,在材料未降解之前已经生成软骨;③胎龄BMSCs相比于成年BMSCs有更强的抵抗材料降解形成的酸性代谢产物的能力。综合以上的原因,胎龄BMSCs在三维支架上构建软骨的能力优于成年BMSCs,胎龄BMSCs能构建出质量更好的软骨。
综上所述,本研究通过对胎猪BMSCs和成年猪BMSCs作为种子细胞构建组织工程软骨进行系统比较,证明胎猪BMSCs在体外培养体系中能构建出质量更好的软骨组织,为软骨组织工程产品化提供了新的前景和希望。但是胎龄BMSCs作为种子细胞构建的软骨能否成功修复同种异体软骨缺损,尚有待进一步的实验研究。
[1] Chen FH,Rousche KT,Tuan RS.Technology Insight:adult stem cells in cartilage regeneration and tissue engineering[J].Nat Clin Pract Rheumatol,2006,2(7):373-382.
[2] Bosnakovski D,Mizuno M,Kim G,et al.Chondrogenic differentiation of bovine bone marrow mesenchymal stem cells(MSCs)in different hydrogels:influence of collagen type II extracellular matrix on MSC chondrogenesis[J].Biotechnol Bioeng,2006,93(6):1152-1163.
[3] Pittenger MF,Mackay AM,Beck SC,et al.Multilineage potential of adult human mesenchymal stem cells[J].Science,1999,284(5411):143-147.
[4] Im GI,Jung NH,Tae SK.Chondrogenic differentiation of mesenchymal stem cells isolated from patients in late adulthood:the optimal conditions of growth factors[J].Tissue Eng,2006,12(3):527-536.
[5] Zhao S,Wehner R,Bornhauser M,et al.Immunomodulatory properties of mesenchymal stromal cells and their therapeutic consequences for immune-mediated disorders[J].Stem Cells Dev,2010,19(5):607-614.
[6] Mackay AM,Beck SC,Murphy JM,et al.Chondrogenic differentiation of cultured human mesenchymal stem cells from marrow[J].Tissue Eng,1998,4(4):415-428.
[7] Zhang ZY,Teoh SH,Chong MS,et al.Superior osteogenic capacity for bone tissue engineering of fetal compared with perinatal and adult mesenchymal stem cells[J].Stem Cells,2009,27(1):126-137.
[8] Weissman IL.Stem cells:units of development,units of regeneration,and units in evolution[J].Cell,2000,100(1):157-168.
[9] Azizi SA,Stokes D,Augelli BJ,et al.Engraftment and migration of human bone marrow stromal cells implanted in the brains of albino rats--similarities to astrocyte grafts[J].Proc Natl Acad Sci U S A,1998,95(7):3908-3913.
[10] Coelho MJ,Fernandes MH.Human bone cell cultures in biocompatibility testing.Part II:effect of ascorbic acid,beta-glycerophosphate and dexamethasone on osteoblastic differentiation[J].Biomaterials,2000,21(11):1095-1102.
[11] Zhou G,Liu W,Cui L,et al.Repair of porcine articular osteochondral defects in non-weightbearing areas with autologous bone marrow stromal cells[J].Tissue Eng,2006,12(11):3209-3221.
[12] Im GI,Kim DY,Shin JH,et al.Repair of cartilage defect in the rabbit with cultured mesenchymal stem cells from bone marrow[J].J Bone Joint Surg Br,2001,83(2):289-294.
[13] Di Nicola M,Carlo-Stella C,Magni M,et al.Human bone marrow stromal cells suppress T-lymphocyte proliferation induced by cellular or nonspecific mitogenic stimuli[J].Blood,2002,99(10):3838-3843.
[14] Mori M,Sadahira Y,Awai M.Characteristics of bone marrow fibroblastic colonies(CFU-F)formed in collagen gel[J].Exp Hematol,1987,15(11):1115-1120.
