不同碳源对海洋假单胞菌PT-8合成胞外多糖的抗氧化性的影响
2013-09-19张佳佳,屈菲,万慧萍,叶淑红,刘峻屹,杨富雄
张 佳 佳,屈 菲,万 慧 萍,叶 淑 红,刘 峻 屹,杨 富 雄
(1.大连工业大学 辽宁省食品生物技术重点实验室,辽宁 大连 116034;2.辽宁省出入境检验检疫局,辽宁 大连 116001;3.大连工业大学 轻工与化学工程学院,辽宁 大连 116034)
0 引 言
海洋微生物由于其高盐、高压、低温、寡营养的特殊生活环境,导致其体内多糖的合成过程与陆地生物有所不同,具有产生结构新颖、功能独特的新型活性胞外多糖(extracellular polysaccha-rides,EPS)的潜力[1]。目前为止研究的海洋微生物胞外多糖在清除自由基及抗氧化方面显示了广泛的生物活性,因此,其作为天然抗氧化剂具有很高的开发价值。
碳源是合成微生物胞外多糖必需的营养元素,因此选取的碳源不同,可能会使其合成的多糖在分子结构、理化性质等方面有所差异,进而对多糖生物活性产生影响[2]。陈晓红、Fukuda等[3-4]研究的结果表明,以不同碳源培养得到的胞外多糖,分子结构、单糖组成与分子质量分布等存在差异,而这与胞外多糖黏度变化有着一定联系,多糖的黏度因分子质量的增大而增加。关于不同碳源对海洋假单胞菌EPS抗氧化活性的影响研究鲜有报道。本实验采用3种不同碳源发酵生产EPS,并进行分离纯化,对这3种EPS的体外抗氧化活性进行研究,以期为开发更高活性的天然抗氧化剂寻找新方法,为进一步探讨多糖构效关系奠定基础。
1 材料与方法
1.1 实验材料
1.1.1 菌 株
假单胞菌PT-8:由实验室自深海海泥中分离、鉴定并保藏。
1.1.2 培养基
种子培养基:葡萄糖5g,蛋白胨10g,氯化钠5g,牛肉膏3g,水1 000mL。
发酵培养基:蔗糖35g,牛肉膏20g,氯化钠55g,K2HPO41g,MgSO41g,KH2PO40.5g,MnSO40.5g,水1 000mL,pH 7.5。
1.1.3 试剂与仪器
主要试剂:T-系列葡聚糖标准品(M=120、2 700、6 700ku)、DEAE-52、Sephadex G-100、1,1-二苯基苦基苯肼(DPPH)均为Sigma公司产品;苯酚、硫酸、1,10-菲咯啉溶液、邻苯三酚、硫酸亚铁、三氯乙酸、过氧化氢、无水乙醇等均为分析纯。
主要仪器:高效液相色谱仪(Waters),真空冷冻干燥机,高速冷冻离心机,紫外可见分光光度计。
1.2 实验方法
1.2.1 胞外多糖的制备
用醇沉法制备胞外多糖[1],对应不同碳源,分别命名为 EPSS、EPSG、EPSM。用苯酚-硫酸法[5]测定多糖含量,进行抗氧化实验。
1.2.2 HPLC测定PT-8EPS的分子质量
HPLC检测条件:色谱柱为 Waters UltrahydrogelTMm1000Column(7.8mm×300mm);流动 相 为 0.2mol/L Na2SO4;体 积 流 量 为0.5mL/min;柱温为35℃;进样量为20μL;最大柱压为2.5MPa;Waters-2414示差检测器检测。
标准曲线的制作:用已知分子质量的系列标准葡聚糖(M=120、2 700、6 700ku),绘制标准曲线[6]。
样品的测定:多糖纯品溶液进样20μL,根据出峰时间,对照标准曲线。根据回归方程计算样品的分子质量。
1.3 不同碳源多糖抗氧化性的测定
1.3.1 多糖还原力的测定
铁氰化钾法测定多糖的还原力,以同浓度VC作阳性对照[7]。
1.3.2 多糖对二苯基苦基苯肼自由基(DPPH·)的清除作用
测定多糖对DPPH的清除作用,以95%乙醇调零,在517nm处测定吸光度值A1,无水乙醇代替DPPH溶液的吸光度为A2,无水乙醇代替样品溶液的吸光度值为A0。以同浓度VC代替多糖作对比实验。

1.3.3 多糖对羟自由基(·OH)的清除作用
采用Fenton体系测定多糖对羟自由基(·OH)的清除作用,以蒸馏水调零,以VC作对比[8]。清除率按式(2)计算:

式(2)中:A′0为不加样品、加入过氧化氢时的吸光度;A′1为加入样品和过氧化氢时的吸光度;A′2为不加样品和过氧化氢时的吸光度。
1.3.4 多糖对超氧阴离子自由基(O-2·)的清除作用
邻苯三酚自氧化法测定多糖对超氧阴离子自由基(O-2·)的清除作用,结果按式(3)计算:

式(3)中:A″0为不加样品、加入邻苯三酚时的吸光度;A″1为加入样品和邻苯三酚时的吸光度;A″2为加入样品、不加邻苯三酚时的吸光度。
2 结果与讨论
2.1 不同碳源对菌体生长和EPS合成量的影响
假单胞菌PT-8能利用供试的3种碳源生长并合成EPS,其中以蔗糖为碳源时EPS合成量最大,达到6.98g/L,以葡萄糖和麦芽糖为碳源时EPS的产量相对较少,分别为6.35和5.93g/L。研究发现生物量和EPS产量呈现出一定相关性,生物量高的培养基中EPS的合成量也较大。
2.2 不同碳源合成的EPS的分子质量
多糖的构效关系非常复杂,其中多糖的分子质量大小是影响多糖生物活性的一个重要因素[9]。本实验中采用HPLC测定3种多糖的分子质量,洗脱曲线如图1所示,均呈单一对称的峰,表明3种多糖都是均一多糖。

图1 HPLC测定 EPSS、EPSG、EPSM 的分子质量分布Fig.1 Molecular weight distribution of EPSS,EPSG,EPSMdetermined by HPLC
根据标准曲线lgM=11.282 7-0.331 6t(R2=0.998),计算得 EPSS、EPSG、EPSM的分子质量分别为7.3、17.8和19.2ku,其中EPSs分子质量最小。结果说明假单胞菌PT-8以不同碳源合成的多糖分子质量不同,这可能会导致多糖溶解度、黏度等的不同,进而影响其生理活性[10]。
2.3 不同碳源合成的EPS的抗氧化性
2.3.1 还原力的测定
还原力的大小与抗氧化活性有着密切的关系,是用来评价抗氧化剂活性的常用方法。由图2可知,不同的多糖浓度和供试组分对还原力有着明显的影响,还原力的大小随着多糖浓度的增加而增加,但EPSS、EPSG和EPSM各浓度下的还原力均小于VC。对EPSS、EPSG、EPSM的对比分析可知,EPSS的还原力大于EPSG和EPSM,其余两种多糖的还原力差别不明显,可见低分子质量的多糖表现出较强的还原力。

图2 EPS和VC的还原力Fig.2 The reducing power of EPS and VC
2.3.2 多糖对DPPH自由基的清除作用
由图3可以看出,在实验所设定的浓度范围内,供试的3种多糖对DPPH均有一定程度的清除能力,但均小于VC。EPSS、EPSG、EPSM对DPPH·的清除能力均随着浓度的增加而缓慢增加,但仍呈上升趋势。3种不同碳源多糖对DPPH·的清除能力强弱依次为EPSS>EPSG>EPSM。

图3 EPS和VC对DPPH·的清除作用Fig.3 The scavenging effect of EPS and VCon DPPH·
2.3.3 多糖对羟自由基(·OH)的清除作用
如图4所示,3种不同碳源胞外多糖清除·OH的能力呈量效关系。不同碳源多糖对·OH的清除能力优于VC,具有较强的清除·OH的能力。3种不同碳源多糖对·OH的清除能力强弱依次为EPSS>EPSG>EPSM。
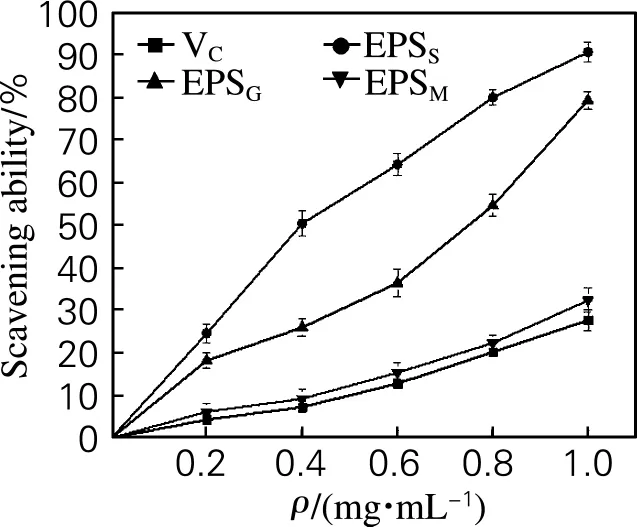
图4 EPS和VC对·OH的清除率Fig.4 The scavenging ability of EPS and VCto·OH
2.3.4 多糖对超氧阴离子自由基(O-2·)的清除作用
由图5可知,当溶液质量浓度达到0.3mg/mL时,EPSS、EPSG、EPSM对O-2·的清除率分别达到83.65%、25.17%、18.68%,均小于同浓度下的VC,其清除率为93.43%。EPSS清除O-2·的能力远远超过EPSG、EPSM而接近于VC。EPSG清除O-2·的能力略微大于EPSM。3种不同碳源多糖对超氧阴离子自由基的清除能力强弱依次为EPSS>EPSG>EPSM。

图5 EPS和VC对O-2·的清除率Fig.5 The scavenging ability of EPS and VCto O-2·
还原力和清除自由基能力的实验结果表明,一定浓度条件下,3种不同碳源合成的多糖均有一定的还原力和清除自由基的能力,并随着多糖质量浓度的增加逐渐增强。其中清除羟自由基和超氧阴离子自由基的能力较强,但在同一浓度下的还原力和清除DPPH自由基能力均小于VC。通过对比不同碳源EPS的抗氧化能力发现,其强弱顺序依次为EPSS>EPSG>EPSM,这与分子质量大小顺序一致,即分子质量小的EPSS的抗氧化性最强,而EPSG和EPSM的分子质量接近,它们的抗氧化活性也没有明显差别,研究表明这并不是巧合,如张凡华[11]研究的南瓜小分子质量的多糖显示了较好的抗氧化活性。说明分子质量大小与多糖的抗氧化能力之间存在密切联系。其原因可能是分子质量越大,体积越大,越不利于多糖跨越多重细胞膜障碍进入生物体内发挥生物学活性,分子质量小的多糖通常具有溶解性好、黏度低等优势,使其更容易结合活性位点。但分子质量过低也无法形成产生活性的聚合结构[12]。因此,分子质量大小适当的多糖活性较高。
3 结 论
本实验研究了不同碳源对假单胞菌PT-8合成胞外多糖的产量、分子质量及其体外抗氧化活性的影响。结果表明,假单胞菌PT-8可利用不同碳源合成不同产量的胞外多糖,且不同碳源合成的多糖分子质量不同;抗氧化实验结果表明,分子质量小的多糖抗氧化活性更强,这一结果与之前国外的有关报道[13]一致,对于该菌株所产胞外多糖的结构和功能的关系研究以及用于抗氧化剂的生产有一定意义。
[1]孙红梅,张星星,白玉,等.海洋假单胞菌胞外多糖的抗氧化性[J].大连工业大学学报,2012,31(6):395-398.(SUN Hong-mei,ZHANG Xing-xing,BAI Yu,et al.Antioxidant effects of extracellular polysaccharides from a marinePseudomonas[J].Journal of Dalian Polytechnic University,2012,31(6):395-398.)
[2]RAO Y M,SURESH A K,SURAISHKUMAR G K.Free radical aspects ofXanthomonascampestriscultivation with liquid phase oxygen supply strategy[J].Process Biochemistry,2003,38(9):1301-1310.
[3]陈晓红,董明盛,黄文利,等.不同碳源对LactococcusFML02-8合成胞外多糖的影响[J].无锡工业大学学报,2004,23(6):13-18.
[4]FUKUDA K,SHI T,NAGAMI K,et al.Effects of carbohydrate source on physicochemical properties of the exopolysaccharide produced byLactobacillusfermentumTDS030603in a chemically defined medium[J].Carbohydrate Polymers,2010,79(4):1040-1045.
[5]徐光域,颜军.硫酸-苯酚定糖法的改进与初步应用[J].食品科学,2005,26(8):342-345.
[6]CHEN Yin,MAO Wen-jun,TAO Hong-wen,et al.Structural characterization and antioxidant properties of an exopolysaccharide produced by the mangrove endophytic fungusAspergillussp.Y16[J].Bioresource Technology,2011,102(17):8179-8184.
[7]DORMAN H J D,HILTUNEN R.Fe(Ⅲ)reductive and free radical-scavenging properties of summer savory(SaturejahortensisL.)extract and subfractions[J].Food Chemistry,2004,88(2):193-199.
[8]LIU Jun,LUO Jian-guang,YE Hong,et al.Production,characterization and antioxidant activities in vitro of exopolysaccharides from endophytic bacteriumPaenibacilluspolymyxaEJS-3[J].Carbohydrate Polymers,2009,78(2):275-281.
[9]郝杰,查学强,鲍素华,等.霍山石斛不同分子量多糖的抗氧化研究[J].食品科学,2009,30(15):94-98.
[10]王兆梅,李琳.活性多糖构效关系研究评述[J].现代化工,2002,22(8):18-21.
[11]张凡华,石宝霞,张树明,等.低分子量南瓜多糖的提取、纯化及结构初步研究[J].食品工业科技,2008(3):93-95.
[12]李越鲲,周旋.不同分子量枸杞多糖体外抗氧化活性研究[J].安徽农业科学,2012,40(29):14174-14175.
[13]KLEEREBEZEM M,BOELS I C,GROOT M N,et al.Metabolic engineering ofLactococcuslactis:the impact of genomics and metabolic modelling[J].Journal of Biotechnology,2002,98(2/3):199-213.
