海参卵中类胡萝卜素提取条件的优化
2013-09-19杨利伟,许兆滨,张春枝,杨希,毕妍
杨 利 伟,许 兆 滨,张 春 枝,杨 希,毕 妍
(1.大连工业大学 生物工程学院,辽宁 大连 116034;2.辽宁省大连海洋渔业集团公司,辽宁 大连 116113)
0 引 言
类胡萝卜素(carotenoids)是一种天然产物的总称。迄今为止,人类在自然界中已发现600多种天然的类胡萝卜素[1]。天然类胡萝卜素主要存在于高等植物中,在藻类、微生物和海洋软体动物壳体内也有分布。目前类胡萝卜素的生产方法主要有化学合成、天然提取和微生物发酵[2]。类胡萝卜素在食品、饲料、医药、保健品、化妆品等领域已被广泛应用。类胡萝卜素在防癌、增强免疫力、保护细胞免受损伤、增强肌肉耐力等方面都有特殊的贡献[3-5]。
海参卵(sea cucumber ovum),俗称海参花,是海参加工过程中的副产物。海参卵和海参体壁有着同样丰富的营养成分,如多糖、核酸、性腺色素等[6]。近年来中国海参产业发展迅速,而海参卵的回收利用一直被人们所忽视,对其中应用价值巨大的类胡萝卜素类物质的提取分析意义重大。本实验以海参加工副产物海参卵为原料,提取其中的类胡萝卜素类物质,结合现代分析方法,优化了提取条件,为海参卵的综合利用及类胡萝卜素的深入研究提供了参考。
1 材料与方法
1.1 材 料
海参卵,大连棒棰岛海产企业集团有限公司;乙酸乙酯、无水乙醇、丙酮、石油醚,天津科密欧化学试剂有限公司;去离子水,实验室供应。
1.2 仪 器
722S分光光度计,上海精密科学仪器有限公司;台式高速离心机(TGL-16G),上海安亭科学仪器厂;恒温水浴锅(HS-3001),太仓市科教仪器厂;干燥箱(766-3型远红外),上海三星电热仪器厂。
1.3 方 法
1.3.1 原料含水量测定
称取冻鲜海参肠卵10g放入105℃恒重的玻璃皿中,105℃烘干至恒重,减重法测定。水分质量分数计算公式为
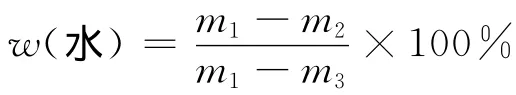
式中:w(水)为水的质量分数,%;m1为称量瓶和试样质量,g;m2为称量瓶和试样干燥后质量,g;m3为称量瓶的质量,g。
1.3.2 类胡萝卜素的提取
类胡萝卜素属于脂溶性色素,可采用有机溶剂浸提法,不同结构的类胡萝卜素要使用不同的溶剂进行萃取[7]。称取一定量的原料,按比例加入提取溶剂,在恒温下浸提一定时间,离心得类胡萝卜素提取液,迅速测定吸光值。
1.3.3 类胡萝卜素的定性定其量分析
薄层层析法定性,以硅胶板为固定相,以V(氯仿)∶V(甲醇)=95∶5为展开剂,对海参卵有机溶剂提取液和类胡萝卜素标准品进行薄层层析,硝酸银喷雾显色[8],对比样品Rf值、斑点颜色和斑点大小,初步判定提取液的成分。
分光光度法定量,按照最佳提取条件提取得到的提取液,以空白试剂调零,在类胡萝卜素最大吸收波长450nm下测定吸光值。类胡萝卜素质量分数按照下面公式计算[9]:

式中:w(类胡萝卜素)为类胡萝卜素质量分数,μg/g;OD450为吸光值;D为稀释倍数;V为提取溶剂所需体积,mL;E1%1cm为百分消光系数,此处取值0.25;m为原料质量,g。
1.3.4 提取溶剂的选择
选取丙酮、乙酸乙酯、石油醚、乙醇4种常用溶剂,在其他条件一致的前提下,比较4种溶剂的提取效果,确定最佳提取溶剂。
1.3.5 提取级数与溶剂量的选择
考察倍数溶剂一次提取与分级提取的关系。首先选择10倍溶剂量一次提取,然后将10倍溶剂量分成5倍、3倍、2倍3个等级,浸提3次,结果同一次提取对比,比较类胡萝卜素质量分数与溶剂用量的关系。
1.3.6 海参卵中类胡萝卜素最优提取条件的确定
首先进行单因素试验,以料液比、提取时间、提取温度为因素,其他条件一致的情况下,考察单一因素的不同水平对提取效果的影响。在单因素试验的基础上,选用L9(33)正交试验设计,对海参卵中类胡萝卜素的提取工艺进行优化,确定最适工艺条件。
2 结果与分析
2.1 原料含水量测定结果
根据恒重法测定原料的水分质量分数,按照实验方法“1.3.1”中公式计算样品中水的质量分数,测3组取均值,结果表明冻鲜海参卵中水的质量分数为90.56%。
2.2 薄层层析结果
以V(氯仿)∶V(甲醇)=95∶5为展开剂,以类胡萝卜素标准品为对照,进行薄层层析,结果如图1所示。
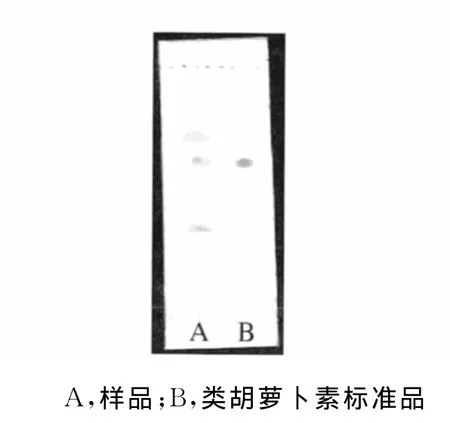
图1 薄层色谱图Fig.1 The thin layer chromatogram
第2个斑点与类胡萝卜素标准品斑点Rf值一致,斑点形状和硝酸银显色后颜色基本一致,可以初步确定样品中该组分为类胡萝卜素。
2.3 提取溶剂的选择
精确称取4份冻鲜海参卵0.3g放置于离心管中,分别加入3mL的丙酮、乙酸乙酯、石油醚、乙醇,迅速转入预热好的40℃的水浴锅中,避光浸提2h,间歇振荡。提取后离心,取上清液,在450nm波长可见光下以提取溶剂为空白对照,测定其吸光值,并计算出类胡萝卜素质量分数,结果见图2。由图2可以看出,乙酸乙酯的提取效果最好,且其毒性最小,价格适中,故选用乙酸乙酯为提取溶剂进行后面的单因素试验。
2.4 提取级数与溶剂量的选择
准确称取0.3g原料2份,1份使用10倍溶剂1次提取,另1份选用10倍溶剂量分级提取,第1次提取溶剂量为5mL,第2次为3mL,第3次为2mL,提取率按照最优提取条件下类胡萝卜素质量分数计算,结果见表1。
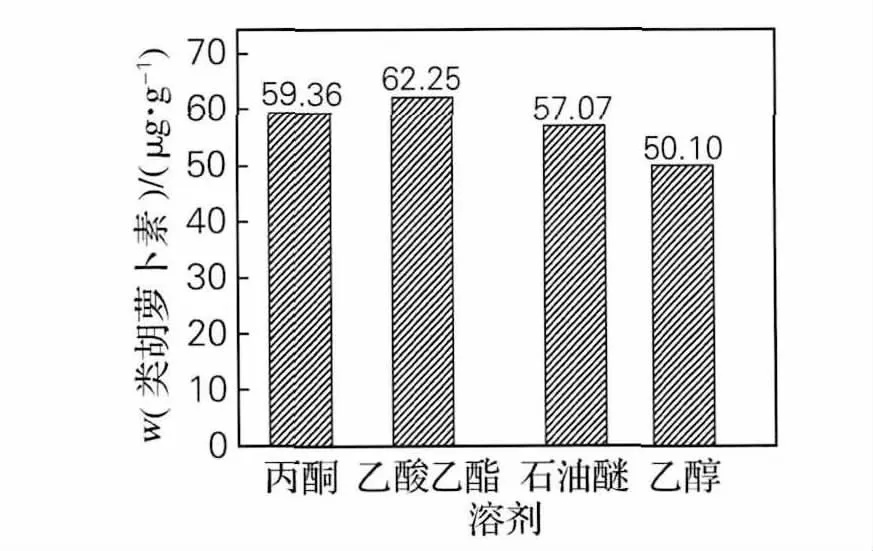
图2 不同提取溶剂对提取效果的影响Fig.2 Effect of different solvent on extraction
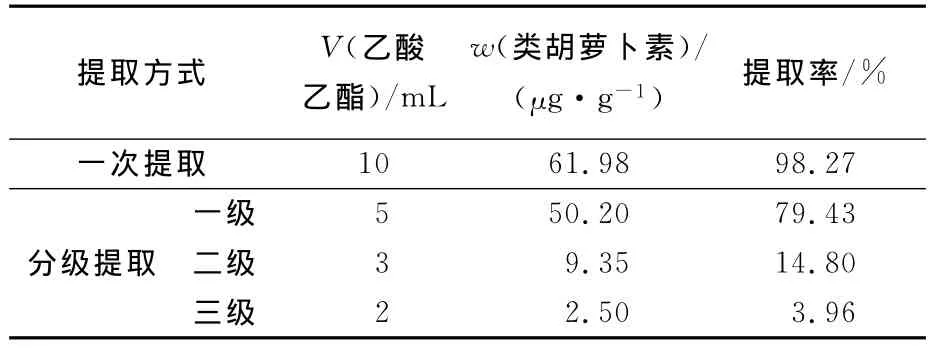
表1 提取级数与溶剂用量的确定Tab.1 Experimental conditions for the extract times and solvent volume
由表1的提取结果可知,二次分级提取的提取率比一次提取的略低,但所用溶剂量比一次提取的少,为提高提取效率节约溶剂,可采用二级提取。
2.5 单因素试验
2.5.1 料液比的选择
精确称取5份冻鲜海参卵0.3g于离心管中,按比例加入1.2、1.8、2.4、3.0、3.6mL乙酸乙酯,40℃水浴避光浸提2h,提取过程间歇振荡。提取后离心、取上清液,在450nm波长可见光下以提取溶剂为空白对照,测定其吸光值,并计算出类胡萝卜素质量分数,结果如图3所示。
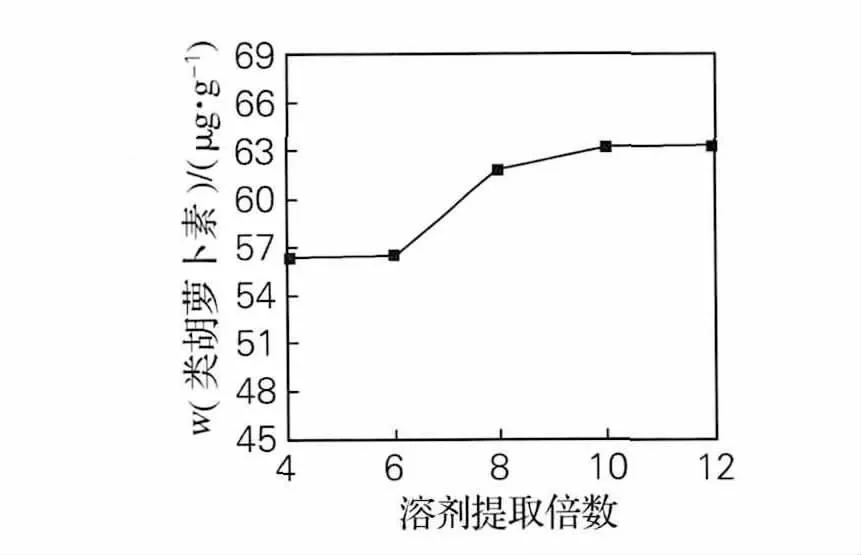
图3 提取溶剂倍数对提取效果的影响Fig.3 Effect of different multiple solvent on extraction
由图3可以看出,随着提取溶剂倍数的增加,类胡萝卜素质量分数越来越大,8~12倍溶剂提取效果相差不大,为了节约溶剂,可以选择8倍或者10倍溶剂量。
2.5.2 提取时间的选择
精确称取7份冻鲜海参卵0.3g于离心管中,各加入3mL乙酸乙酯,40℃水浴避光浸提,浸提时间分别为1.0、1.5、2.0、2.5、3.0、3.5、4.0h,提取过程间歇振荡。提取后离心,取上清液,在450nm波长可见光下以提取溶剂为空白对照,测定其吸光值,并计算出类胡萝卜素质量分数,结果如图4所示。
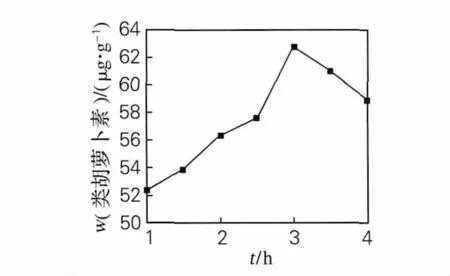
图4 提取时间对提取效果的影响Fig.4 Effect of extract time on extraction
由图4可以看出,在1~3h时,提取时间越长,提取效果越好,3h达到最高点,再延长提取时间,类胡萝卜素质量分数反而下降,可能是由于类胡萝卜素类物质不稳定容易失活,故应选取3h为提取最佳时间。
2.5.3 提取温度的选择
精确称取6份冻鲜海参卵0.3g分别于离心管中,各加入3mL乙酸乙酯,分别在25、30、35、40、45、50℃水浴下避光浸提3h,提取过程间歇振荡。离心,取上清液在450nm波长可见光下以提取溶剂为空白对照,测定其吸光值,并计算出类胡萝卜素质量分数,结果见图5。
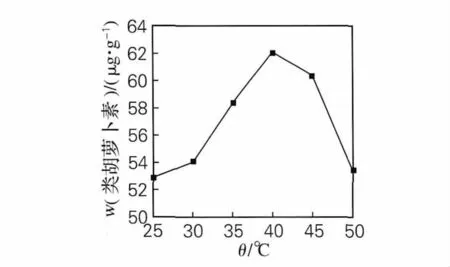
图5 提取温度对提取效果的影响Fig.5 Effect of extract time on extraction
由图5可以看出,提取温度为40℃时提取效果最好,温度继续升高,质量分数反而下降,可能温度过高会破坏类胡萝卜素结构使其失活,故选择提取温度为40℃作为单因素试验的最佳提取温度。
2.6 正交试验
在单因素试验的基础上,利用L9(33)正交试验表,进一步对提取条件进行优化。正交试验设计以及正交试验方差分析见表2、3。
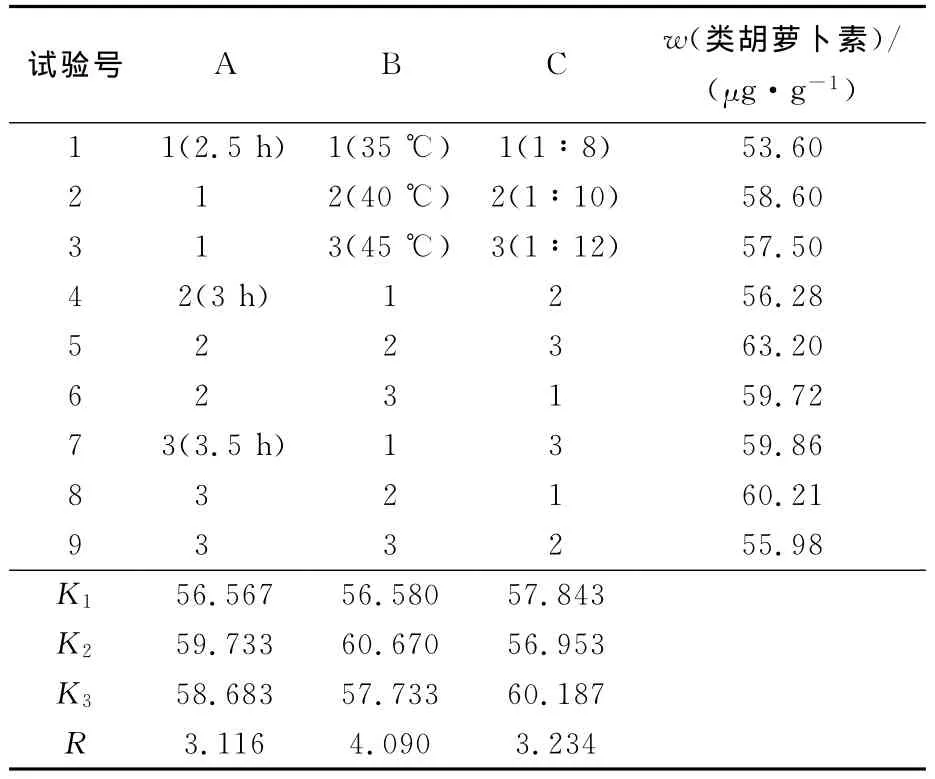
表2 海参卵中类胡萝卜素提取条件正交试验设计及其结果Tab.2 Orthogonal test of carotenoids extract conditions design and result

表3 方差分析表Tab.3 Analysis of covariance table
以乙酸乙酯为提取溶剂,正交试验结果及分析表明,各因素对海参卵中类胡萝卜素质量分数的影响顺序为C(提取温度)>A(料液比)>B(提取时间),其中提取温度为显著性影响因素(a=0.05),方差分析结果和极差分析结果相一致,所以确定最佳提取条件组合为A2B2C3,即料液比为1∶12、提取时间3h、提取温度40℃,类胡萝卜素质量分数可达63.20μg/g。
3 结 论
类胡萝卜素性质极其不稳定,遇光、热、空气都容易分解,结构发生变化,而且导致吸光度下降,提取和测量时应该尽量在避光低温下进行。
薄层层析结果表明海参卵中含有一定比例的类胡萝卜素类物质。冻鲜海参卵中水分质量分数为90.56%。通过单因素试验结合正交试验分析得知,海参卵中类胡萝卜素的最佳提取条件为:以乙酸乙酯为提取溶剂,提取温度40℃,提取时间3h,料液比1∶12,类胡萝卜素质量分数可达63.20μg/g。两级提取的类胡萝卜素提取率可达94.23%,比一级提取提取率高且节省提取溶剂。
[1]惠伯棣.类胡萝卜素化学及生物化学[M].北京:中国轻工业出版社,2005:1-2.
[2]李福枝,刘飞,曾晓希,等.天然类胡萝卜素的研究进展[J].食品工业科技,2007,28(9):227-231.
[3]ZEB A,MEHMOOD S.Carotenoids contents from various sources and their potential health applications[J].Pakistan Journal of Nutrition,2004,3(3):199-204.
[4]CAPELLI B,CYSEWSKI G.Natural astaxanthin:the king of the carotenoids[M].Holualoa:Bob Capelli Cyano-tech Corporation,2007:1-3.
[5]MATSUNO T.Aquatic animal carotenoids[J].Fisheries Science,2001,67:771-783.
[6]赵鸿霞,周大勇,秦磊,等.响应面法优化海参卵酶解工艺[J].食品与机械,2010,26(5):114-117.
[7]姬小明,邵惠芳,刘金霞,等.类胡萝卜素的提取及分离方法研究进展[J].河南科学,2008,26(11):1337-1339.
[8]黄晨.万寿菊中类胡萝卜素的分离及性质研究[D].天津:天津商业大学,2008:34-35.
[9]黄健,刘建国.类胡萝卜素的分析测定[J].青岛化工学院学报,2001,22(3):223-227.
