司来吉兰联合复合多巴治疗帕金森病的有效性和安全性
2013-09-17陈斐管强郑玉果靳令经聂志余
陈斐 管强 郑玉果 靳令经 聂志余
迄今,左旋多巴替代疗法仍是治疗帕金森病(Parkinson disease,PD)最有效的药物和金标准。但随着PD病程进展,长期应用左旋多巴会出现疗效减退、剂末现象、开关现象、冻结状态、异动症等各种运动并发症,从而促进了其他抗帕金森病药,如多巴胺受体激动剂、B型单胺氧化酶(monoamine oxidase,MAO-B)抑制剂及儿茶酚氧位甲基转移酶(COMT)抑制剂等的研发和应用。本文报道了应用 MAO-B抑制剂盐酸司来吉兰(selegiline)联合复方多巴治疗PD的疗效及安全性的结果。
1 对象和方法
1.1 对象 选取2008-12-2013-04作者医院门诊及住院的PD患者89例,其中男51例,女38例;年龄53~79岁,平均(62.5±7.1)岁;病程2~9年,中位数为4.5年,四分位数间距为2.6年。入组标准:入组病例均符合英国PD协会脑库标准[1]。排除标准:症状性PD或帕金森叠加综合征,有严重剂峰异动症、体位性低血压、脑部立体定向手术史及深部脑刺激(DBS)或干细胞移植治疗史的患者,纳入研究前30d内合并使用神经安定剂、胃肠外麦角制剂、可能引起锥体外系不良反应药物或其他试验药物者及妊娠或哺乳期妇女。所有患者均疗效减退或出现运动并发症或对疗效不满意,应用随机数字表法将患者随机分为对照组(45例)和治疗组(44例),两组患者间性别构成、年龄、病程和治疗前UPDRS评分比较差异无统计学意义(P>0.05)。
1.2 方法
1.2.1 对照组治疗措施:单用左旋多巴/苄丝肼(美多巴)治疗25例,左旋多巴/苄丝肼加左旋多巴/卡比多巴控释片16例,单用左旋多巴/卡比多巴控释片4例,用量以所含左旋多巴计算为225~400mg/d,平均(285±87.5)mg/d;合用金刚烷胺、吡贝地尔、苯海索者各1例,合用普拉克索者6例。其中疗效不满意8例、疗效减退13例、出现剂末现象10例、开关现象8例、异动症6例。6个月为1个观察周期,整个观察期内,对照组患者维持原药物种类和剂量不变。
1.2.2 治疗组治疗措施:单用左旋多巴/苄丝肼(美多巴)24例,左旋多巴/苄丝肼加左旋多巴/卡比多巴控释片14例,单用左旋多巴/卡比多巴控释片6例,用量以所含左旋多巴计算为250~420 mg/d,平均(315±85.5)mg/d。其中,合用金刚烷胺、吡贝地尔各3例、苯海索者2例,合用普拉克索者7例。各例患者均在此治疗基础上加服盐酸司来吉兰(商品名:金思平,南京振中生物有程有限公司生产),从小剂量2.5mg/d开始,逐渐递增至5.0~7.5mg/d(分早、中服用),当疗效较满意时即维持原剂量不再增量。6个月为1个观察周期。加用司来吉兰原因分别为疗效不满意9例、疗效减退14例、出现剂末现象9例(其中2例合并异动症)、开关现象8例、异动症6例。
1.2.3 疗效评估:治疗前及治疗后1、3、6个月分别对两组患者进行PD统一评分量表(UPDRS)评分,评分由对该研究不知情的、富有经验的神经科医生完成。
1.2.4 不良反应监测:询问和记录患者出现的不良反应。全部患者于治疗前后进行血压,血、尿常规,肝、肾功能,心电图检测。
1.3 统计学处理 数据采用SPSS17.0统计软件进行分析,计量资料以均数±标准差表示,组间比较采用独立样本t检验;多组间均数比较采用单因素方差分析,两两比较采用q检验(Newman-Keuls法)。以P<0.05为差异有统计学意义。
2 结果
2.1 UPDRS评分
2.1.1 UPDRSⅠ评分比较:对照组治疗前及治疗后各时间点UPDRSⅠ评分比较无统计学意义(F=0.95,P=0.4184),治疗组治疗前及治疗后各时间点UPDRSⅠ评分比较有统计学差异(F=6069,P=0.0003)。与对照组比较,治疗组治疗3个月与6个月时其UPDRSⅠ评分明显降低(P<0.05)。治疗组同组内比较,治疗3个月和6个月其UPDRSⅠ评分较治疗前及治疗1个月明显下降(P<0.01)。具体结果见表1。
2.1.2 UPDRSⅡ评分比较:对照组治疗前及治疗后各时间点UPDRSⅡ评分改变比较无统计学差异(F=0.69,P=0.5592),治疗组治疗前及治疗后各时间点UPDRSⅡ评分改变有统计学差异(F=6.01,P=0.0006)。与对照组比较,治疗组治疗3个月与治疗6个月时其UPDRSⅡ评分明显降低(P<0.05)。治疗组同组内比较,治疗3个月和6个月时UPDRSⅡ评分较治疗前明显下降(均P<0.01),余各时间点两两比较无统计学差异(P>0.05)。具体结果见表2。
2.1.3 UPDRSⅢ评分比较:对照组治疗前及治疗后各时间点UPDRSⅢ评分比较无统计学差异(F=2.62,P=0.0524),治疗组治疗前及治疗后各时间点UPDRSⅢ评分比较有统计学差异(F=25.46,P=0.0000)。与对照组比较,治疗组治疗后各时间点UPDRSⅢ评分均有明显下降(P<0.05)。治疗组同组内比较,治疗1、3、6个月时UPDRSⅢ评分均较治疗前明显下降(均P<0.01),治疗3个月、6个月时其评分较治疗1个月时下降(P<0.05),而治疗6个月与治疗3个月时相比该评分无统计学差异(P>0.05)。具体结果见表3。
表1 两组患者治疗前后精神、行为和情绪(UPDRSⅠ)评分比较 (±s)

表1 两组患者治疗前后精神、行为和情绪(UPDRSⅠ)评分比较 (±s)
注:与同组治疗前相比,*P<0.01;与同组治疗1个月相比,#P<0.05
组别 例数 治疗前 治疗1个月 3个月 6个月 F值 P值对照组 45 2.45±1.22 2.30±1.06 2.25±1.15 2.07±1.02 0.95 0.4184治疗组 44 2.58±1.30 2.36±1.19 1.81±0.90*# 1.68±0.92*# 6.69 0.0003 t值0.628 0.802 0.047 0.040 0.488 0.251 2.007 2.087 P值
表2 两组患者治疗前后日常活动(UPDRSⅡ)评分比较 (±s)
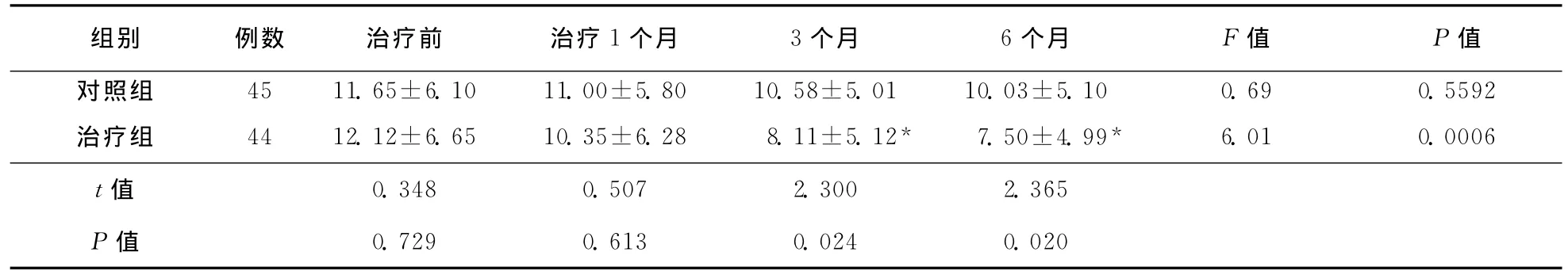
表2 两组患者治疗前后日常活动(UPDRSⅡ)评分比较 (±s)
注:与同组治疗前相比,*P<0.01
组别 例数 治疗前 治疗1个月 3个月 6个月 F值 P值对照组 45 11.65±6.10 11.00±5.80 10.58±5.01 10.03±5.10 0.69 0.5592治疗组 44 12.12±6.65 10.35±6.28 8.11±5.12* 7.50±4.99* 6.01 0.0006 t值0.729 0.613 0.024 0.020 0.348 0.507 2.300 2.365 P值
表3 两组患者治疗运动功能(UPDRSⅢ)评分比较 (±s)

表3 两组患者治疗运动功能(UPDRSⅢ)评分比较 (±s)
注:与同组治疗前相比,*P<0.01;与同组治疗1个月相比,#P<0.05
组别 例数 治疗前 治疗1个月 3个月 6个月 F值 P值对照组 45 30.79±10.10 28.98±7.66 26.88±8.01 26.29±8.22 2.62 0.0524治疗组 44 33.13± 9.65 24.23±9.12* 20.50±6.71*# 18.35±8.90*# 25.46 0.0000 t值0.267 0.009 0.0001 0.0000 1.117 2.663 4.069 4.374 P值
表4 两组患者治疗前后运动并发症(UPDRSⅣ)评分比较 (±s,例)
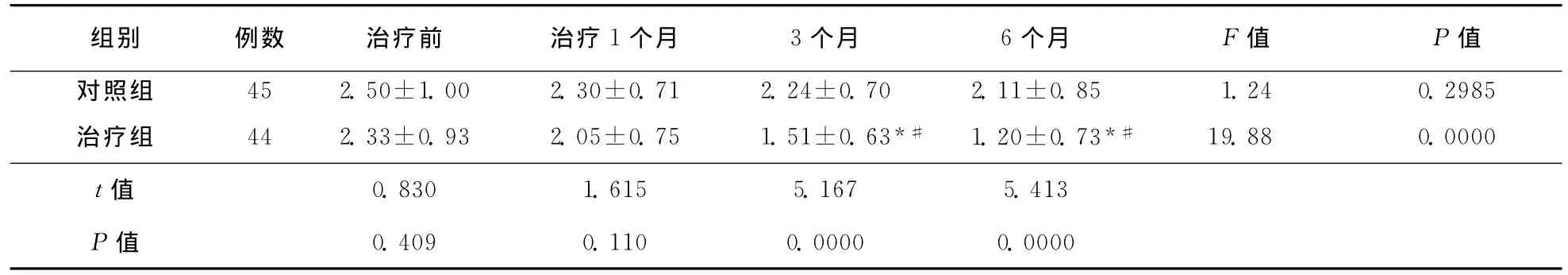
表4 两组患者治疗前后运动并发症(UPDRSⅣ)评分比较 (±s,例)
注:与同组治疗前相比,*P<0.01;与同组治疗1个月相比,#P<0.01
组别 例数 治疗前 治疗1个月 3个月 6个月 F值 P值对照组 45 2.50±1.00 2.30±0.71 2.24±0.70 2.11±0.85 1.24 0.2985治疗组 44 2.33±0.93 2.05±0.75 1.51±0.63*# 1.20±0.73*# 19.88 0.0000 t值0.409 0.110 0.0000 0.0000 0.830 1.615 5.167 5.413 P值
2.1.4 UPDRSⅣ评分比较:对照组治疗前及治疗后各时间点UPDRSⅣ评分比较无统计学差异(F=1.24,P=0.2985),治疗组治疗前及治疗后各时间点UPDRSⅣ评分比较有统计学差异(F=19.88,P=0.0000)。与对照组比较,治疗3个月与治疗6个月时UPDRSⅣ评分明显降低(P<0.01)。治疗组同组内比较,治疗1、3、6个月时UPDRSⅣ评分较治疗前均明显下降(均P<0.01),而治疗6个月与治疗3个月时比较,该评分无统计学差异(P>0.05)。具体结果见表4。
2.2 不良反应 对照组观察期间无不适主诉。治疗组中出现轻度恶心4例、头晕5例、嗜睡2例、心悸4例、口干2例、纳减2例,入睡困难8例,除2例入睡困难的患者需服用安眠药外,余患者均未予特殊处理,上述症状在用药1~2周后自行缓解。所有患者治疗前后血、尿常规,肝、肾功能,心电图及血压均无明显改变。
3 讨论
MAO有A、B两种异构体,广泛分布于体内各组织器官,以肝、肾、脑等组织中含量较高。在细胞内,MAO主要分布在线粒体外膜。MAO-A主要分布在外周器官,尤其是消化系统;在脑组织,主要分布于蓝斑的去甲肾上腺素能神经元。MAO-B主要分布于脑组织,基底节神经元富含 MAO-B,尤其是缝际核的5-羟色胺能神经元和胶质细胞[2]。
单胺氧化酶是脑组织内单胺类神经递质主要的代谢酶。MAO-B可通过增加以单胺类物质为底物的反应性氧自由基(generation of reactive oxygen species,ROS)产生,以及增加神经毒素的氧化合成(如促使1-甲基-1,4-苯-1,2,3,6-四氢吡啶氧化成1-甲基-1,4-苯-吡啶),从而参与 PD 的发病[3]。
司来吉兰是第一个人工合成的、选择性、不可逆性MAO-B抑制剂(1962年),可选择性地、不可逆地抑制体内多巴胺降解,提高体内多巴胺水平,延长外源性多巴类药物的作用时间,减少血药浓度波动,增强多巴类药物的治疗作用;同时减少突触前膜对多巴胺的再摄取,间接增加多巴胺合成,使纹状体突触间隙内多巴胺浓度处于相对稳定状态,司来吉兰及其代谢产物苯异丙胺可致敏残存的多巴胺能神经元,增加多巴胺释放,抑制突触后膜多巴胺能转运体(dopamine transport,DAT)对突触间隙内多巴胺的再摄取,以提高突触间隙多巴胺浓度,从而改善PD的运动症状及伴随的症状波动和运动障碍并发症,还可减少多巴制剂用量及给药频率[4]。另外,司来吉兰可抵抗氧自由基的氧化作用,上调超氧化物歧化酶和过氧化氢酶水平,延迟无血清条件下的细胞凋亡,阻止凋亡诱发的线粒体膜电位下降[5]。司来吉兰最早用于抗抑郁治疗,二十世纪70年代应用于PD的治疗。文献报道,以司来吉兰5~10mg/d治疗PD不仅可改善患者症状,延迟开始左旋多巴治疗的时间,降低与应用左旋多巴相关的症状波动的发生率,缩短“关”相时间,延长“开”相时间,而且其安全性和耐受性良好[6]。2009年Caslake总结询证医学证据后发现,尽管MAO-B抑制剂的疗效略逊于左旋多巴和多巴胺受体激动剂,但仍是治疗早期PD的最佳选择。而且,与应用左旋多巴起始治疗者相比,症状波动的发生率较低[7]。
本研究结果显示,与对照组比较,联合应用司来吉兰后的3、6个月,UPDRSⅠ~Ⅳ评分均有显著下降。这与文献报道结果一致[8]。治疗组治疗前后比较结果显示,运动功能改善出现最早,于治疗1个月时UPDRSⅢ评分即出现显著降低,至治疗3个月时达最佳状态;精神、行为和情绪UPDRS评分,日常活动UPDRS评分和运动并发症UPDRS评分的显著改善均出现于用药后的第3个月,这与Löhle等的报道一致[9]。本研究结果显示,司来吉兰联合复合多巴治疗PD不仅可改善PD患者的运动症状和运动并发症,而且对患者的日常活动能力、精神行为及情绪也有显著的改善作用,提示联合应用司来吉兰和复合多巴治疗PD可全面改善PD的临床症状。由于本研究样本较小,且为开放性研究,因此其确切疗效需扩大样本,采用随机、双盲对照研究加以证实。文献报道[10],司来吉兰主要不良反应有口干、焦虑、恶心、睡眠障碍、眩晕、头痛、头昏、腹泻、幻觉(听幻觉、可逆性易装癖)、情绪激动、直立性低血压及心血管不良反应等,但有些不良反应尚存争议。本研究结果显示,治疗组不良反应仅有轻度恶心、头晕、嗜睡、心悸、口干、纳减及失眠,多数出现于用药初期的1~2周内,除2例给予安定类药物对症治疗外,均且未经特殊处理,大部分自动缓解,未见幻觉、双下肢水肿和直立性低血压等不良反应。血、尿常规,肝、肾功能,心电图及血压均无明显变化,提示司来吉兰联合复方多巴治疗PD疗效确切,而且安全。
综上所述,MAO-B抑制剂司来吉兰对PD症状具有较全面的改善作用,其中运动症状的改善出现最早;对精神、行为和情绪,日常活动,运动并发症等也有明显改善作用,作用最佳时期出现在用药后第3个月,而且不良反应较少,多数可自动缓解。因此,无论在PD早期或疾病晚期,均可应用司来吉兰治疗。
[1]Hughes AJ,Daniel SE,Kilford L,et al.Accuracy of clinical diagnosis of idiopathic Parkinson's disease:a clinic-pathological study of 100cases[J].J Neurol Neurosurg Psychiatry,1992,55:181-184.
[2]Leegwater-Kim J,Bortan E.The role of rasagiline in the treatment of Parkinson's disease[J].Clin Interv Aging,2010,5:149-156.
[3]Inaba-Hasegawa K,Akao Y,Maruyama W,et al.Rasagiline and selegiline,inhibitors of type B monoamine oxidase,induce type A monoamine oxidase in human SH-SY5Ycells[J].J Neural Transm,2013,120:435-444.
[4]Fabbrini G,Abbruzzese G,Marconi S,et al.Selegiline:a reappraisal of its role in Parkinson disease[J].Clin Neuropharmacol,2012,35:134-140.
[5]Magyar K.The pharmacology of selegiline[J].Int Rev Neu-robiol,2011,100:65-84.
[6]Riederer P,Laux G.MAO-inhibitors in Parkinson's disease[J].Exp Neurobiol,2011,20:1-17.
[7]Caslake R,Macleod A,Ives N,et al.Monoamine oxidase B inhibitors versus other dopaminergic agents in early Parkinsons disease[J].Cochrane Database Syst Rev,2009,CD006661.
[8]Mizuno Y,Kondo T,Kuno S,et a1.Early addition of selegiline to L-Dopa treatment is beneficial for patients with Parkin-son disease[J].Clin Neuropharmacol,2010,33:1-4.
[9]Löhle M,Reichmann H.Controversies in Neurology:why monoamine oxidase B inhibitors could be a good choice for the initial treatment of Parkinson's disease[J].BMC Neurol,2011,11:112.
[10]蒋雨平,蒋雯巍.司来吉兰的临床研究进展及安全性[J].中国临床神经科学,2012,20:424-433.
