大鼠低血糖后血糖升高水平对脑损伤的影响
2013-09-17刘建芝赵玉武褚秀丽徐周伟
刘建芝 赵玉武 褚秀丽 徐周伟
低血糖是一种十分常见的临床现象,尤其在糖尿病患者的治疗过程中经常发生。低血糖产生的危害较高血糖更迅速、更严重,轻者导致易激惹、局灶性神经功能损害、昏迷等,重者可导致死亡[1-2]。一旦发生低血糖,目前的治疗原则强调立刻给予高浓度葡萄糖,迅速将血糖升高并维持在8.3~11.1 mmol/L[3]。既往研究发现,低血糖后血糖升高过快会导致大鼠海马神经元凋亡细胞增加,并提出了低血糖后“葡萄糖再灌注”的概念[4],但其机制尚不清楚。本研究进一步了观察低血糖后升高血糖速度对大鼠海马神经元细胞坏死及其超微结构改变的影响,同时探讨了不同升高血糖水平下活性氧自由基(ROS)产生的变化。
1 材料和方法
1.1 实验动物 4月龄SD雄性大鼠36只,体质量280~320g,购自上海西普尔-必凯实验动物有限公司,饲养时昼夜各12h。采用简单随机抽样方法将大鼠分为模型组(24只)、空白对照组(6只)、假手术组(6只)。模型组再按照血糖升高水平分为1~3mmol/L、3~6mmol/L、6~9mmol/L、>9mmol/L亚组,各亚组大鼠6只。
1.2 方法
1.2.1 低血糖再灌注模型的制作:参照Sang Won Suh等[5]造模方法并稍作调整。大鼠术前禁食12h,用1%(质量浓度)戊巴比妥钠按体质量0.5mL/100g腹腔注射麻醉,通过股静脉置入密闭式静脉留置针。用微量注射泵静脉推注短效胰岛素诺和灵R(1U/mL)诱导低血糖。用血糖仪(Roche,德国)通过尾静脉半小时测一次血糖。血糖开始降至1mmol/L以下时停止胰岛素推注,此时大鼠脑电图处于等电位状态。维持1h后,用25%(质量浓度)葡萄糖溶液通过股静脉推注升高血糖,升糖速度分别为0.75、1.5、2.0和3.5mL/h,使大鼠血糖在1h后分别升高到1mmol/L<血糖≤3mmol/L(1~3mmol/L组)、3mmol/L<血糖≤6mmol/L(3~6mmol/L组)、6mmol/L<血糖≤9mmol/L(6~9mmol/L 组)和血糖>9 mmol/L(>9mmol/L组)4个不同的浓度水平,并维持3h,使血糖保持稳定。空白对照组为不作任何处理的正常大鼠,假手术组大鼠经腹腔麻醉后通过股静脉置入密闭式静脉留置针,通过股静脉按体质量15U/kg推注含胰岛素的葡萄糖(1.5mL/h),使血糖水平维持在(5.50±0.25)mmol/L的正常范围内,维持5h。在低血糖造模过程中,排除发生四肢抽搐、癫痫发作、死亡的大鼠。本实验共选取130只大鼠,其中96只(73.8%)造模成功。
1.2.2 神经细胞坏死情况观察:于造模术后7d经心脏灌注固定,断头取脑。经固定、脱水、透明、浸蜡、包埋后用石蜡切片机(Leica RM2235)切取4 um厚冠状切片,每个标本在前囟后2.8~3.3 mm间隔80μm取5张切片。采用HE染色后观察海马神经细胞坏死情况,坏死的细胞核浓缩、深染,胞浆呈嗜伊红染色。采用双盲法于光镜下计数每个脑片两侧海马CA1区、齿状回(DG)区和颞叶皮层(2~3层)细胞坏死总数,并计算均值。
1.2.3 透射电镜观察海马超微结构:于术后7d经心脏灌注固定,断头取一侧海马,在DG区切取1mm3组织块,以4%(质量浓度)多聚甲醛固定24 h,磷酸漂洗液漂洗3次;以1%(质量浓度)锇酸固定3h,磷酸漂洗液漂洗3次。然后脱水、包埋、固化、超薄切片机切片60nm、染色,置透射电镜(Hitachi-7650,日本)下观察海马神经元的超微结构。
1.2.4 ROS检测:超氧化物阴离子荧光探针(dihydroethidium,DHE)可自由进入活细胞内,被细胞内的ROS氧化,形成氧化乙啶。氧化乙啶可掺入染色体DNA中,产生红色荧光[6]。DHE试剂盒购自上海碧云天生物技术有限公司,用1%(质量浓度)二甲亚砜稀释至1mg/mL,在大鼠血糖开始降至1mmol/L以下时按体质量1mg/kg经股静脉给药。葡萄糖再灌注结束后立即处死,经心灌注固定后取脑,梯度脱水,用冰冻切片机(Leica CM 1850)切取20μm厚切片,置荧光显微镜510~500nm处测量各组大鼠CA1、DG和颞叶皮层的Et荧光密度。Et信号强度用神经元核周和背景的平均荧光比率表示。空白对照组未进行ROS检测。
1.3 统计学处理 应用SAS 8.0软件进行数据处理,计量资料以均数±标准差表示,多组间均数比较采用单因素方差分析(One-way ANOVA),两两比较采用 SNK(Student-Newman-Keuls)检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠脑神经元坏死比较 各组大鼠海马CA1、DG和颞叶皮层细胞坏死数间比较均有统计学差异(均P<0.01)。与空白对照组比较,假手术组、1~3mmol/L组海马CA1、DG及颞叶皮层细胞坏死数变化无统计学差异(P>0.05);3~6 mmol/L组、6~9mmol/L组、>9mmol/L组海马CA1、DG区及颞叶皮层细胞坏死数均较假手术明显增加(均P<0.01);3~6mmol/L组和6~9 mmol/L组间比较各区细胞坏死数均无统计学差异(均P>0.05);与>9mmol/L组比较,1~3 mmol/L组、3~6mmol/L组和6~9mmol/L组大鼠各区细胞坏死数均显著减少(均P<0.01,图1、表1)。
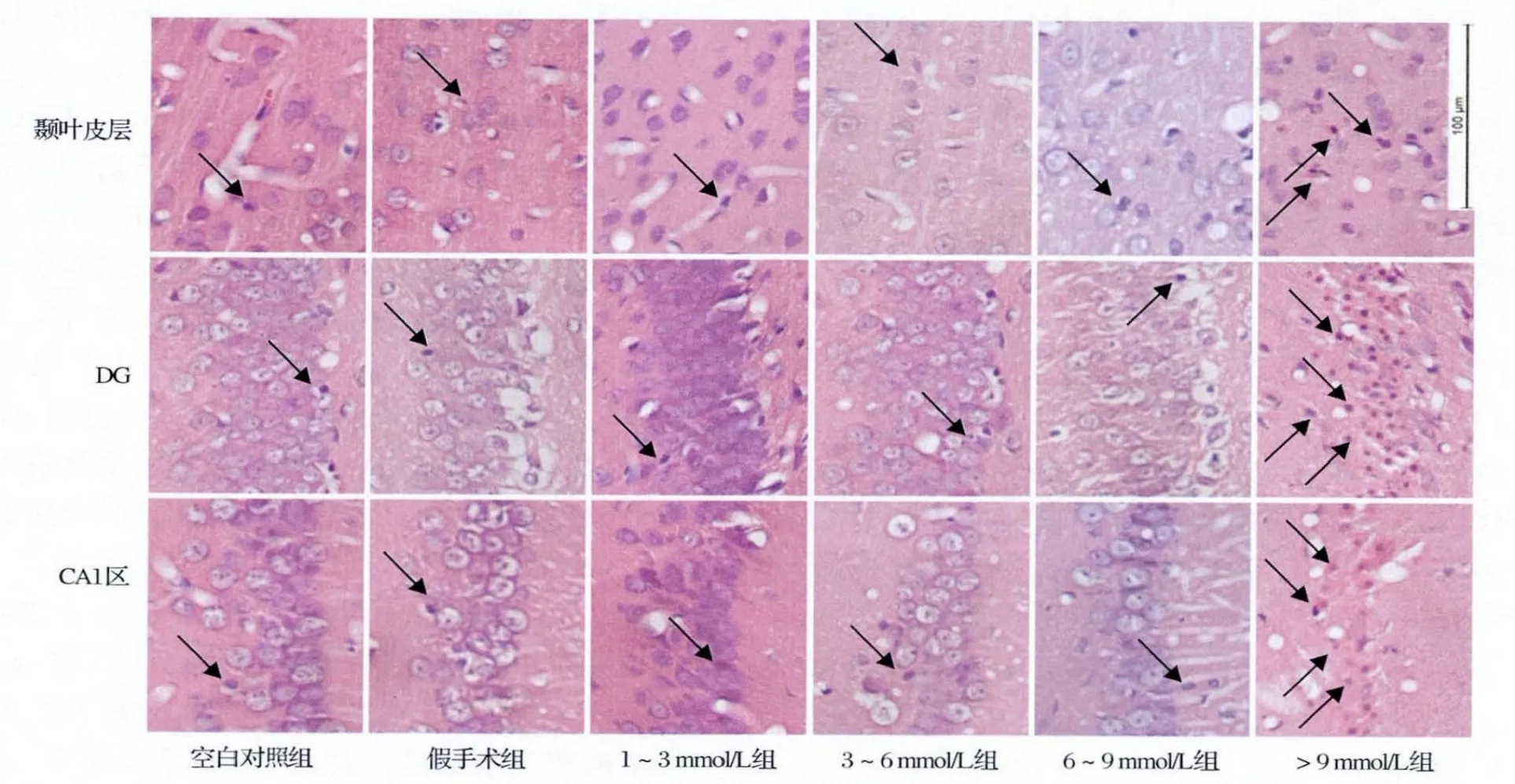
图1 各组大鼠海马CA1区、DG区及颞叶皮层神经元死亡(箭头所示)情况比较(HE,×400)
表1 各组大鼠海马和颞叶皮层坏死神经元细胞数比较 (±s)
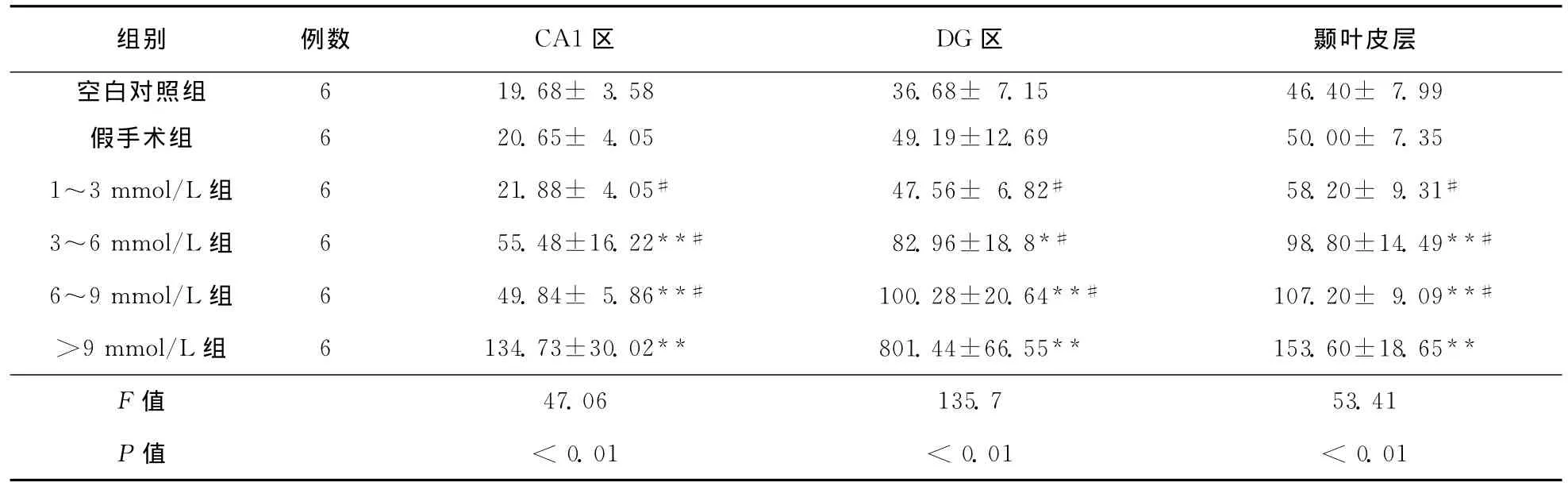
表1 各组大鼠海马和颞叶皮层坏死神经元细胞数比较 (±s)
注:与空白对照组比较,*P<0.05,**P<0.01;与>9mmol/L组比较,#P<0.01
组别 例数 CA1区 DG区6 19.68± 3.58 36.68± 7.15 46.40± 7.99假手术组 6 20.65± 4.05 49.19±12.69 50.00± 7.35 1~3mmol/L组 6 21.88± 4.05# 47.56± 6.82# 58.20± 9.31#3~6mmol/L组 6 55.48±16.22**# 82.96±18.8*# 98.80±14.49**#6~9mmol/L组 6 49.84± 5.86**# 100.28±20.64**# 107.20± 9.09**#>9mmol/L组 6 134.73±30.02** 801.44±66.55** 153.60±18.65**F值颞叶皮层空白对照组0.01 47.06 135.7 53.41 P值 <0.01 <0.01 <
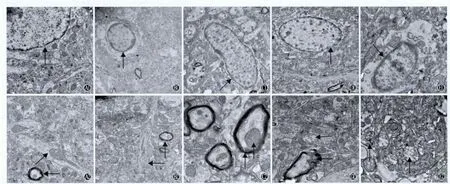
图2 透射电镜下观察低血糖再灌注后大鼠海马神经元超微结构变化(×12000)

图3 低血糖再灌注后不同组别CA1区、DG区和颞叶皮层ROS检测
2.2 大鼠海马神经元超微结构 假手术组大鼠海马神经元细胞膜完整,核染色质均匀,核仁清晰,线粒体、内质网形态正常,髓鞘完整(图2A);1~3 mmol/L组大鼠海马神经元细胞膜完整,核仁清晰,髓鞘结构完整,线粒体轻度肿胀(图2B);3~6 mmol/L组大鼠海马神经元细胞膜基本完整,线粒体嵴排列基本正常,部分线粒体发生肿胀,内质网扩张,髓鞘有溶解现象(图2C);6~9mmol/L组海马神经元细胞膜基本完整,可见异染色质,线粒体肿胀,线粒体嵴破裂;髓鞘溶解(图2D);>9 mmol/L组组大鼠海马神经元核膜模糊,胞浆溶解坏死,线粒体明显肿胀呈空泡状,线粒体基质颗粒消失,线粒体嵴普遍破裂、溶解,内质网明显扩张(图2E)。和假手术组相比,不同升糖速度组均有不同程度的线粒体损伤和髓鞘变化,其中>9 mmol/L组最严重。
2.3 ROS检测 各组大鼠海马CA1和DG区荧光信号比较有统计学差异(均P<0.01)。与假手术组相比,不同升糖水平组海马CA1区和DG区荧光信号均明显增加(P<0.05,P<0.01);与1~3mmol/L组比较,另3个升糖水平组海马CA1区和DG区荧光信号均升高(P<0.05),而3~6 mmol/L组和6~9mmol/L组相比则无统计学差异(P>0.05)(图3,表2)。
3 讨论
低血糖是用药物治疗糖尿病患者时常见的一种严重并发症[6]。与缺血性脑损伤不同,低血糖性脑损伤主要集中在海马CA1区、DG区和颞叶皮层[7]。
神经元受损伤时,其超微结构会发生一系列变化:核染色质边集并出现异染色质、核膜溶解、内质网扩张、线粒体肿胀、髓鞘溶解等。本实验结果显示,低血糖后迅速升高血糖(>9mmol/L组)较缓慢升高血糖(1~3mmol/L组)更易造成神经元超微结构损伤,且神经元的坏死程度较缓慢升高血糖(1~3mmol/L组)显著。氧化应激造成ROS过量产生是导致神经元损伤的主要因素。Sang Won Suh等证实低血糖造成神经元死亡不是在低血糖阶段产生而主要是由葡萄糖再灌注触发,ROS是在葡萄糖再灌注阶段产生[5]。本研究结果显示快速升高血糖(>9mmol/L组)时ROS产生的程度比缓慢升高血糖(1~3mmol/L组)显著。
表2 各组大鼠海马CA1区和DG区ROS检测比较(±s,n=6)
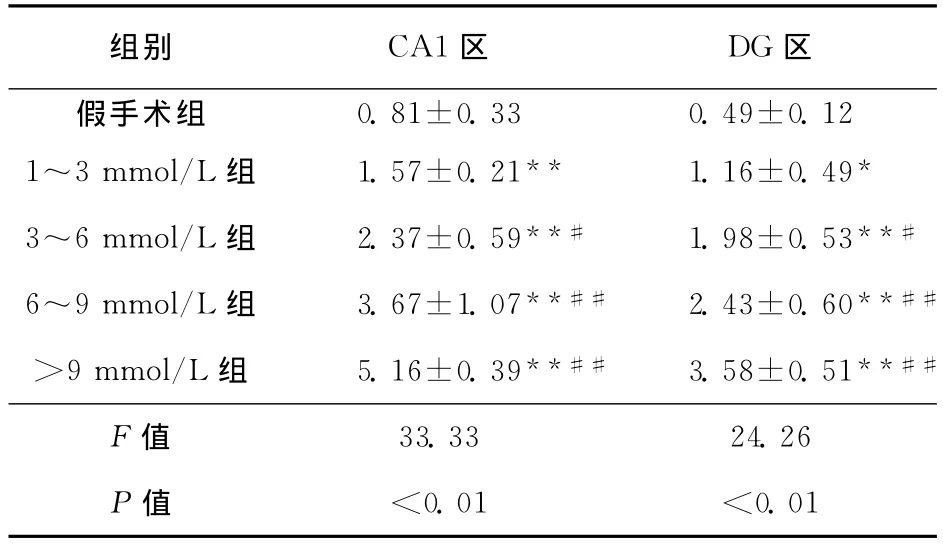
表2 各组大鼠海马CA1区和DG区ROS检测比较(±s,n=6)
注:与假手术组相比,*P<0.05;**P<0.01;与1~3 mmol/L组比较,#P<0.05,##P<0.01
组别 CA1区 DG区假手术组0.81±0.33 0.49±0.12 1~3mmol/L组 1.57±0.21** 1.16±0.49*3~6mmol/L组 2.37±0.59**# 1.98±0.53**#6~9mmol/L组 3.67±1.07**## 2.43±0.60**##>9mmol/L组 5.16±0.39**## 3.58±0.51**##F值0.01 33.33 24.26 P值 <0.01 <
目前公认的低血糖诱导神经元死亡的信号途径是一个多步骤的级联反应。这个反应中的关键步骤包括:谷氨酸受体激活[8]、葡萄糖再灌注、ROS产生[9]、锌离子释放[10]、线粒体通透性改变[11]和聚腺苷酸二磷酸核糖转移酶-1活化[12]。最新研究发现,低血糖可以造成脑组织中兴奋性氨基酸水平的改变[13],兴奋性氨基酸如谷氨酸过度活化在低血糖性脑损伤中发挥重要作用[14],谷氨酰胺可以在葡萄糖被剥夺的过程中保护小脑颗粒神经元线粒体膜电位的稳定[15]。目前临床中对于低血糖的治疗是即刻给予50%葡萄糖,使血糖迅速升高到8.3~11.0mmol/L。本研究电镜和 HE染色结果均显示,过快的升高血糖反而会加重脑损伤,这和临床中的治疗原则相矛盾,对于临床治疗有一定的指导意义。虽然目前关于低血糖再灌注的研究取得了明显的进展,但其中某些机制仍然不清楚,如在严重低血糖阶段细胞外液谷氨酸浓度升高的原因等尚有待进一步研究。
[1]McCrimmon RJ,Frier BM.Hypoglycaemia,the most feared complication of insulin therapy[J].Diabete Metab,1994,20:503-512.
[2]Ben-Ami H,Nagachandran P,Mendelson A,et al.Drug-induced hypoglycemic coma in 102diabetic patients[J].Arch Intern Med,1999,159:281-284.
[3]中国糖尿病防治指南编写组.中国糖尿病防治指南[M].北京:北京大学医学出版社,2004.42-43.
[4]褚秀丽,赵玉武,米亚静,等.血糖升高水平对大鼠低血糖性脑损伤的影响[J].中华糖尿病杂志,2012,3:170-176.
[5]Suh SW,Gum ET,Hamby AM,et al.Hypoglycemic neuronal death is triggered by glucose reperfusion and activation of neuronal NADPH oxidase[J].J Clin Invest,2007,117:910-918.
[6]Davis EA,Keating B.Impact of improved glycaemic control on rates of hypoglycaemia in insulin dependent diabetes mellitus[J].Arch Dis Child,1998,78:111-115.
[7]Auer RN,Siesjo BK.Hypoglycaemia:brain neurochemistry and neuropathology[J].Baillieres Clin Endocrinol Metab,1993,7:611-625.
[8]Nellgard B,Wieloch T.Cerebral protection by AMPA-and NMDA-receptor antagonists administered after severe insulininduced hypoglycemia[J].Exp Brain,1992,92:259-66.
[9]Suh SW,Hamby AM,Gum ET,et al.Sequential release of nitric oxide,zinc,and superoxide in hypoglycemic neuronal death[J].Cereb Blood Flow Metab,2008,28:1697-1706.
[10]Suh SW.Detection of zinc translocation into apical dendrite of CA1pyramidal neuron after electrical stimulation[J].Neurosci Methods,2009,177:1-13.
[11]Ferrand Drake M,Friberg H,Wieloch T.Mitochondrial permeability transition induced DNA-fragmentation in the rat hippocampus following hypoglycemia[J]. Neuroscience,1999,90:1325-1338.
[12]Suh SW,Aoyama K,Chen Y,et al.Hypoglycemic neuronal death and cognitive impairment are prevented by poly(ADP-ribose)polymerase inhibitors administered after hypoglycemia[J].Neurosci,2003,23:10681-10690.
[13]Rao R,Ennis K,Long JD,et al.Neurochemical changes in the developing rat hippocampus during prolonged hypoglycemia[J].J Neurochem,2010,114:728-738.
[14]Farooqui AA,Ong WY,Horrocks LA.Neurochemical aspects of excitotoxicity[M].New York:Springer Science and Business Media,2008.125-142.
[15]Stelmashook EV,Novikova SV,Isaea NK.Glutamine effect on cultured granule neuron death induced by glucose deprivation and chemical hypoxia[J].Biochemistry,2010,75:1039-1044.
