具抗凝血作用的三种钕配合物与人血清白蛋白的相互作用
2013-09-15宋玉民姚小强
宋玉民 王 莉 姚小强
(西北师范大学化工学院,兰州 730070)
随着我国社会经济的发展和控制人口过快增长政策的多年实施,目前我国社会开始进入老龄化阶段,而脑血栓是老年人的一种常见疾病。故对具有抗凝血药物的研究早已是药物学家研究的重点。具抗凝血作用的金属配合物的合成和性质研究亦成为化学家关注的研究课题。前期本课题组研究了一些稀土华法灵配合物、稀土水杨酸配合物、稀土华法灵、水杨酸三元配合物和稀土半胱氨酸、枸橼酸钠三元配合物、稀土纳米氧化物肝素杂化材料的抗凝血功效[1-3]。研究表明,配合物的抗凝血效果均比配体好;二元配合物的抗凝血效果比三元配合物的抗凝血效果好;钕配合物在同类配合物中的抗凝血作用时间最长。人血清白蛋白是血浆中含量较高的一种蛋白质,也是形成血栓的成分之一。配合物的抗凝血作用是否通过改变HSA的构象来实现,而不同构象的HSA在血液中的溶解、沉降性能是否不同,导致了血栓形成的容易与否,为此本课题组曾对华发灵过渡金属配合物、水杨酸过渡金属配合物、华发灵水杨酸过渡金属三元配合物与HSA之间的作用进行过研究,配合物的存在明显改变人血清白蛋白的构象[4-6]。为进一步探讨配合物改变人血清白蛋白构象的原因,本课题组对形成配合物的中心原子(稀土离子)和配体华法林离子(华法林钠)及水杨酸分子与HSA分子之间的作用进行了研究[7-9],结果表明稀土离子的存在对HSA的二级结构几乎没有影响,华法林离子(华法林钠)和水杨酸分子的存在可引起HSA二级结构的变化,华法林离子(华法林钠)与HSA之间的主要作用力是氢键和范德华力,水杨酸与HSA之间的主要作用力是疏水作用力。为进一步了解钕配合物在同类配合物中的抗凝血作用最好的原因,本文报道了对华法灵钕(NdL3·2H2O,L=华法灵离子)、水杨酸钕(NdL′3·2H2O,L′=水杨酸离子)、华法灵水杨酸钕(NdL2L′·2H2O)三种配合物(结构如图1所示)与HSA相互作用的研究。结果表明:3种配合物均对HSA的荧光产生猝灭作用,华法灵钕和华法灵水杨酸钕配合物对于HSA的猝灭效应属于两者之间生成了不发荧光的复合物而导致静态猝灭,而水杨酸钕是动态猝灭与静态猝灭两种效应导致的猝灭。并确定了它们的结合力类型:华法灵钕与HSA之间主要作用力是静电作用力;水杨酸钕与HSA之间主要作用力为典型的疏水作用力;华法灵水杨酸钕与HSA之间为氢键和范德华力。计算了配合物与HSA的结合常数K和结合位点数n。并且发现配合物的存在可引起HSA的构象发生变化,并对HSA在不同浓度的配合物存在时构象发生变化的原因进行了讨论。提供了对合成抗凝血效果好、毒性低、水溶性好的药物有参考意义的实验基础。

1 实验部分
1.1 仪器与试剂
LS-55荧光分光光度计(美国PE公司);Agilent-8453紫外分光光度计 (美国Agilent公司);J-810圆二色谱仪(日本Jasco公司);TB-85型恒温器(日本岛津公司);pHS-25型酸度计(上海第二分析仪器厂)。
人血清白蛋白为国药集团化学试剂有限公司产品;华法灵钕、水杨酸钕、华法灵水杨酸钕配合物(自制)[1-2];实验用水为去离子三次蒸馏水;配制10 mmol·L-1Tris-HCl缓冲溶液,pH=7.37(内含 50 mmol·L-1NaCl的溶液维持离子强度);其余试剂均为分析纯。
1.2 实验方法
1.2.1 配合物与HSA作用的荧光光谱
实验所需的HSA溶液用Tris-HCl缓冲溶液配制(CHSA=10 μmol·L-1),华法灵钕、水杨酸钕与华法灵水杨酸钕配合物用2次蒸馏水溶解(CQ=10μmol·L-1),移取 2 mL 10 μmol·L-1的 HSA 溶液于 1 cm 石英比色池中,用微量进样器分别加入不同体积的配合物,分别在20℃和30℃下反应5 min后,以λex=282 nm为激发波长,记录300~500 nm波长范围的荧光光谱。并且测定Δλ=15 nm和Δλ=60 nm时的同步荧光光谱。
1.2.2 配合物与HSA作用的紫外吸收光谱
向加有 2.5 mL 的 50 μmol·L-1HSA 溶液的 1 cm石英吸收池中滴加不同体积的相应配合物 (CQ=10 μmol·L-1)溶液,以 Tris-HCl缓冲溶液为参比,扫描紫外吸收光谱。
1.2.3 配合物与HSA作用的圆二色谱(CD)
室温下,在一系列10 mL比色管中,加入2.5 mL 的 HSA(CHSA=0.10 μmol·L-1)溶液,然后依次加入不同体积的3种配合物溶液,定容后充分震荡摇匀测定3种配合物与HSA作用的圆二色谱;以相应的Tris-HCl缓冲溶液为参比溶液,样品池为1 cm石英吸收池。
2 结果与讨论
2.1 荧光光谱
图2 A、B、C分别为华法灵钕配合物、水杨酸钕配合物和华法灵水杨酸钕配合物对HSA溶液荧光影响光谱图。以激发波长λex=282 nm分别激发HSA溶液和配合物溶液,HSA在λem=348 nm附近有很强的荧光发射峰,而华法灵钕、水杨酸钕与华法灵水杨酸钕3种配合物在该波长附近没有荧光发射峰。

固定HSA的浓度,依次加入相应的配合物溶液,随着配合物浓度的增加,HSA在λem=348 nm附近的荧光发射峰强度有规律地减弱,并且可以看到图2A中发射峰位置有略微的红移(从348 nm移至354 nm),HSA在348 nm附近的发射峰是色氨酸残基所产生的,而色氨酸残基的最大发射波长与它所处的环境有关,发射波长红移表明HSA中的色氨酸残基周围的疏水性有所降低[10-11]。图2B中的发射峰位置有略微蓝移(从348 nm移至343 nm),说明水杨酸钕与人血清蛋白之间通过一定的作用形成了复合物[10],发射波长蓝移这表明HSA的构象发生了变化,说明色氨酸残基周围的疏水性有所增加[10-11]。华法灵水杨酸钕配合物仅使HAS溶液的荧光强度有所降低。
2.2 荧光猝灭方式
荧光猝灭过程通常分为动态猝灭和静态猝灭两类[12-13]。动态猝灭主要是依赖于分子的扩散,温度越高,扩散系数越大,猝灭常数的改变与温度成正比。而静态猝灭,温度升高,基态配合物的稳定性越差,形成常数越小[14]。动态猝灭是猝灭剂和荧光物质的激发态分子之间的相互作用过程。其作用过程遵循Stern-Volmer方程:

其中F0为未加入猝灭剂时的荧光强度;F为加入猝灭剂后的荧光强度;Kq(L·mol-1·s-1)为双分子猝灭过程的速率常数;Kqτ0=Ksv(L·mol-1) 称为 Stern-Volmer猝灭常数,CQ为猝灭剂的浓度;τ0为没有猝灭剂存在时荧光分子的平均寿命,生物大分子的平均寿命约为10-8s[15];静态猝灭是猝灭剂和荧光物质分子相互作用生成不发光的基态化合物,从而导致荧光物质荧光强度降低的过程。其荧光强度与猝灭剂浓度之间的关系与公式(1)是相同的,但其常数的物理意义是基态的形成常数[16]。
根据(1)式,以F0/F-1对所加入的配合物浓度CQ作图,得到人血清白蛋白荧光的Stern-Volmer猝灭曲线。配合物HSA体系在不同温度下的Stern-Volmer曲线都近似为直线,说明配合物对HSA的荧光猝灭主要存在一种方式,动态猝灭或静态猝灭[17]。由(1)式求得猝灭速率常数见表1,各类猝灭剂对生物大分子的最大动态猝灭常数为2.0×1010L·mol-1·s-1[18],然而反应中双分子猝灭常数Kq远大于最大动态猝灭常数,且随着温度的升高,Kq值变小,该3种配合物对HSA的荧光猝灭过程不是动态猝灭而是配合物和HSA之间生成了不发荧光的复合物而导致的静态猝灭[19]。
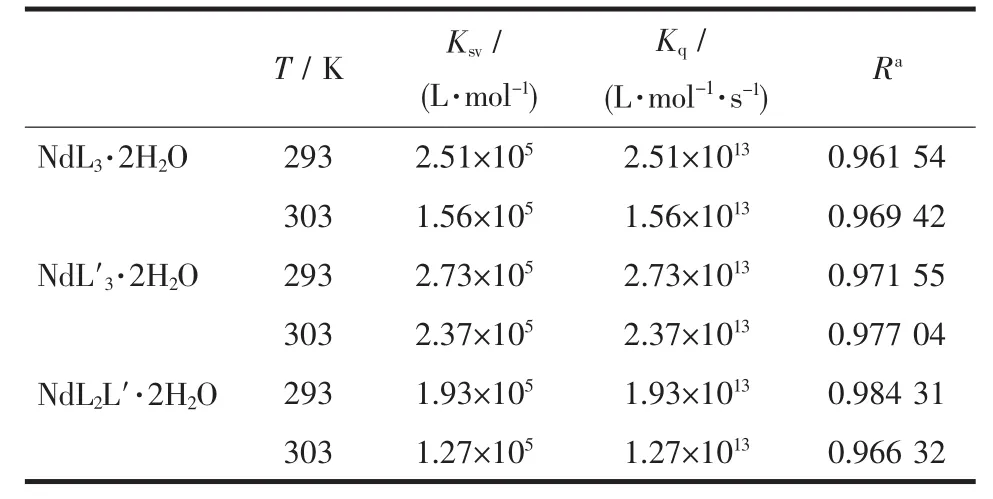
表1 配合物-HSA在不同温度的Stern-Volmer常数Table 1 Stern-Volmer quenching constant of K sv at different temperature
2.3 用静态猝灭法分析配合物与HSA相互的作用
在静态猝灭过程中,荧光物质与猝灭剂分子间的结合常数可根据荧光强度与猝灭剂浓度的关系求出。设蛋白质大分子有n个相同并且相互独立的结合位置。则有下式求出[20]:

其中F0为未加入猝灭剂时的荧光强度;F为加入猝灭剂后的荧光强度;K为静态猝灭常数,CQ为配合物的浓度。
相关数据代入式(2),得到lg(F0/F-1)与lg CQ的关系图,由图求出在不同温度下的NdL3·2H2O,NdL′3·2H2O 和 NdL2L′·2H2O 与 HSA 的结合常数 K以及结合位点数n(见表2)。从表2中可以看出:NdL3·2H2O,NdL′3·2H2O 和 NdL2L′·2H2O 的结合常数K均较小,较大的值也仅在1.0×102L·mol-1,表明配合物与HSA之间的结合力较弱,配合物与HSA的的结合常数随温度的升高而减小,进一步说明了这几种配合物对HSA荧光猝灭为静态猝灭过程。然而水杨酸钕(NdL′3·2H2O)的结合常数随温度的升高而增大,达到了 8.16×102L·mol-1,表明水杨酸钕配合物对HSA荧光猝灭以静态为主也含有一定的动态猝灭。
2.4 配合物与HSA之间的作用力类型
有机小分子和蛋白质等生物大分子之间的结合力主要有氢键、范德华力、静电引力、疏水作用力等。由反应前后热力学参数焓变ΔH和熵变ΔS的相对变化,可以判断小分子与蛋白质分子链之间的主要作用力类型[21]。假设在测定的温度变化范围内焓变的变化可以忽略,则焓变ΔH和熵变ΔS以及ΔG可以通过以下的热力学方程式求得(见表3):
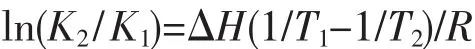

表3 热力学参数Table 3 Thermodynamic parameters
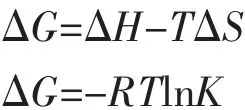
Mohammed等[22]根据大量的实验结果总结出判断生物大分子与小分子结合力性质的热力学规律,即:ΔS>0可能是疏水和静电作用力:ΔS<0可能为氢键和范德华力;ΔH>0,ΔS>0 为典型的疏水作用力;ΔH≈0或较小,ΔS>0 为静电作用力;ΔH<0,ΔS<0为氢键和范德华力。从表3数据中可以看出NdL3·2H2O-HSA 体系中 ΔH<0,ΔS>0,说明华法灵钕与HSA之间主要作用力是静电作用力;NdL′3·2H2O-HSA 体系中 ΔH>0,ΔS>0, 表明水杨酸钕与HSA之间主要作用力为典型的疏水作用力;NdL2L′·2H2O-HSA 体系中 ΔH<0,ΔS<0, 表明华法灵水杨酸钕与HAS之间为氢键和范德华力。3种配合物与HSA之间作用力的不同,与3种配合物的中心钕バ离子的有效核电荷的高低有关。因配位基团中的羧酸根所连接的基团不同,导致羧酸根供电子能力不同,直接影响到了中心离子的有效核电荷的高低。配合物 NdL3·2H2O和 NdL2L′·2H2O与HSA反应的ΔH<0,为放热反应,升高温度不利于反应正向进行,而NdL′3·2H2O与HSA反应的ΔH>0,为吸热反应,升高温度利于反应的正向进行,这与配合物的静态猝灭常数K值随温度的变化曲线相一致。
2.5 同步荧光光谱
固定激发波长和发射波长的间距Δλ,同步扫描激发和发射单色器可以得到同步荧光光谱,因其具有简化光谱、窄化谱带和减少光谱重叠等优点,而常被用于研究小分子对蛋白质构象的影响,进而探讨蛋白质构象的变化[17]。蛋白质的荧光主要来自于色氨酸、酪氨酸和苯丙氨酸所产生的荧光,它们的荧光强度之比一般为 100∶9∶0.5。 由于苯丙氨酸的荧光强度太弱,所以一般重点考察构象发生变化的是色氨酸还是酪氨酸。在Δλ=15 nm与Δλ=60 nm时,HSA的同步荧光分别显示酪氨酸残基和色氨酸残基的特征信息[23]。
图3为NdL′3·2H2O与HSA相互作用的同步荧光光谱。室温20℃下,固定HSA的浓度,逐渐增加配合物的浓度,记录Δλ=15 nm与Δλ=60 nm时的同步荧光光谱。发现酪氨酸残基的最大发射波长稍有红移(从280 nm移至286 nm),而色氨酸残基的最大发射波长蓝移(从280 nm移至276 nm)。表明配合物的加入使HSA的构象发生变化,酪氨酸残基所处环境的疏水性增加,色氨酸残基所处环境的疏水性降低。配合物分子的结合部位可能处于HSA亚结构域中圆筒状的疏水腔内,导致HSA内部的疏水结构有一定程度的瓦解。NdL3·2H2O和NdL2L′·2H2O与HSA相互作用的同步荧光光谱与NdL′3·2H2O与HSA相互作用的同步荧光光谱类似。

2.6 紫外光谱
华法灵钕、水杨酸钕和华法灵水杨酸钕在260~300 nm范围内无吸收。图4为NdL2L′·2H2O配合物对HSA的紫外紫外吸收光谱的影响图。随着配合物的加入,HSA在278 nm处的吸收强度逐渐增强,并且峰位略微红移3~4 nm。
HSA在278 nm处的吸收峰是其肽链上的酪氨酸和色氨酸的苯杂环π-π*跃迁引起的,吸收强度随着配合物浓度的增加而加强,说明以上3种配合物与HSA发生了作用,从而诱导HSA分子链发生了类似降低pH值所出现的蛋白质肽链伸展现象[24]以至被包含在HSA内部的色氨酸和酪氨酸残基的芳杂环疏水基团裸露出来,使吸收峰的强度增加,与此同时疏水基团之间的疏水作用减弱,由于HSA与加入的配合物生成了新的共轭体系,增加了新的π-π*跃迁,π-π*跃迁能量增大,使得吸收峰发生了略微的红移。NdL3·2H2O 和 NdL′3·2H2O 与 HSA 相互作用的紫外光谱与NdL2L′·2H2O与HSA相互作用的紫外光谱类似。

2.7 HSA的构象变化
蛋白质的各种二级结构(α-螺旋、β-折叠、转角、无规卷曲)在远紫外圆二色谱(178~250 nm)区域存在特征峰[25]。如无规卷曲结构的特征峰为195 nm左右的1个负强峰(负科顿效应所对应);而β-折叠的特征峰为217 nm处的1个负宽峰及198 nm处的1个正强峰(正科顿效应所对应);对于α-螺旋则对应于 192 nm(正)、209 nm(负)以及 222 nm(负)3 个峰位置[26-27]。
由于HSA是具有光学活性的物质,因此通过测量它的CD图谱,帮助我们了解它的构象,当加入配合物之后,通过观察其CD图谱的变化来进一步了解其结构的变化。
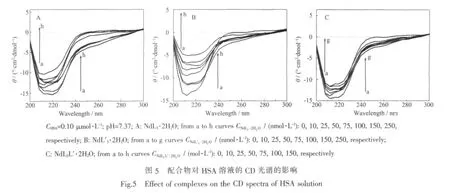
图5所示,随着配合物浓度的增加,HSA分子典型的二级结构α-螺旋在209 nm和222 nm处的负峰略微向低波数方向移动,并且相应的振幅也显著地减弱。表明配合物与HSA分子发生了相互作用,从而使得HSA肽链伸展,影响了HSA的二级结构,导致了α-螺旋结构减少[28]。这个结果与配合物存在时HSA溶液的荧光光谱中的变化相一致。当配合物 NdL3·2H2O 浓度增大到 50 nmol·L-1时 (图5A,d),208 nm处负峰振幅继续减小,222 nm处负峰的振幅反而增大,说明此时部分HSA分子在结构上发生了一些变化。当配合物NdL2L′·2H2O浓度增大到 25 nmol·L-1时(图 5C,c),也出现 208 nm 处负峰振幅继续减小而222 nm处负峰的振幅增大的现象。通过计算得到图5A中的α-螺旋结构由42.86%减少到22.30%;图5C中的α-螺旋结构由42.86%减少到25.50%[29-30]。
3 结 论
通过荧光光谱分析得知,有抗凝血作用华法灵钕和华法灵水杨酸钕配合物对于HSA的猝灭效应属于两者之间生成了不发荧光的复合物而导致静态猝灭,而水杨酸钕是动态猝灭与静态猝灭两种效应导致的猝灭。并确定了它们的结合力类型,华法灵钕(NdL3·2H2O)与HSA之间主要作用力是静电作用力;水杨酸钕(NdL′3·2H2O)与 HSA 之间主要作用力为典型的疏水作用力;华法灵水杨酸钕(NdL2L′·2H2O)与HSA之间为氢键和范德华力。通过HSA溶液的同步荧光光谱、紫外吸收光谱和圆二色谱的变化可知,配合物的加入,影响了HSA的二级结构,导致α-螺旋结构减少。具抗凝血作用的NdL3·2H2O;NdL2L′·2H2O 和 NdL′3·2H2O 与 HSA 结合后,改变了HSA的构象,这对于研究血液中由血清白蛋白的构象变化而导致的溶解性变化与血栓的形成有着一定的启示意义。
[1]SONG Yu-Ming(宋玉民),DONG Yin-Long(董银龙),FU Yun-Long(付云龙),et al.Acta Chim.Sin.(Huaxue Xuebao),2007,65(8):678-682
[2]WANG Kun-Jie(王坤杰),LUAN Ni-Na(栾尼娜),SONG Yu-Ming(宋玉民).Acta Chim.Sin.(Huaxue Xuebao),2009,67(10):1042-1046
[3]Wang K J,Li H X,Song Y M,et al.Biopolymers,2010,93(10):887-892
[4]SONG Yu-Ming(宋 玉 民),LIU Zhe(刘 哲),WANG Kun-Jie(王坤杰),et al.Acta Chim.Sin.(Huaxue Xuebao),2010,68(21):2191-2198
[5]LIU Zhe(刘哲),WANG Kun-Jie(王坤杰),SONG Yu-Ming(宋玉民),etal.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2010,26(1):72-78
[6]ZHANG Qiong(张琼),SONG Yu-Ming(宋玉民).Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2011,27(9):1772-1780
[7]SONG Yu-Ming(宋玉民),WU Jin-Xiu(吴锦绣),ZHENG Xiu-Rong(郑秀荣),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2006,22(9):1615-1622
[8]SONG Yu-Ming(宋玉民),ZHANG Qiong(张琼),LI Qing-Ping(李清萍),et al.J.Northwest Normal Univ.(Xibei Shifang Daxue Xuebao),2011,47(1):48-52
[9]ZHANG Qiong(张琼).Thesis for the Masterate of Northwest Normal University(西北师范大学硕士论文).2011.
[10]ZHAO Yan(赵妍),CAO Yi(曹燚),HAN Fen-Mei(韩凤梅),et al.Spectrosc.Spectral Anal.(Guangpuxue Yu Guangpu Fenxi),2008,28(4):904-907
[11]YANG Mei-Ling(杨美玲),YANG Pei-Ju(杨培菊),SONG Yu-Ming(宋玉民).Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2005,21(4):483-489
[12]YANGPin(杨频),GAOFei(高飞).Principlesof Bioinorganic Chemistry(生物无机化学原理).Beijing:Science Press,2002:329-331
[13]ZHONG Wei-Qing(仲维清),ZHANG Qi(张琦),YUE Chen(岳晟),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),1997,13(3):241-250
[14]Lakowiez J R.Principles of Fluorom etric Spectroscopy.New York:Plenum Press,1983:187-214
[15]ZHA Dan-Ming(查丹明),LI Shu-Tin(李舒婷),YANG Yong-Fei(杨勇飞),et al.Spectrosc.Spectral Anal.(Guangpuxue Yu Guangpufenxi),1999,19(6):788-791
[16]LU Yan(卢雁),GAO Sheng-Hua(高胜华),WANG Yun-Lai(王运来),et al.Chin.Sci.Bull.(Kexue Tongbao),2009,54(14):2071-2075
[17]CHEN Guo-Zhen(陈国珍),HUANG Xian-Zhi(黄贤智),XU Jin-Guo(许金钩),et al.Fluorimetric Analysis.2nd Ed.(荧光分析.2版).Beijing:Science Press,1990:201-212
[18]XIE Meng-Xia(谢孟峡),XU Xiao-Yun(徐晓云),WANG Ying-Dian(王英典),et al.Acta Chim.Sin.(Huaxue Xuebao),2005,63(22):2055-2062
[19]Lakowicz JR.Principles of Fluorescence Spectroscopy.2nd Ed.New York:Plenum Press,1999:209-212
[20]YAN Hua(闫 华),YANG Jian-Guo(杨 健 国 ),LIANG Hua-Ding(梁华定).Acta Phys.-Chim.Sin.(Wuji Huaxue Xuebao),2008,24(3):543-548
[21]Ross PD,Subamanian S.Biochemistry,1981,20:3096-3102
[22]Mohammed H R,Toru M,Tomoko O,et al.Biochem.Pham.,1993,46(10):1721-1731
[23]Miller JN.Proc.Anal.Div.Chem.Soc.,1979,16:203-208
[24]LI Xiao-Jin(李晓晶),WANG Zhi-Qiang(王志强),CHEN Ji(陈继).Chin.J.Appl.Chem.(Yingyong Huaxue),1998,15(1):5-8
[25]Greenfield N.Trends Anal.Chem.,1999,18:236-239
[26]LI Lian-Zhi(李连之),JI Hai-Wei(冀海伟),ZHAO Chao(赵超).Chin Sci.Bull.(Kexue Tongbao),2005,50(6):964-968
[27]ZHAO Chao(赵超),LI Lian-Zhi(李连之),JI Hai-Wei(冀海伟).Chem.J.Chin.Univ.(Gaodeng Xuexiao Huaxue Xuebao),2006,27(3):641-645
[28]SHEN Xin-Can(沈星灿),LIANG Hong(梁宏),HE XI-Weng(何锡文),et al.Chin.J.Anal.Chem.(Fenxi Huaxue),2004,33(2):388-392
[29]YANGPin(杨频),GAOFei(高飞).Principlesof Bioinorganic Chemistry(生物无机化学原理).Beijing:Science Press,2002:348-349
[30]Milese A J,Janes R W,Brown A.J.Synchrotron Radiat.,2008,15:420-422
