二茂铁修饰Aβ疏水段五肽的电化学性质及自组装研究
2013-09-15魏传晚刘又年
魏传晚 李 娟 刘又年*,
(1中南大学化学化工学院,长沙 410083)(2南华大学化学化工学院,衡阳 421001)
近年来,多肽的自组装逐渐成为分子生物学、化学、材料学和生物医学等领域的研究热点。1993年,Ghadiri等[1]设计并合成了含有8个氨基酸残基的环多肽(cyclo-[(L-Gln-D-Ala-L-Glu-D-Ala)2-]),该环肽可以在水溶液中自组装形成纳米管状结构;同年,Zhang等[2]从酵母蛋白中发现了一组可自组装形成水凝胶膜的离子互补型十六肽;随后,一系列具有自组装行为的多肽被国内外科学家相继报道。如Aggeli等[3]发现多肽分子之间的β-折叠结构使多肽自组装成规整的纳米纤维;Gazit等[4-5]报道了二肽FF及其衍生物可以通过苯环间的π-π堆积作用自组装形成纳米管、纳米空心球以及纳米纤维等结构;Krysmann等[6]发现七肽AAKLVFF能在甲醇溶液自组装形成纳米管,并指出苯丙氨酸残基芳香环之间的π-π堆积对形成β-折叠具有重要作用,还提出双层β-折叠螺旋卷曲形成纳米管的模型;Lu和Lynn[7-8]发现KLVFFAE能自组装形成β-折叠结构为主的纳米纤维和纳米管;周庆翰等[9]设计了一种对称结构多肽,该多肽在水溶液中形成纳米纤维结构;王净[10]合成了系列两亲性多肽,并发现A3K能自组装形成层状结构;A6K自组装形成纳米纤维结构;而A9K自组装形成纳米短棒结构;马鑫等[11]合成了A6K的二倍体A6KA6K,其能在水溶液中自组装形成纳米囊泡状结构。
二茂铁衍生物具有亲脂性、高稳定性、氧化还原性和多种生物(理)活性等特点而被广泛应用于生物学、医学、微生物学、材料学等领域[12-16]。近年来,我们课题组合成了多种二茂铁-多肽化合物,并将其用于生物分子的检测[17-19]、Aβ阻断剂[20]、金属离子检测[21]以及单晶培养等领域[22]。此外,芳香族功能基还可作为疏水性基团引入到多肽链段的一端提供π-π堆积作用并被广泛运用于两亲性多肽自组装行为的研究[23-25]。
许多研究表明,阿尔茨海默氏症 (Alzheimer′s disease)与 β-淀粉样肽(Aβ)疏水核心片段(KLVFF)的β-折叠空间结构所导致的淀粉样沉淀聚集有关[26-28]。目前,未见用二茂铁标记β-淀粉样肽(Aβ)疏水核心片段进行自组装的研究报道。在本研究中,我们将具有良好电化学特性[29],且易与多肽、蛋白质和DNA等结合的芳香化合物二茂铁与Aβ疏水核心片段多肽相结合,得到以二茂铁作为芳香端基的多肽,即 Fc-Lys(Z)-Leu-Val-Phe-Phe-OMe(Fc-KLVFF),并利用透射电镜、傅里叶红外、紫外-可见和荧光光谱等方法对Fc-KLVFF在甲醇溶液中的自组装行为进行研究,还采用电化学方法研究了Fc-KLVFF的电化学性能。
1 实验部分
1.1 主要仪器与试剂
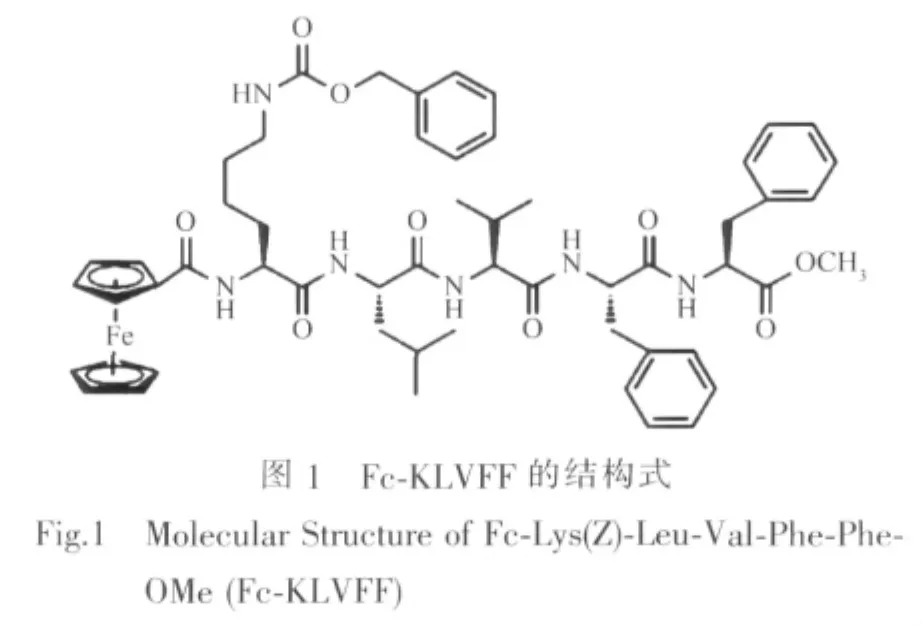
本实验所研究二茂铁-多肽(Fc-KLVFF)的合成参照文献[30]合成并经过质谱和核磁确证,二茂铁-多肽Fc-KLVFF序列如图1所示。甲醇为色谱纯(美国Tedia公司),其它试剂均为市售分析纯试剂,去离子水使用Milli-Q纯水仪制备。
AVATAR360傅里叶变换红外光谱仪 (美国Nicolet公司),电化学工作站(CHI-440,上海辰华仪器有限公司),F-2500荧光分光光度计(日本Hitachi公司),JEM-1230透射电子显微镜 (日本JEOL公司)。
将Fc-KLVFF溶解于甲醇溶液中,制成浓度为0.2%的甲醇溶液,密封并在避光的室温条件下进行自组装培养。
1.2 实验方法
1.2.1 透射电镜
采用JEOL JEM-1230透射电镜观察自组装的纳米管的微观结构,电镜工作电压为80~100 kV。取一滴Fc-KLVFF的甲醇溶液置于铜网格上,多余的溶液用无尘滤纸移除,空气中风干约5 min,将铜网置于在透射电镜下扫描。
1.2.2 电化学实验
以玻碳电极为工作电极,Ag/AgCl电极为参比电极,铂丝(Pt)电极为对电极。将化合物配成0.5 mmol·L-1的 DMSO 溶液, 缓冲液为 20 mmol·L-1的PBS 溶液(pH=7.4),加入 0.1 mol·L-1的 NaCl溶液作为支持电解质,进行循环伏安测试,扫描速度为0.05~1.0 V·s-1,扫描范围为 0.4~0.8 V。
1.2.3 傅里叶红外(FT-IR)光谱分析
FT-IR光谱分析采用AVATAR360傅里叶变换红外光谱仪,分辨率为2 cm-1。采用空白KBr压片液膜法测定样品的红外图谱。先用滴有甲醇溶液的KBr薄片作为空白背景,然后将一片KBr片固定在样品架上,将Fc-KLVFF的甲醇溶液样品滴1~2滴于KBr片上,迅速盖上另一块片,固定好迅速放入仪器中进行FT-IR扫描。
1.2.4 荧光光谱
取0.05%Fc-KLVFF的甲醇溶液移入微量比色皿测试荧光光谱。激发波长(Ex)265 nm,光栅(Exand EmBandpass)5 nm。
2 结果与讨论
2.1 化合物Fc-KLVFF的电化学性能研究
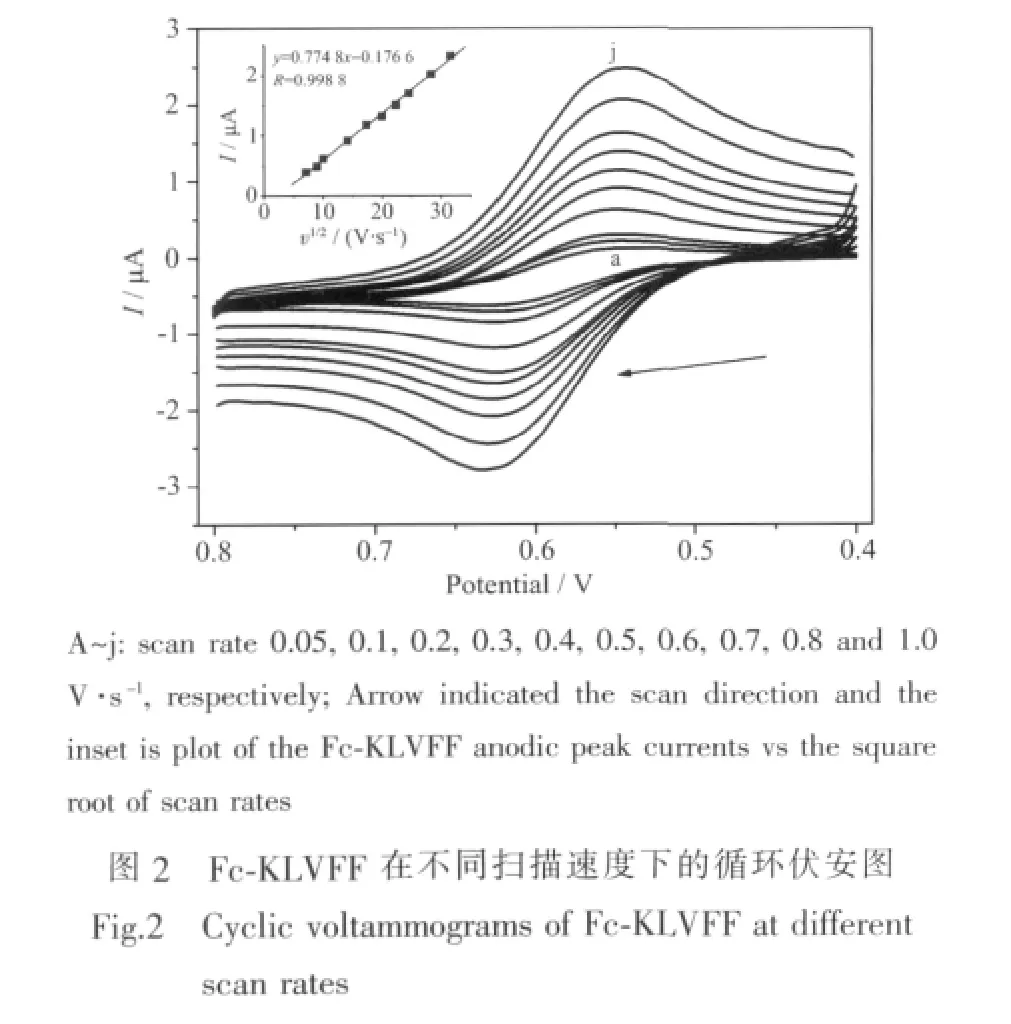
通过循环伏安法(CV)对合成的产物Fc-KLVFF的电化学性能进行测试,结果如图2所示。由图2可知,CV扫描结果 (扫描速率为 100 mV·s-1),在0.4~0.8 V范围内出现了一对可逆的氧化还原峰,氧化峰和还原峰电位分别为0.544和0.626 V,峰电位之差 ΔEp=82 mV,峰电流密度之比 Ipa/Ipc=1.08,表明Fc-KLVFF在溶液中的良好的电子传递能力,该对氧化还原峰对应于Fc/Fc+的氧化还原反应过程。
在扫描速率为 0.05~1.0 V·s-1范围内, 阳极峰电流和扫描速率的平方根呈线性关系 (如图2中插图所示),并根据方程(1)得出扩散系数 D0=1.784×10-6cm2·s-1,表明相应的电化学过程主要受扩散控制[31]。

式中:R,普适常数;T,温度;A,电极面积(cm2);D0,扩散系数(cm2·s-1);v,扫描速度(V·s-1);C0,物质初始浓度(mol·L-1);F,法拉第常数;n,传递电子数。
2.2 光谱研究Fc-KLVFF的自组装
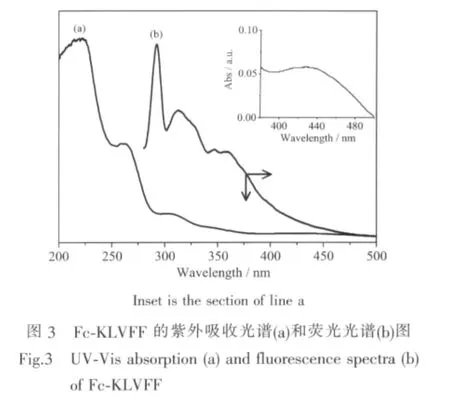
室温下以甲醇溶剂为溶剂,进行校零,测得Fc-KLVFF甲醇溶液的紫外可见吸收光谱图,如图3a所示。其中,210 nm峰是酰胺吸收峰,260 nm处是苯丙氨酸残基苯环的吸收峰[6,32],305 nm和 435 nm处则为二茂铁的特征吸收峰(参见图3中的插图)[33-35]。260 nm处吸收峰较单个苯环的紫外吸收红移了6 nm,且吸收强度增强,说明多肽链间存在芳香堆积作用。荧光光谱为自组装的纳米管多肽链间的芳香堆积作用提供了进一步的证据。在图3b的荧光光谱中,290 nm处的强发射峰对应苯丙氨酸残基苯环的π-π堆积作用[6,36]。311 nm处的弱峰是溶剂中痕量水的拉曼峰[37]。由此可见芳香环之间的ππ堆积作用在 Fc-KLVFF自组装成纳米管中起着重要作用。
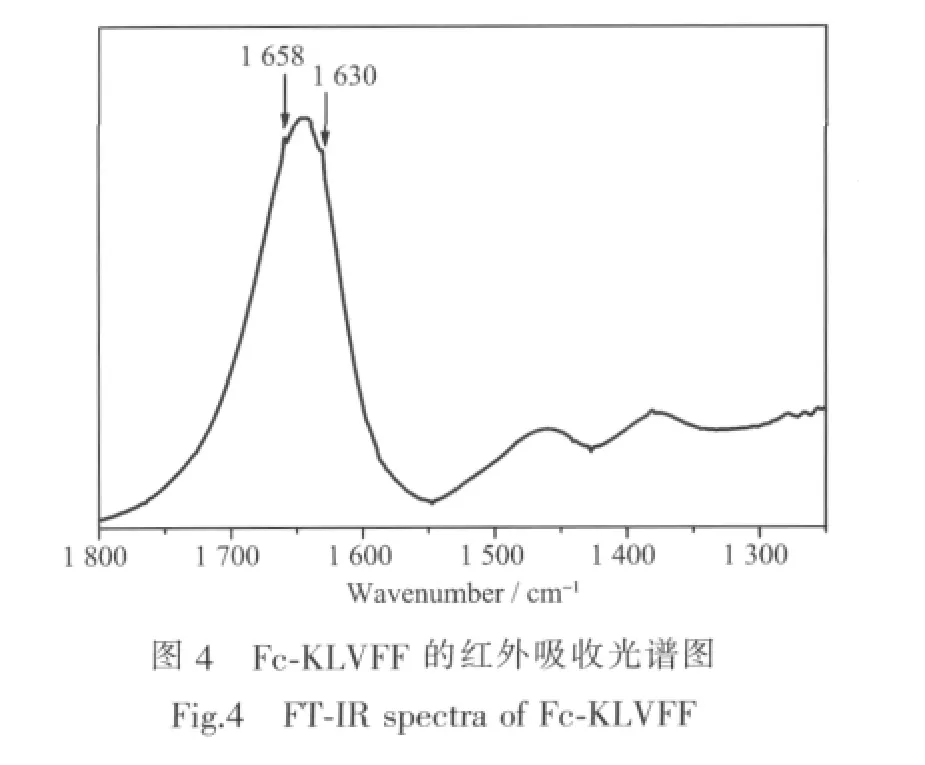
蛋白质和多肽的红外吸收光谱的酰胺Ⅰ带(1 700~1 600 cm-1)可以反映其二级结构的丰富信息,酰胺Ⅰ带主要是氨基酸残基的C=O伸缩振动吸收带。从图4可以看出,图谱中只有酰胺Ⅰ带附近有较强吸收峰,在1 630 cm-1处的较强吸收峰可指认为 β-折叠(pleatedβ-sheet)结构产生的吸收峰[38-42],我们推测Fc-KLVFF在甲醇溶液中自组装成的纳米管含有β-折叠结构。而1 644~1 658 cm-1的强吸收峰可归属为样品中痕量水或无规卷曲 (random coil)产生的吸收峰[40-42],可能是Fc-KLVFF在自组装过程中还有部分没有自组装成纳米管,形成一些无序结构聚集物的原因。
2.3 二茂铁-多肽纳米管的TEM及自组装机制的研究
图5为Fc-KLVFF在甲醇溶液中自组装的TEM照片,从图5(a~c)可以观察发现Fc-KLVFF自组装形成纳米管状结构,在图5(b)可以看到几根并列紧靠在一起的多肽纳米管,而在图5(c)中可以观察到一根管壁未完全封闭的多肽纳米管。随着孵育时间延长至3个月,多肽纳米管的宽度相应增加(见图5(d))。

经过紫外、荧光、红外光谱研究纳米管二级结构的实验结果和透射电镜图片的综合分析,发现Fc-KLVFF的自组装机制类似于Lynn等[7-8]研究七肽KLVFFAE能自组装形成的纳米管时所建立的自组装模型。结合Fc-KLVFF的结构特点,我们推测二茂铁-多肽自组装的过程如图6所示,首先Fc-KLVFF分子通过氨基酸残基之间氢键作用形成β-折叠,β-折叠则可以继续堆叠/层压(stack/laminated)形成的 β-折叠片层(β-sheet lamination)如图 6(b)所示[8],然后 β-折叠片层采用一种“头-尾”相接(end to end)的排列方式形成一个面积更大的β-折叠片层(图6(c)),大β-折叠片层在多肽侧链间的氢键和芳香堆积作用等作用力下螺旋卷曲 (helical wrapping)形成纳米管(图6(d))[6-8]。随着纳米管孵育时间的延长,Fc-KLVFF可以继续聚集到已长成的纳米管上(图6(e)),因此,多肽纳米管的长度和宽度都相应增加,如图5(d)所示。可能是孵育过程中受到扰动等影响,大β-折叠片层出现了缺损,致使大β-折叠片层卷曲成的纳米管中出现只有部分管壁的现象 (见图5(c)),图5(c)中这种管壁封闭不完全的现象,为我们提出的二茂铁-多肽自组装模型提供了实验支持。

3 结 论
设计了一种新型的二茂铁标记的β-淀粉样肽(Aβ)疏水核心片段多肽Fc-KLVFF,对其进行了溶液电化学研究,发现其具有良好的电化学性能。通过TEM观察到Fc-KLVFF在甲醇溶液中自组装成纳米管,利用红外、紫外-可见和荧光光谱对纳米管的二级结构进行了研究,结果表明Fc-KLVFF通过分子间芳香残基之间的π-π堆积作用和氨基酸残基之间氢键的共同作用形成含有β-折叠的二茂铁-多肽纳米管,并推测出二茂铁-多肽可能的组装模型。为进一步研究神经退行性疾病的发生发展过程提供了理论依据。二茂铁-多肽纳米管电化学性质及应用研究正在进行中。
[1]Ghadiri M R,Granja JR,Milligan R A,et al.Nature,1993,366(6453):324-327
[2]Zhang S,Holmes T,Lockshin C,et al.Proc.Nat.Acad.Sci.USA,1993,90(8):3334-3338
[3]Aggeli A,Nyrkova I A,Bell M.et al.Proc.Nat.Acad.Sci.USA,2001,98(21):11857-11862
[4]Reches M,Gazit E.Science,2003,300(5619):625-627
[5]Reches M,Gazit E.Nano Lett.,2004,4(4):581-585
[6]Krysmann MJ,Castelletto V,McKendrick JE,et al.Langmuir,2008,24(15):8158-8162
[7]Lu K,Jacob J,Thiyagarajan P,et al.J.Am.Chem.Soc.,2003,125(21):6391-6393
[8]Mehta A K,Lu K,Childers W S,et al.J.Am.Chem.Soc.,2008,130(30):9829-9835
[9]ZHOUQing-Han(周庆翰),LINJuan(林 娟),LUOJian-Bin(罗建斌).J.Southwest Univ.National.:Nat.Sci.Ed.(Xinan Minzu Daxue Xuebao:Ziran Kexue Ban),2011,37(3):437-440
[10]WANG Jing(王净).Thesis for the Doctorate of China University of Petroleum(East China)(中国石油大学(华东)博士论文).2010.
[11]MA Xin(马鑫),MENG Qing-Bin(孟庆斌),KOU Ying-Ying(寇莹莹),et al.Chem.J.Chinese Universities(Gaodeng Xuexiao Huaxue Xuebao),2011,32(8):1774-1778
[12]Van Staveren D R,Metzler-Nolte N.Chem.Rev.,2004,104(12):5931-5985
[14]Peng Y,Jiang D,Su,L et al.Anal.Chem.,2009,81(24):9985-9992
[15]XUE Ya-Dong(薛亚东).Thesis for the Doctorate of Nanjing University(南京大学博士论文).2010.
[16]ZHOU Mi(周密),ZHU Jun-Jie(朱俊杰),ZHA Jian-Wei(赵健伟).Acta Phys.-Chim.Sin.(Wuli Huaxue Xuebao),2007,23(1):46-50
[17]WANG Bei(王蓓),WEI Chuan-Wan(魏传晚),LI Xia(李霞),et al.Acta Chim.Sin.(Huaxue Xuebao),2008,66(3):349-354
[18]Peng Y,Liu Y N,Zhou F.Electroanalysis,2009,21(16):1848-1854
[19]WANG Fang-Bin(王芳斌),PENG Yong(彭勇),FAN Mei-Yi(范美意),etal.Acta Phys.-Chim.Sin.(Wuli HuaXue Xuebao),2009,25(6):1125-1130
[20]LI Xue-Qiang(李学强),WEI Chuan-Wan(魏传晚),LIU Xiao-Fang(刘晓芳),et al.Chin.J.Org.Chem.(Youji HuaXue),2010,30(10):1492-1496
[21]YE Wu-Long(叶武龙),PENG Yong(彭勇),LI Xue-Qiang(李学强),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2010(10):1820-1824
[22]Xiang J,Peng Y,Schatte G,et al.Z.Kristallogr.,2009,224(11):551-555
[23]Smith A M,Williams R J,Tang C,et al.Adv.Mater.,2008,20(1):37-41
[24]Gazit E.Chem.Soc.Rev.,2007,36(8):1263-1269
[25]Ulijn RV,Smith A M.Chem.Soc.Rev.,2008,37(4):664-675
[26]Goedert M,Spillantini M G.Science,2006,314(5800):777-781
[27]Roberson E D,Mucke L.Science,2006,314(5800):781-784
[28]Hamley I W.Angew.Chem.Int.Ed.Engl.,2007,46(43):8128-8147
[29]MAO Wei-Li(毛薇莉),LI Yi-Zhi(李一志),SU Yang(苏杨),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2007,23(7):1201-1205
[30]Wei CW,Peng Y,Zhang L,et al.Bioorg.Med.Chem.Lett.,2011,21(19):5818-5821
[31]Bard A J,Faulkner L R.,Translated by SHAO Yuan-Hua(邵元华),ZHU Guo-Yi(朱果逸),DONGXian-Dui(董献堆),et al.Electrochemical Methods,Fundamentals and Applications.2nd ed.(电化学方法、原理和应用.2版).Beijing:Chemical Industry Press,2005:159
[32]Hamley I W,Castelletto V,Moulton C,et al.Macromol.Biosci.,2010,10(1):40-48
[33]Mata J A,Peris E,Asselberghs I,et al.New.J.Chem.,2001,25:299-304
[34]Curnow O J,Fern G M,Jenkins E M.J.Organomet.Chem.,2006,691:643-647
[35]Caballero A,Espinosa A,Trraga A,et al.J.Org.Chem.,2007,72:6924-6937
[36]Haris PI,Chapman D.Biopolymers,1995,37(4):251-263
[37]LI Hong-Liang(李宏亮),ZHANG Jia-Ling(张加玲),TIAN Ruo-Tao(田若涛).Chinese J.Health Lab.Tech.(Zhongguo Weisheng Jianyan Zazhi),2009,19(3):478-480
[38]Byler D M,Susi H.Biopolymers,1986,25(3):469-487
[39]XIE Meng-Xia(谢孟峡),LIU Yuan(刘媛).Chem.J.Chinese Universities(Gaodeng Xuexiao Huaxue Xuebao),2003,24(2):226-231
[40]Jackson M,Mantsch H H.Crit.Rev.Biochem.Mol.Biol.,1995,30(2):95-120
[41]Pelton J T,McLean L R.Anal.Biochem.,2000,277(2):167-176
[42]Krysmann MJ,Castelletto V,Kelarakis A,et al.Biochemistry,2008,47(16):4597-605