3-巯基丙酸自组装单层控制碳酸钙晶型及形貌的研究
2013-09-15王海水
张 素 王海水
(华南理工大学化学与化工学院,广州 510640)
0 引 言
碳酸钙作为一种重要的生物矿化材料,同时也是一种非常重要的无机化工产品,已被广泛应用于建材,橡胶,涂料,油墨,造纸,塑料,医药等行业中[1-2]。不同的应用领域对材料性质有不同的要求,因此实际工业生产中对碳酸钙的晶型和形貌等都有特定的要求。无水碳酸钙通常有3种晶型:方解石,文石,球霰石。方解石是3种晶型中最稳定的,属于三方晶系;文石的稳定性次于方解石,属于斜方晶系,常存在于生物体的骨骼和壳体;而球霰石是3种晶型中最不稳定的,属于六方晶系,潮湿环境和水溶液中会自发的转化为方解石或者文石。球霰石在有机质中少量存在,但是对某些软体动物的生命和健康起着重要的作用[3-5]。由于在溶液的自发结晶生长过程中,碳酸钙往往以两种或者三种晶型同时共存,因此近20年来利用体外模拟生物矿化的方法合成性能优异的,晶型和形貌均一的碳酸钙材料一直受到科学家们的关注。
目前用于控制碳酸钙晶型和形貌的制备方法有多种,如表面活性剂、生物高分子聚合物、氨基酸、蛋白质等添加剂方法[6-9],Langmuir膜、Langmuir-Blodgett膜和自组装单层(SAMs)等模板方法[10-13],凝胶介质等控制多孔性方解石晶体的生长技术[14-17]。作为模拟生物矿化的重要模板,自组装单层具有分子排列高度有序,外露功能团可以有多种选择等优点,有序排列的有机分子可以诱导和调控无机晶体的成核和生长,这与生物矿化有异曲同工之妙。因此自组装单分子膜作为模板诱导无机晶体的生长已被广泛的研究应用[12-13,18-19]。
本研究工作中,采用了3-巯基丙酸自组装单层作为模板来诱导碳酸钙晶体的生长。利用XRD,SEM以及显微拉曼(Micro-Raman)技术对得到的碳酸钙晶体进行了表征。在25℃条件下,溶液中自发沉淀同时得到了3种不同的碳酸钙晶型,即方解石、文石和球霰石;而在3-巯基丙酸自组装单层存在情形时,只诱导生长了典型的菱面体方解石并且方解石的形状规整,表明自组装单层对碳酸钙晶体的成核和生长有重要调控能力。温度对自组装单层诱导晶体的结晶习性也有重要影响。同样的自组装单层存在条件下,常温25℃条件下得到正常的菱面体方解石,而60℃条件下则得到了多孔性菱面体方解石。这是首次利用自组装单层在较高的温度条件下诱导得到特异结构的多孔性方解石,这为合成多孔碳酸钙晶体提供了新路径。
1 实验部分
1.1 试剂和样品的制备
试剂:3-巯基丙酸(HSCH2CH2COOH)(99%)购于阿拉丁试剂;氯化钙和碳酸铵为分析纯试剂;实验用水为Milli-Q超纯水,电阻率不低于18 MΩ·cm-1。
基片的处理:镀金片定制于济南奥波光电科技有限公司,金(111)面;镀金片置入新配置的Piranha(体积比为7∶3的浓硫酸和双氧水(30%)的混合液)溶液中,90℃水浴20 min;取出用水冲洗干净,N2吹干待用。显微载玻片依次在Piranha溶液,无水乙醇,超纯水中超声处理10 min,N2吹干后备用。
自组装膜(SAMs)的制备:处理好的镀金片置于配置好的 10 mmol·L-1的 3-巯基丙酸 50 mL溶液中,浸泡4 h,然后取出,超纯水冲洗干净,N2吹干,得到3-巯基丙酸自组装膜。
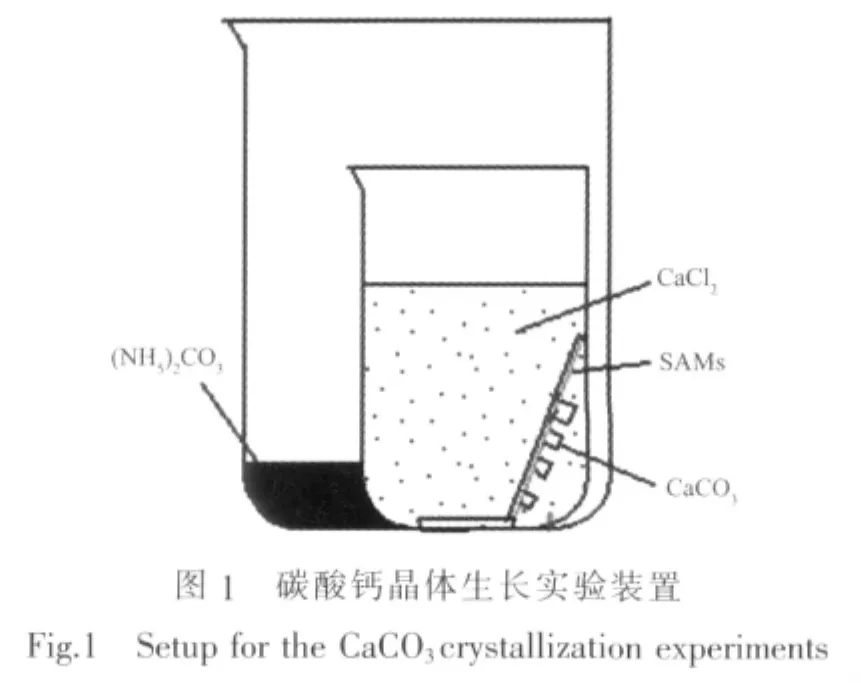
SAMs诱导晶体的生长:将生长有3-巯基丙酸自组装膜的镀金片倾斜放入装有20 mL 5 mmol·L-1的氯化钙溶液中(初始pH=9.0,25 mL烧杯),镀金片斜靠在烧杯壁上并保持自组装膜面朝向斜下方;清洁的载玻片直接置于烧杯底部用于防止镀金片的滑动。用干净的保鲜膜将盛氯化钙溶液的小烧杯口密封并且在保鲜膜上扎6个小孔,备气体CO2和NH3进出,再将小烧杯放入装有(NH4)2CO3(1.5 g)的150 mL大烧杯中,再用保鲜膜密封大烧杯口,整个反应装置置于设置好温度的干燥箱中,实验装置如图1所示。碳酸铵分解产生的二氧化碳和氨气可以透过保鲜膜上的6个小孔进入小烧杯,它们溶解在溶度积Ksp时,就可以制备得到碳酸钙晶体。
1.2 仪器及样品的检测
仪器:X射线粉末衍射仪 (Bruker D8 Advance,Germany);扫描电子显微镜 (HITACHI S-3700N,Japan);显微拉曼光谱仪 (Horiba Jobin Yvon,LabRAM Aramis)。
样品的检测:用XRD对晶体进行物相分析,测试条件为Cu的Kα,λ=0.154 18 nm辐射,扫描速度17.7°·min-1,电压为 40 kV,电流为 40 mA。样品喷金处理后,在10 kV扫描电压下用SEM进行形貌观察。显微拉曼对晶体中的部分晶型进行微区分析表征,激发波长为532.8 nm,激光功率50 mW,扫描累加2次。
2 结果与讨论
2.1 溶液中沉积的碳酸钙晶体
常温下,碳酸铵可以分解:

分解产生的氨气和二氧化碳通过保鲜膜上的小孔不断扩散并溶解到小烧杯中的CaCl2溶液中,使溶液中碳酸根离子浓度迅速增加。
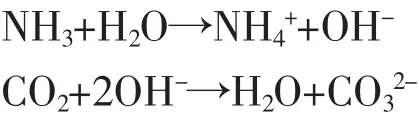
图3为溶液中得到的碳酸钙晶体的XRD图(a)和显微拉曼光谱图(b)。从XRD图中可以看出最强的是方解石的(104)峰。将XRD纵坐标放大,见图3a内插图。内插图上可以清晰的看到方解石(C)、球霰石(V)和文石(A)的衍射峰,这与观察到的SEM图相吻合,即溶液中获得的沉淀物存在3种晶型。显微拉曼光谱可以进行微区分析,直接给出SEM图片中的不同晶型的光谱。图3b上部的图谱为文石的拉曼光谱,其中144和196 cm-1是文石的晶格振动峰,705 cm-1是文石中CO32-的面内弯曲振动,1 082 cm-1对应的是文石中CO32-的对称伸缩振动;图3b下部的图谱为球霰石的拉曼光谱,106和262,1 089 cm-1分别对应球霰石的晶格振动及其中的CO32-的对称伸缩振动。这与文石和球霰石的拉曼结果完全符合[20]。

2.2 沉积在自组装单层上的碳酸钙晶体
文献报道中,自组装单层诱导碳酸钙晶体生长时经常使用Kitano过饱和碳酸钙溶液。采用碳酸铵分解法的优点是,随着碳酸铵的缓慢分解,二氧化碳和氨气逐渐溶入氯化钙溶液中,溶液中也是逐渐增加的,碳酸钙可以在适宜的过饱和度下沉积在自组装单层上。3-巯基丙酸自组装单层也是首次用来诱导碳酸钙晶体的生长。图4为自组装单层上诱导生长得到的CaCO3晶体的扫描电镜图,整个实验过程温度控制在25℃,反应陈化48 h。从图中可以看出,晶体为典型的菱面体方解石,表面光滑。自组装单层上得到的碳酸钙晶体只有方解石,XRD结果也证实了没有球霰石和文石成分。与纯溶液中得到的碳酸钙沉淀比较,自组装单层上得到的晶体具有晶型单一,形貌均一等优点,这表明3-巯基丙酸自组装单层对碳酸钙的成核和生长具有重要调节作用。

在温度为60℃时,自组装单层上得到的碳酸钙也为方解石,但晶体的形貌发生了很大变化,见图5。60℃时,自组装单层上得到的是多孔方解石,而25℃时得到的是表面光滑的方解石。这是首次在自组装单层上得到形貌规整的多孔方解石。与凝胶介质控制制备多孔方解石晶体比较,自组装单层方法具有实验简单易控制的特点。高温条件下,碳酸铵分解速度加快,CO2和NH3向溶液溶解的相对速率也会发生改变,溶液的pH随时间的变化也会出现差别,高温条件下晶体在自组装单层界面的结晶-溶解-重结晶过程也会有些变化,这些原因都可能影响形成多孔方解石,但详细机理还有待于更深入系统的研究。

另外,两种实验条件下得到的方解石晶体除了形貌不同之外,晶体尺寸也有差别。60℃时,晶体尺寸集中在5~9μm,而25℃时,晶体尺寸较大,集中在16~24μm。晶体生长过程中,成核速率快的情况下最后得到的晶体个数较多但尺寸较小,反之则晶体尺寸较大[21]。60℃时,单位面积内生成了更多的晶体是导致其晶体尺寸较小的可能原因。

图6a、6b分别给出了60和25℃条件下自组装膜上得到的碳酸钙晶体的XRD图。从2个XRD图中可以看出:2个温度条件下,都只出现了方解石的(104)和(006)2个衍射峰,但2个峰的相对强度不同。这表明3-巯基丙酸自组装膜都只诱导了方解石晶体的生长。方解石(006)面上排列的全是Ca2+,在溶液pH=9.0碱性条件下,自组装膜的末端基团主要以-COO-形式存在,形成了带负电的极性区域。由于静电吸引作用,溶液中Ca2+会有规则的排布在自组装单层上的-COO-附近,形成成核位点,从而诱导(006)面的生长。60℃时,(104)峰的相对强度远远大于(006)峰,这是因为方解石(104)面由 Ca2+和交错排列组成,是热力学最稳定的晶面,在较高的温度下,晶体会更倾向于以热力学稳定的形式存在。25℃条件下,纯溶液中得到的碳酸钙晶体的XRD图并未出现(006)峰,这再次说明了SAMs缺席情形下,全由Ca2+排列形成的(006)面不易形成而热力学最稳定的晶面为(104)面的事实。
3 结 论
我们首次采用3-巯基丙酸自组装单层模板诱导了CaCO3晶体的生长。在自组装单分子膜的诱导下,60℃时得到了形貌规则的多孔方解石,而25℃时得到了典型的表面光滑的菱面体方解石,多孔和表面光滑的方解石都沿着(104)和(006)面取向生长,但高温条件下,热力学稳定的(104)面更占据支配地位。没有自组装单层存在时,溶液中得到的是球霰石、方解石和文石三晶型的共存物。SAMs上的羧酸根与溶液中的Ca2+的静电作用是方解石成核和结晶的前提。本研究为温和条件下制备特殊形貌的多孔方解石材料及模拟生物矿化提供一条可行的途径。
[1]Hu Z S,Zen X Y,Gong J,et al.Colloids Surf.,A,2009,351(1-3):65-70
[2]Mishra S,Shimpi N G,Patil U D.J.Polym.Res.,2007,14(6):449-459
[3]De Leeuw N H,Parker S C.J.Phys.Chem.B,1998,102(16):2914-2922
[4]Rodriguez-Blanco J D,Shaw S,Benning L G.Nanoscale,2011,3(1):265-271
[5]Taylor D R,Crowther R S,Cozart J C,et al.Hepatology,1995,22(2):488-496
[6]Xiao J W,Zhu Y C,Liu Y Y,et al.Cryst.Growth Des.,2008,8(8):2887-2891
[7]Zhu W J,Lin J P,Cai C H.J.Mater.Chem.,2012,22(9):3939-3947
[8]Tong H,Ma W T,Wang L L,et al.Biomaterials,2004,25(17):3923-3929
[9]Chen Z Y,Nan Z D.J.Colloid Interf.Sci.,2011,358(2):416-422
[10]Xue Z H,Hu B B,Dai S X,et al.Mater.Chem.Phys.,2011,129(1-2):315-321
[11]WU Xin-Zhi(吴新志),DAI Shu-Xi(戴树玺),XUE Zhong-Hui(薛中会),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2009,25(9):1657-1662
[12]Aizenberg J,Black A J,Whitesides G W.J.Am.Chem.Soc.,1999,121(18):4500-4509
[13]Travaille A M,Kaptijn L,Verwer P,et al.J.Am.Chem.Soc.,2003,125(38):11571-11571
[14]Li H Y,Estroff L A.CrystEngComm,2007,9(12):1153-1155[15]Hetherington N B J,Kulak A N,Kim Y Y,et al.Adv.Funct.Mater.,2011,21(5):948-954
[16]Park R J,Meldrum F C.J.Mater.Chem.,2004,14(14):2291-2296
[17]Park R J,Meldrum F C.Adv.Mater.,2002,14(16):1167-1169
[18]Küther J,Seshadri R,Knoll W G,et al.J.Mater.Chem.,1998,8(3):641-650
[19]Travaille A M,Steijven E G A,Meekes H,et al.J.Phys.Chem.B,2005,109(12):5618-5626
[20]Carteret C,DandeuA,Moussaoui S,et al.Cryst.Growth Des.,2009,9(2):807-812
[21]Guo X H,Xu A W,Yu SH.Cryst.Growth Des.,2008,8(4):1233-1242