酞菁在光动力治疗中的应用
2013-09-15丁兰兰栾立强施佳伟
丁兰兰 栾立强 施佳伟 刘 伟
(山东大学晶体材料国家重点实验室,济南 250100)
光动力治疗(Photodynamic Therapy,PDT)是近几十年来发展起来的一种新兴癌症治疗技术。该技术利用光激发癌细胞内部的光敏剂分子(Photosensitizer,PS)产生高细胞毒性的单线态氧,从细胞内部杀死癌细胞,而使正常组织免受伤害[1-2]。它是手术、化疗和放疗等三大传统的肿瘤治疗手段之外的新型癌症治疗技术,具有传统治疗技术不可比拟的优点,如:毒副作用小,抗癌广谱性、微创或无创、无耐药性以及可反复应用治疗等[1],这使得成千上万的癌症患者得益于PDT技术而减轻病痛并延长寿命。自20世纪70年代进入临床研究以来,PDT已经成为发达国家癌症治疗的主要手段之一,广泛应用于头颈癌、食道癌、胰腺癌、皮肤癌、肺癌、前列腺癌、脑部肿瘤、宫颈癌等癌症的治疗与预防中,在恶性肿瘤的治疗中取得了令人瞩目的成就,已成为肿瘤防治研究中的一个不可替代的领域。
1 光动力治疗基本要素和原理
光动力治疗需要包含三要素:光敏剂、光和分子氧[1.3-4]。三要素相互作用,缺一不可。三要素中的任一要素单独使用均不具有毒性,但其结合在一起共同作用,就可以产生具有高细胞毒性的活性氧(Reactive Oxygen Species,ROS),从而达到治疗的目的。根据产生的活性氧的类型不同,PDT的作用机理可以分为两类型,Ⅰ型为以产生氧自由基为主,Ⅱ型为以产生单线态氧为主。目前,人们普遍认为Ⅱ型机理为PDT的主要作用机制。如图1所示,Ⅱ型机理中,光敏剂首先吸收光子的能量由基态(S0)跃迁到第一激发态(S1),该激发态除了可以以辐射/非辐射跃迁回基态外,还可以通过系间穿越(Intersystem Crossing,ISC)转换为三重激发态(T1),从而通过能量传递将基态三重态氧分子(3O2)活化为单线态氧(1O2)[5]。单线态氧 (1O2)的半衰期极短[6],只能够氧化其生成位置附近的生物大分子或细胞器,所以具有较明显的定位作用。单线态氧能够引起细胞凋亡而不会引起周围组织的变态反应。

光的波长也是影响光动力治疗的重要因素。随着波长的增加,光线对组织的穿透能力逐渐增强。其中,600~1 200 nm波长范围通常被称为人体组织光学窗口,这一波段的光线可以穿透组织[7]。在已有的报道中,激光和白炽灯光均被用于光动力治疗且表现出了类似的疗效[8]。而LED因其光谱宽度窄、光效高、寿命长等特点,已成为光动力治疗中理想的替代光源[9]。
2 光敏剂
光敏剂的发展到至今,大致可以分为三代:
第一代光敏剂以血卟啉类衍生物(如Photofrin®)为代表[10-11]。Photofrin®是美国食品和医药管理局(FDA)最早批准临床应用于多种肿瘤治疗的PDT光敏剂[10],已广泛应用于治疗各种恶性肿瘤并取得了很大成功;国内学者也对其进行了大量深入的研究[12-13]。但是其缺点也很明显:成分复杂,组织透过率低,代谢较慢,皮肤光敏反应时间长。
第二代光敏剂克服了第一代光敏剂的缺点,吸收比第一代相对红移,结构主要以叶绿素衍生物,酞菁配合物、苯并卟啉[14]及氢化卟吩、竹红菌素[15]等等;
第三代光敏剂是将第二代光敏剂与靶向化学物质通过共价键连接,进一步提高光敏剂对肿瘤组织的选择性。
理想的光敏剂应具有以下特点:
今年的鸡蛋价格可以用扬眉吐气来形容。上半年,鸡蛋价格经历了多轮上涨,蛋鸡养殖十分见效益。这股热度一直持续到年终,蛋价仍在高位震荡,并没有出现淡季下滑的情况。再加上近期出现的非洲猪瘟疫情,间接促进了禽蛋类的走俏,鸡蛋价格更是接连看涨。不过,这行情是短暂暴发,还是有持续动力?蛋鸡养殖前景如何?
(1)成分单一,稳定性高。成分单一有助于对光敏剂进行质量控制,减少杂质可能引发的副作用。
(2)暗毒性小,光毒性强。避光下,理想的光敏剂本身及其代谢产物不具有毒性。光照下,光敏剂分子应具有高的活性氧产率,氧化细胞内大分子或细胞器,从而达到分子内部杀死细胞的目的。
(3)选择性好。理想的光敏剂对癌细胞应具有选择性,能够在癌细胞中特异性聚集而不影响正常组织细胞。
(4)长波吸收。在红光和近红外区有较强吸收以匹配组织透过窗口。
(5)具有一定水溶性。水溶性有利于光敏剂在人体内的扩散和吸收。
本文结合本课题组近几年的工作和国内外学者在光动力治疗光敏剂设计合成方面的研究进展,尤其是靶向酞菁类光敏剂的的研究工作做一综述。
3 酞菁类光敏剂
酞菁(Phthalocyanine,Pc)是一类卟啉的合成衍生物,属于苯并氮杂卟啉的范畴(图2)。由于其所具有的更扩展的共轭π体系,使得其最大吸收相对于卟啉显著红移。通过在酞菁分子上引入相应的取代基和中心金属离子,酞菁的最大吸收可以红移至700~800 nm,该波段人体的透过率高,从而具有优于卟啉的光化学性质。另外,酞菁的理化性质稳定,在红光区吸收系数比卟啉高出1~2个数量级,因此在进行光动力治疗时,只需要1/5~1/10倍的卟啉剂量,却能达到优于卟啉的治疗效果。另外,酞菁在体内的动力学作用比卟啉快的多,经注射后1~3 h内在肿瘤组织中即可达到最大值,并在24 h内从体内清除干净,因此皮肤的光敏反应只是短暂的。通过极性基团的引入,可以改变酞菁的高度憎水性并使其具有不同的水溶性,从而解决了溶解性问题。比酞菁多4个苯环的萘酞菁/萘菁,对更长的波有很强的吸收(750~900 nm),利用这一优点可以使PDT治疗更深处的肿瘤[16]。当今酞菁类光敏剂已经成为癌症治疗中最具有应用前景的第二代光敏药物之一。而水溶性的酞菁衍生物更是其中的研究热点[17-24]。陈耐生课题组在这一方面做了许多卓有成效的工作,其设计合成的光敏剂“福大赛因”[25]已进入临床试验阶段。
为了增强光敏剂的肿瘤选择性,科学家们进行了大量的尝试。这些尝试主要有两个方向,一方面是利用脂质体[26]、聚合物胶束[27-28]或硅纳米颗粒[29]等载体对光敏剂进行封装,通过提高药物的滞留能力以增强其选择性和循环时间;另一方面将光敏剂与肿瘤靶向载体,如表皮生长因子、腺病毒蛋白、单克隆抗体等通过共价键连接[30-32]。研究结果显示,将光敏剂与靶向载体直接连接能够显著提高光敏剂对肿瘤的选择性,近年来成为各国研究工作者的研究重点。本文将对后者近几年的研究现状做重点的评述。
3.1 单克隆抗体靶向因子
单克隆抗体是指由淋巴细胞杂交瘤产生的、只针对复合抗原分子上某一单个抗原决定簇的特异性抗体[33]。将与肿瘤抗原相关的单克隆抗体与光敏剂相连能够提高光敏剂的选择性[30,34],但由于单克隆抗体体积较大,影响其组织渗透能力,降低了细胞摄入。同时,光敏剂的引入却一定程度上降低了单克隆抗体对抗原的特异性[35]。
3.2 短肽类靶向因子
作为蛋白质的组成部分,具有适当序列的多肽可以特异的与癌细胞或肿瘤血管表面的整合素(Integrin)结合[36]。

Ke等[37]将一种具有核定位序列(Nuclear Localization Signal,NLS) 的短肽(Gly-Gly-Pro-Lys-Lys-Lys-Arg-Lys-Val)通过三甘醇与不对称酞菁锌连接,合成结构如图3中所示的新型光敏剂。测试结果表明,这种新型光敏剂在DMF中表现出良好的溶解性,以非聚集态形式存在,最大吸收峰(λmax)位于691 nm,DMF 中单线态氧量子产率(ΦΔ)达到 0.84(以非取代酞菁锌在DMF中单线态氧量子产率为标准,ΦΔ=0.56)。通过与非多肽结合酞菁对比,多肽的引入显著提高了结肠癌细胞摄入和细胞内活性氧产率。在光照强度为48 J·cm-2,波长大于610 nm的光照条件下 IC50低至 0.21 μmol·L-1,而非多肽结合酞菁IC50=0.39 μmol·L-1。 在动物实验中,荷瘤小鼠在注射72 h后,肿瘤中的光敏剂浓度明显高于其他器官。与预期不同的是,虽然光敏剂与核定位多肽相连,但是荧光照片显示其主要在细胞膜中聚集。同时,类似现象也在其他的核定位结合卟啉类光敏剂中被发现[38-41]。这被认为是结合体中的疏水大环影响了多肽的定位作用。
Master[42-43]等在酞菁的脂质体包裹的纳米药物外围连接上GE11多肽,通过GE11对EGFR生长因子的特殊选择性实现了酞菁分子的定向给药功能。细胞试验证明,该类靶向药物可以对EGRF过度表达的A431扁平上皮细胞癌有高度的选择性。当纳米药物的荷载率 (酞菁/脂质体)为50μg·mg-1时,被包裹的酞菁Pc4表现出最高的单线态氧产率。并且当用药量以Pc4计为400 nmol·L-1,用200 mJ·cm-2强度的光照射400 s的情况下,A431的细胞的杀死率可以达到100%。
最近Guerin[44]和Vicent[45]课题组在酞菁多肽类靶向光敏剂的研究中也成功地将酞菁与多肽靶向分子相连接,并对其进行了细胞生物测试验证了其对不同癌症细胞的选择作用和PDT光毒性。
3.3 多胺类靶向因子
多胺是一类含有多个氨基的链状化合物,是一种非常重要的生物活性分子。它在自然界中天然存在,在细胞增殖和分化中起着重要作用[46-47]。癌细胞等快速增殖细胞需要大量多胺来维持其快速分裂。细胞自身合成的多胺远远不能满足癌细胞需要,因此大量的多胺通过活性特异多胺转运蛋白由外源引入。因此,多胺是一类重要的癌细胞靶向载体,已有大量的与多胺结合的细胞毒性药物报道[48-56]。
Jiang等合成了一系列硅酞菁的轴向多胺和芳基羟胺衍生物(图4)[57-58]。由于胺基具有还原淬灭作用,而胺基质子化可以有效降低这种淬灭作用。测试结果证明这些硅酞菁的多胺衍生物的荧光强度和单线态氧产率与pH值显著相关:在DMF中,胺基不发生质子化,荧光量子产率和单线态氧量子产率在10-2数量级 (与非取代酞菁锌相比);加入0.6 mmol·L-1HCl后,胺基发生质子化,淬灭作用荧光量子产率和单线态氧量子产率均有5~10倍的增强。众所周知,正常组织细胞内pH值约为7.4,而癌细胞内pH值约为6。对比两种pH值下的活性氧产率,pH值的降低使得活性氧产率有着1.5倍至9.5倍的提高。因此这类光敏剂在癌细胞中的作用效果远远好于正常细胞。而实验证明多胺的引入显著降低了酞菁在水中的聚集。在光照能量48 J·cm-2,波长大于610 nm的光照条件下IC50低至0.03μmol·L-1。荧光显微镜结果显示,与多胺连接的光敏剂能够与细胞溶酶体特异性结合,且在pH~6时荧光强度远高于pH~7和8时的荧光强度。此外流式细胞仪监测分析结果显示,光敏剂对细胞的杀伤作用主要是诱发细胞凋亡过程。

3.4 糖类靶向因子
糖类的分解是细胞获取能量的主要来源[59]。癌细胞需要获取大量的葡萄糖以维持其快速增殖。因此,将糖类与光敏剂结合能够增加癌细胞对光敏剂的吸收。
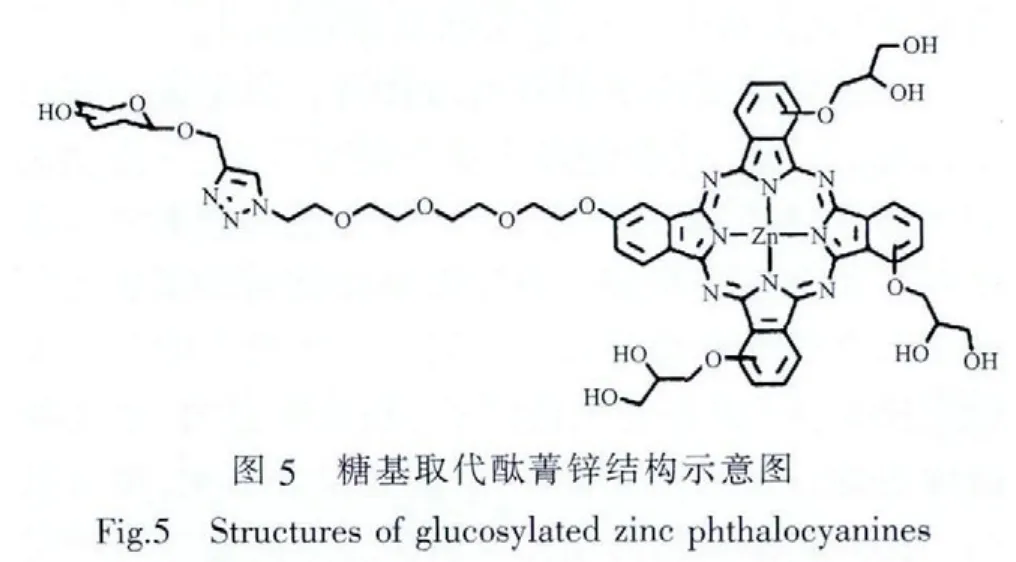
Zorlu[60]等合成出了不对称的糖基取代酞菁光敏剂,该类光敏剂在同一分子上接入两种糖基分子,从而增加了其水溶性和作为靶向光敏剂的选择性(图5)。Liu等合成了一系列通过四甘醇连接的葡萄糖取代酞菁锌,并研究了其性质[61]。测试结果显示,取代基的数量和位置均对其细胞毒性产生影响,具体活性顺序为二α取代>二β取代>单α取代>四β取代。其中,二α取代产物在光照强度为48 J·cm-2,波长大于610 nm的光照条件下对HT29细胞的 IC50低至 0.03 μmol·L-1。
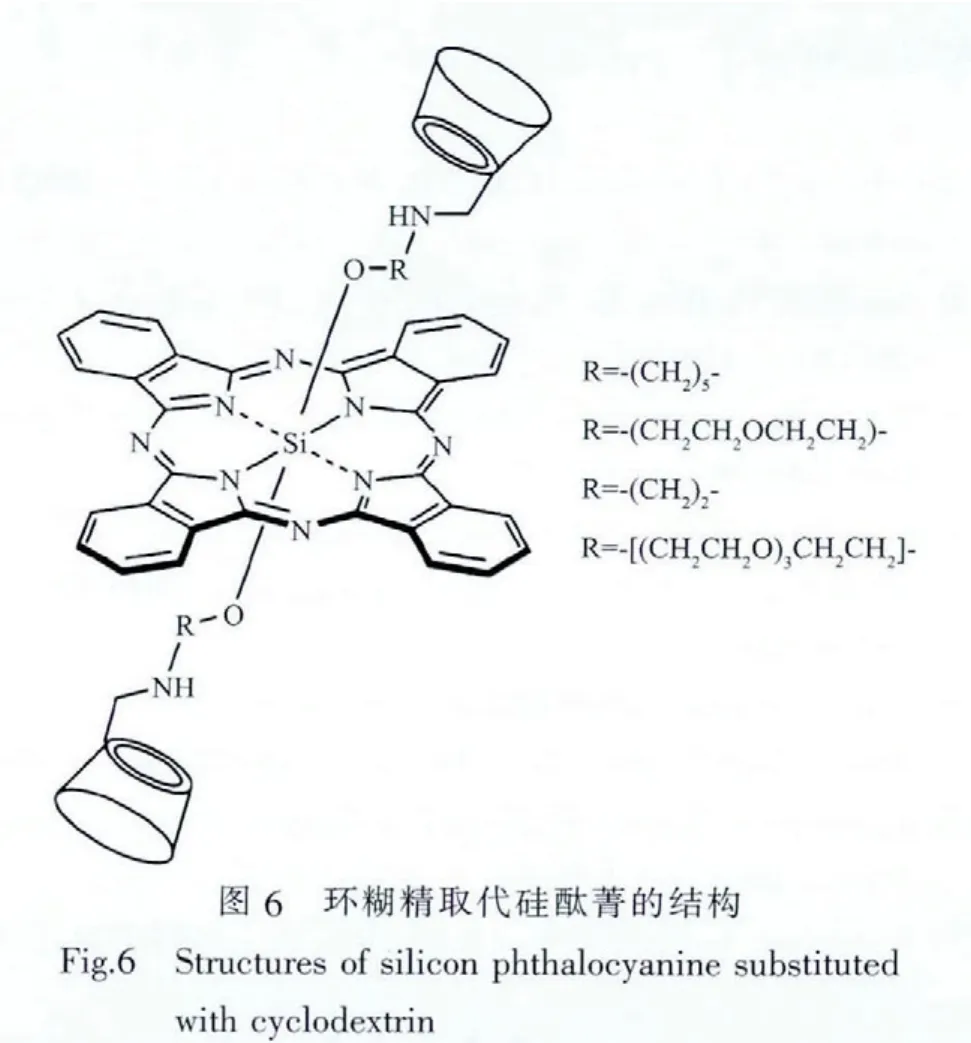
环糊精是一类在自然界中存在的环状低聚糖,它具有良好的亲水性和生物相容性,其中心的锥状空腔可以捕获疏水物质,增强其水溶性[62-64];环糊精与细胞表面分子的相互作用可以提高光敏剂与细胞和组织表面的结合,促进细胞对光敏剂的吸收。此前,研究主要集中在光敏剂与环糊精之间形成的复合物[65-67]。在大多数情况下,这种复合物能够减弱光敏剂在水溶液中聚集的趋势,增强光敏剂的活性。
Kralova等合成了卟啉的单、双环糊精衍生物并进行了细胞和动物实验。结果表明,双环糊精衍生物能够快速、特异的在癌症组织内聚集,并具有更高的抗癌活性和更快的代谢速度[68]。Lau等合成了一系列对称/不对称环糊精取代硅酞菁(图6)[69-70]。由于环糊精对称取代硅酞菁的轴向两侧均有大型水溶基团,因此其具有非常好的溶解性,以水为溶剂测试得到紫外可见光谱图呈现出酞菁单体的特征曲线,即在水中以单体形式存在。而且非对称取代硅酞菁也表现出了类似的性质。测试结果显示,延长连接的碳链有助于提高荧光量子产率和单线态氧量子产率。在光照强度为48 J·cm-2,波长大于610 nm的光照条件,环糊精对称取代硅酞菁对HT29 细胞的 IC50值最低可 达 0.04 μmol·L-1,对HepG2最低可达 0.05μmol·L-1;非对称取代硅酞菁中,当另一种配体为单糖分子时,其对HT29和HepG2细胞的 IC50分别达到 21 nmol·L-1和 26 nmol·L-1。荧光显微镜结果显示,两类硅酞菁均能够与溶酶体特异性结合;流式细胞测试结果显示,两类硅酞菁均通过引发细胞凋亡程序杀死细胞。
3.5 染料靶向因子
罗丹明B是一种众所周知的线粒体靶向介质[71]。它能够在活细胞的线粒体中聚集,并曾在生物测试中用作测量和监测线粒体膜电势的探针[72-74]。而线粒体损伤是导致细胞凋亡的重要因素。Zhao等将罗丹明B作为硅酞菁的靶向配体,合成了图7中所示的对称及非对称罗丹明B取代硅酞菁[75]。荧光显微镜结果表明这种光敏剂能够在线粒体中特异聚集。将HK-1细胞在样品浓度为0.1μmol·L-1的培养基中培养6 h,在光照强度为4 J·cm-2情况下,两种硅酞菁均能杀死90%以上的细胞,而对称取代硅酞菁的细胞毒性略优于非对称取代硅酞菁。两种连接了罗丹明B的硅酞菁表现出了双光子吸收的特性。当使用波长为850 nm连续激光照射含有对称硅酞菁的细胞30 min后,细胞均呈现出细胞死亡的早期标志:聚集。这表明轴向连接罗丹明B的硅酞菁是一种非常有潜力的光敏剂。
3.6 与化疗药物连接

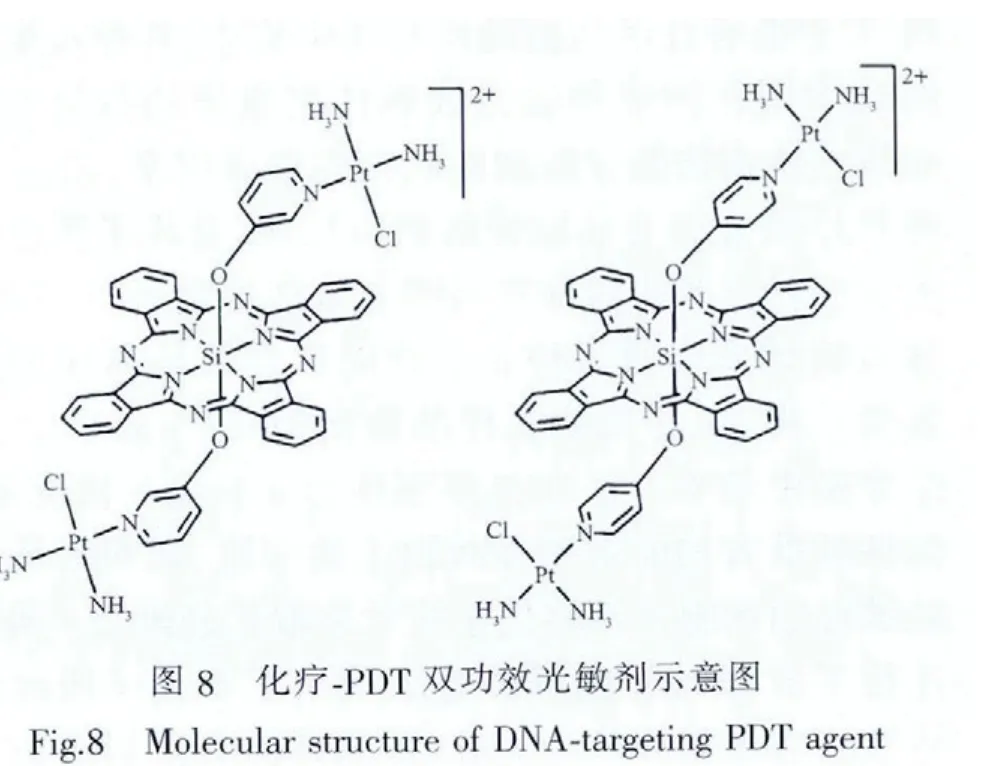
除了靶向介质,人们还研究了光敏剂与化疗药物结合之后的性质。郭子健教授课题组[76]将硅酞菁与铂类化疗药物通过轴向联接,合成出集化疗和光动力治疗于一体的双功能光敏剂。该共价配体中酞菁和化疗药物各自保持了本身的特性,表现出了优异的光毒性和作为DNA靶向化疗药物的双功效性能(图8)。Lau等将酞菁锌与奥沙利铂通过三甘醇连接在一起,合成出了可用于光动力治疗和化疗的新型光敏剂[77]。与酞菁锌衍生物和奥沙利铂共同使用相比,该光敏剂的光毒性有了显著提高,IC50从0.42 μmol·L-1降低至 0.11 μmol·L-1,但其避光毒性也有了一定程度的增加。而与不含奥沙利铂的酞菁锌衍生物相比,其细胞摄取量明显增大。荧光显微镜结果表明,这种复合光敏剂能够与溶酶体特异性结合。除此之外,人们还进行了许多其他尝试。研究发现,将光敏剂与白蛋白或低密度脂蛋白结合仅能有限地提高光敏剂的选择性。
4 研究展望
光动力治疗历经20多年的发展,已经取得了长足的进步。Photofrin®等药物的临床应用,也证明了这是一种非常有潜力的治疗癌症的手段。近年来,国内外学者致力于靶向光动力治疗光敏剂,特别是靶向酞菁类光敏剂的合成、结构表征及其光动力性质的测试,并取得了许多进展,这为之后的临床试验提供了更多的选择,也为光动力治疗的发展注入了新的活力。
同时,我们也应该注意到,还有许多方面有待进一步研究:如靶向基团的种类和大小是通过何种方式影响细胞对光敏剂的吸收;靶向基团对于光敏剂在细胞内定位的影响,这是决定光敏剂能否起到更好的杀死癌细胞的作用;靶向基团是否会对光敏剂的活性产生负面影响;如何进一步提高光敏剂对癌细胞的选择性;如何提高光敏剂的产率等等。而这些新型光敏剂也有待进一步的动物以及临床试验来验证它们的可行性。更多的具有靶向作用的光敏剂也有待被合成和改进。相信随着研究的更加深入,光动力治疗必将具有更优异的疗效和更广泛的应用前景。
[1]Dolmans D,Fukumura D,Jain R.Nat.Rev.Cancer,2003,3(5):380-387
[2]Agostinis P,Berg K,Cengel K,et al.CA Cancer J Clin,2011,61(4):250-281
[3]Dougherty T,Gomer C,Henderson B,et al.J.Natl.Cancer Inst.,1998,90(12):889-905
[4]GAO Yuan(高源),QIAO Guang-Ming(乔光明),LI Na(李娜),et al.Chinese J.Anal.Chem.(Fenxi Huaxue),2011,39(12):1926-1931
[5]Foote C.Science,1968,162(3857):963-970
[6]Moan J,Berg K.Photochem.Photobiol.,1991,53(4):549-553
[7]Juzeniene A,Nielsen K,Moan J.J.Environ.Pathol.Toxicol.Oncol.,2006,25(1-2):7-28
[8]Brancaleon L,Moseley H.Lasers Med.Sci.,2002,17(3):173-186
[9]Juzeniene A,Juzenas P,Ma L,et al.Lasers Med.Sci.,2004,19(3):139-149
[10]Sharman W,Allen C,van Lier J.Drug Discov.Today,1999,4(11):507-517
[11]WANG Ling-Yun(汪凌云),CAO De-Rong(曹德榕).Chin.J.Org.Chem.(Youji Huaxue),2012,32:2248-2264
[12]ZHU Jing(朱菁),SHI Hong-Min(施虹敏),ZHANG Hui-Guo(张慧国).Chinese J.Lasers(Zhongguo Jiguang),2000,27(1):95-96
[13]JIN Xiao-Min(金晓敏),WU Jian(吴健).Chin J.Med.Chem.(Zhongguo Yaowu Huaxue Zazhi),2002,12(1):52-56
[14]Pandeyi R K,Potter W R,Meunier I,et al.Photochem.Photobiol.,1995,62(4):764-768
[15]LIU Yan-Yan(刘岩岩),WANG Xue-Song(王雪松),ZHANG Bao-Wen(张宝文).Prog.Chem.(Huaxue Jinzhan),2008,20(9):1345-1352
[16]Luan L,Ding L,Zhang W,et al.Bioorg.Med.Chem.Lett.,2013,23(13):3775-3779
[17]Uslan C,Sesalan B,Durmus M.J.Photochem.Photobiol.A.Chem.,2012,235:56-64
[18]Liu W,Jensen T,Fronczek F,et al.J.Med.Chem.,2005,48(4):1033-1041
[19]Luan L,Chen J,Ding L,et al.Chem.Lett.,2012,41:1012-1014
[20]WU Li-Rong(吴丽荣),HUANG Li-Ying(黄丽英),XU Hui(许慧).U.Chem.(Daxue Huaxue),2010,25(4):1-10
[21]LIU Li-Zhen(刘丽珍),ZHENG Si-Ning(郑思宁),PENG Yi-Ru(彭亦如),et al.J.Mol.Sci.(Fenzi Kexue Xuebao),2005,21(5):56-62
[22]HUANG Yan(黄 焱),XU Guo-Xing(徐 国 兴),PENG Yi-Ru(彭亦如).Applied Laser(Yingyong Jiguang),2010,30(6):518-524
[23]HUANGJian-Dong(黄剑东),LIU Feng-Ran(刘丰冉),CHEN Yan-Mei(陈燕梅),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2006,22(3):435-442
[24]NIU Li-Hong(牛丽红),LI Zhong-Yu(李忠玉),CHEN Zi-Hui(陈子辉),et al.Chemistry(Huaxue Tongbao),2009,72(3):251-257
[25]HUANG Jin-Ling(黄金陵),CHEN Nai-Sheng(陈耐生),WANG Jun-Dong(王俊东),et al.CN Patent,CN1593424.2005-03-16.
[26]Derycke A,de Witte P.Adv.Drug Deliv.Rev.,2004,56(1):17-30
[27]Bechet D,Couleaud P,Frochot C,et al.Trends Biotechnol.,2008,26(11):612-621
[28]Nishiyama N,Morimoto Y,Jang W,et al.Adv.Drug Deliv.Rev.,2009,61(4):327-338
[29]Couleaud P,Morosini V,Frochot C,et al.Nanoscale,2010,2(7):1083-1095
[30]Sharman W,van Lier J,Allen C.Adv.Drug Deliv.Rev.,2004,56(1):53-76
[31]Solban N,Rizvi I,Hasan T.Lasers Surg.Med.,2006,38(5):522-531
[32]Verma S,Watt G,Mai Z,et al.Photochem.Photobiol.,2007,83(5):996-1005
[33]Schwaber J,Cohen E.Nature,1973,244(5416):444-447
[34]Miller G,Lown J.Drug Dev.Res.,1997,42(3/4):182-197
[35]Mitsunaga M,Ogawa M,Kosaka N,et al.Nat.Med.,2011,17(12):1685-U1210
[36]Peoples G,Goedegebuure P,Smith R,et al.Proc.Natl.Acad.Sci.U.S.A.,1995,92(2):432-436
[37]Ke M,Yeung S,Fong W,et al.Chem.Eur.J.,2012,18(14):4225-4233
[38]Sibrian-Vazquez M,Jensen T,Vicente M.Org.Biomol.Chem.,2010,8(5):1160-1172
[39]Sibrian-Vazquez M,Jensen T,Hammer R,et al.J.Med.Chem.,2006,49(4):1364-1372
[40]Sibrian-Vazquez M,Jensen T,Vicente M.J.Med.Chem.,2008,51(10):2915-2923
[41]Sehgal I,Sibrian-Vazquez M,Vicente M.J.Med.Chem.,2008,51(19):6014-6020
[42]Master A,Livingston M,Oleinick N,et al.Mol.Pharm.,2012,9(8):2331-2338
[43]Master A,Qi Y,Oleinick N,et al.Nanomedicine,2012,8(5):655-664
[44]Ali H,Ait-Mohand S,Gosselin S,et al.J.Org.Chem.,2011,76(6):1887-1890
[45]Ongarora B,Fontenot K,Hu X,et al.J.Med.Chem.,2012,55(8):3725-3738
[46]Wang C,Delcros J,Cannon L,et al.J.Med.Chem.,2003,46(24):5129-5138
[47]Cosentino C,Bates D.Feedback Control in Systems Biology.Cleveland:CRCPress,2011.
[48]Samor C,Guerrini A,Varchi G,et al.Bioconjugate Chem.,2008,19(11):2270-2279
[49]Papadopoulou M,Rosenzweig H,Bloomer W.Bioorg.Med.Chem.Lett.,2004,14(6):1519-1522
[50]Eiseman J,Rogers F,Guo Y,et al.Cancer Res.,1998,58(21):4864-4870
[51]Holley J,Mather A,Wheelhouse R,et al.Cancer Res.,1992,52(15):4190-4195
[52]Yuan Z,Egorin M,Rosen D,et al.Cancer Res.,1994,54(3):742-748
[53]Cullis P,Green R,Malone M.J.Chem.Soc.,Perkin Trans.2,1995,0(7):1503-1511
[54]Dallavalle S,Giannini G,Alloatti D,et al.J.Med.Chem.,2006,49(17):5177-5186
[55]Delcros J,Tomasi S,Carrington S,et al.J.Med.Chem.,2002,45(23):5098-5111
[56]Battaglia A,Guerrini A,Baldelli E,et al.Tetrahedron Lett.,2006,47(16):2667-2670
[57]Jiang X,Yeung S,Lo P,et al.J.Med.Chem.,2011,54(1):320-330
[58]Jiang X,Lo P,Tsang Y,et al.Chem.Eur.J.,2010,16(16):4777-4783
[59]Siegel G,Albers R,Brady S.Basic Neurochemistry:Molecular,Cellular,and Medical Aspects:Vol.1.Salt Lake City:Academic Press,2006.
[60]Zorlu Y,Dumoulin F,Bouchu D,et al.Tetrahedron Lett.,2010,51(50):6615-6618
[61]Liu J,Lo P,Fong W,et al.Org.Biomol.Chem.,2009,7(8):1583-1591
[62]Araki J,Ito K.Soft Matter,2007,3(12):1456-1473
[63]Chen Y,Liu Y.Chem.Soc.Rev.,2010,39(2):495-505
[64]Hapiot F,Tilloy S,Monflier E.Chem.Rev.,2006,106(3):767-781
[65]Leng X,Choi C,Luo H,et al.Org.Lett.,2007,9(13):2497-2500
[66]Baugh S,Yang Z,Leung D,et al.J.Am.Chem.Soc.,2001,123(50):12488-12494
[67]Ruebner A,Yang Z,Leung D,et al.Proc.Natl.Acad.Sci.U.S.A.,1999,96(26):14692-14693
[68]Kralova J,Synytsya A,Pouckova P,et al.Photochem.Photobiol.,2006,82(2):432-438
[69]Lau J,Lo P,Fong W,et al.Chem.Eur.J.,2011,17(27):7569-7577
[70]Lau J,Lo P,Tsang Y,et al.Chem.Commun.,2011,47(34):9657-9659
[71]Johnson L,Walsh M,Chen L.Proc.Natl.Acad.Sci.U.S.A.,1980,77(2):990-994
[72]Lee D,Helps S,Macardle P,et al.Neurochem.Res.,2009,34(10):1857-1866
[73]Baracca A,Sgarbi G,Solaini G,et al.BBA-Bioenergetics,2003,1606(1-3):137-146
[74]Ferlini C,Scambia G.Nat.Protocols,2007,2(12):3111-3114
[75]Zhao Z,Chan P,Li H,et al.Inorg.Chem.,2012,51(2):812-821
[76]Mao J,Zhang Y,Zhu J,et al.Chem.Commun.,2009,0(8):908-910
[77]Lau J,Lo P,Fong W,et al.J.Med.Chem.,2012,55(11):5446-5454
