国内不同厂家替米沙坦片与原研制剂的溶出曲线对比分析*
2013-09-15贾孟良谢守霞杨红英练宏新
贾孟良,谢守霞,杨红英,练宏新,王 玉
(广东省深圳市人民医院·暨南大学第二临床医学院,广东 深圳 518020)
替米沙坦为高选择性血管紧张素Ⅱ(AngⅡ)受体拮抗剂,由德国勃林格殷格翰公司开发,1999年在美国首次上市,用于高血压治疗[1]。替米沙坦在水和pH=3~9范围内几乎不溶,口服生物利用度为50%[1]。为考察替米沙坦片的质量,按照2010年版《中国药典(二部)》附录ⅩC第二法,参照文献[2]用高效液相色谱法定量,比较了市售4个厂家间的替米沙坦片及与原研制剂的体外溶出曲线的相似性。现报道如下。
1 仪器与试药
RCZ-8B型溶出仪(天津天大天发科技有限公司);BP211D型十万分之一电子天平(德国赛多利斯);ZKT-7F型真空脱气机(天津天大天发科技有限公司);Waters2695型高效液相色谱仪-2487UV检测器(沃特世科技有限公司)。替米沙坦对照品(中国药品生物制品检定所,批号为 144701-48-4,含量98.9%);国外A企业替米沙坦原研制剂(勃林格殷格翰,商品名 Micardis,每片 80 mg),国内B企业替米沙坦片(每片40mg),国内C企业替米沙坦片(每片40 mg),国内D企业替米沙坦片(每片40mg),国内E企业替米沙坦片(每片40 mg);盐酸;试验所用试剂均为分析纯,水为超纯水。

图1 替米沙坦的高效液相色谱图
2 方法与结果
2.1 色谱条件
色谱柱:WatersSymmetry C18柱(250mm ×4.6mm,5μm);流动相:乙腈-水 -冰乙酸(500∶500 ∶1;)流速:1.0 mL/min;检测波长:210 nm;进样量:10μL;柱温:30℃[3]。色谱图见图1。
2.2 溶出度试验条件
按照2010年版《中国药典(二部)》附录ⅩC第二法(桨法),以pH=7.4磷酸盐缓冲溶液1 000 mL为溶出介质,溶出温度(37±0.5)℃,转速50 r/min,依法操作,按拟订色谱条件测定。
2.3 溶液制备
精密称取替米沙坦对照品 0.025 68 g,以流动相稀释至50mL,混均得 513.6μg/mL对照品贮备液。溶出介质为 pH=7.4磷酸盐缓冲溶液,取磷酸二氢钾6.8 g和0.9 g氢氧化钠,加水1 000mL,摇均,调 pH 至 7.4。
2.4 方法学考察
波长选择与线性关系考察:精密称取替米沙坦对照品贮备液1mL,用流动相稀释至200mL,于200~400 nm波长范围内进行扫描,测定其最大吸收波长为210 nm。分别精密称取替米沙坦贮备液 1mL 置 10,25,50,100,200,500mL 容量瓶中,用溶出介质稀释至刻度,摇匀,以溶出介质为空白,用高效液相色谱法在210nm波长处测得峰面积,以峰面积(Y)对质量浓度(X)进行线性回归,得回归方程 Y=29.171 4X+0.003 9,R2=1.000 0(n=6)。结果表明,替米沙坦质量浓度在1~50mg/L范围内与峰面积线性关系良好。
精密度试验:精密称取替米沙坦对照品贮备液0.5,2,3.5mL,定容于 50 mL 容量瓶中,分别得 5.136,20.544,35.952 μg/mL的测定液,进行日内精密度测试,分别于 0,1,4,9,16,24 h 时进样测定。结果的 RSD=0.023%(n=3),表明仪器精密度良好。
加样回收试验:精密称取替米沙坦细粉适量(相当于5mg替米沙坦),置100mL容量瓶中,将对照品3,5,8mg分别加入,用溶出介质定容至刻度,摇匀,滤过,进样10μL,测定峰面积,计算回收率。结果见表1。

表1 不同企业产品的替米沙坦含量测定与加样回收试验结果
2.5 溶出曲线测定[3]
量取经脱气的溶出介质1 000mL于溶出杯中,加热使溶出介质保持在(37±0.5)℃范围内,调整转速使其稳定在75 r/min。取供试品6粒,分别置6个转篮中,将转篮降到烧杯内,立即计时,并定时在 5,10,15,20,30,45,60min 取样 10 mL(及时补液),立即用0.8μm滤膜过滤后,用高效液相色谱法进行定量计算,得不同时间点的累积溶出率。
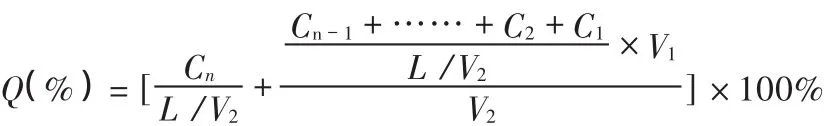
Q为各时间点校正后累积溶出量,Cn为各时间点取出后的样品质量浓度(稀释前);L为制剂标示量(L/V2单位需与 Cn一致);V1为各时间点固定取样体积;V2为溶出介质体积。
溶出曲线见图 2。根据 Weibull方程 InIn[1/(1-Ft)]=m in t+in A,求出不同厂家替米沙坦片的溶出参数 T50(药物溶出50%的时间)、TD(药物溶出 63.2%的时间)及 m(参数 m),见表2。并对其进行国内厂家与进口制剂的两两 t检验,由表3可知,A 厂家与 B,C,D,E 4 个厂家的溶出参数 T50,TD,T80,m 值均无显著性差异(P >0.05,t=1.812,df=10)。

图2 5个厂家的替米沙坦片累积溶出曲线
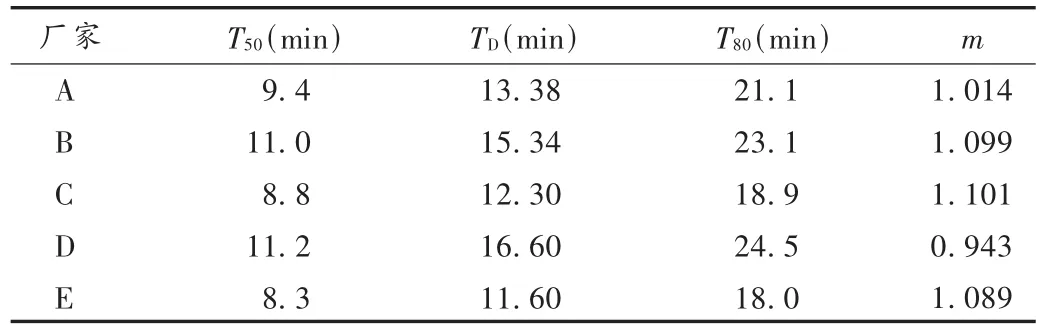
表2 不同厂家替米沙坦片的释放参数

表3 对照片与国产替米沙坦片的 t值检验表
3 讨论
高效液相色谱法是常用的检验分离方法,具有定量准确、专属性强等优点,操作简单,适用于快速分析试验采用。在以溶出介质pH=7.4的磷酸盐缓冲溶液中,比较A厂家与B,C,D,E厂家的溶出参数,经双单侧 t检验进行分析,B,C,D,E 4个厂家生产的替米沙坦片与A厂家生产的原研制剂均可在35min内溶出标示量的85%以上,溶出曲线基本一致。由表3可见,B,C,D,E 4个厂家的溶出参数与进口对照片均无显著性差异,质量可靠。溶出度是药品质量控制的指标之一,固体制剂的溶出度直接影响药品的体内生物利用度和临床疗效。因此,应严格按照药典的质量标准控制产品内在质量,保证用药的合理性和安全性。
[1]杨惠娣,徐 彬.降压型药替米沙坦[J].世界临床药物,2003,24(11):695-697.
[2]Kurade VP,Pai MG,Gude R.RP-HPLC Estimation of Ramipril and Telmisartan in Tablets[J].Indian JPharm Sci,2009 ,71(2):148 - 151.
[3]国家药典委员会.中华人民共和国药典(二部)[M].北京:中国医药科技出版社,2010:附录ⅤD.
