正交试验优化杜仲叶中绿原酸的超声提取工艺
2013-09-15王柏强江承平何效平
王柏强 ,刘 福 ,江承平 ,何效平
(1.川北医学院附属医院药剂科,四川 南充 637000;2.川北医学院药学院,四川 南充 637000)
绿原酸具有利胆、抗菌、降压、增加白细胞及兴奋中枢神经系统、抗肿瘤、调血脂、清除自由基等多种药理作用,对消化系统、血液系统和生殖系统疾病均有显著疗效[1]。杜仲叶与皮所含化学成分基本相同,且杜仲叶中绿原酸含量更高,达到干叶重的1%~5%。因此,从杜仲叶中提取绿原酸成为当前研究热点[2]。笔者通过预试验对提取方法及提取溶剂进行了初步考察,结果发现,以60%乙醇液回流提取和60%乙醇液超声提取绿原酸提取率最高,但60%乙醇液回流法提取杂质多,不易过滤,且温度高,加热时间长,易使绿原酸氧化分解。水回流提取法的不足之处在于提取温度比醇提法更高,过滤分离困难,绿原酸含量也比醇提法偏低。采用超声法提取,与热回流法相比,所需温度低、时间短,节省能源,并可提高绿原酸的稳定性。
1 仪器与试药
752型紫外分光光度计(上海精密科学仪器有限公司);760CRT型双光束紫外可见分光光度计(北京普析通用仪器有限公司);TG328A型光学读数分析天平(湘仪天平仪器厂);KQ3200DE型超声波提取器(昆山超声仪器有限公司);SHZ-D型循环水式真空泵(巩义英峪予华仪器厂);RE-52AA型旋转蒸发器(上海亚荣生化仪器厂)。杜仲叶(购自重庆医药公司,产地贵州,经川北医学院药学院中药教研室李生茂博士鉴定为杜仲科植物杜仲的树叶);绿原酸对照品(中国药品生物制品检定所,批号为0753-200111);硝酸钠(AR,天津基准化学试剂有限公司);钨酸钠、磷酸氢二钠、磷酸二氢钠(分析纯,天津基准化学试剂有限公司);95%乙醇(医用级,四川金山制药有限公司)。
2 方法与结果
2.1 杜仲叶绿原酸含量测定[3]
2.1.1 溶液制备
称取干燥至恒重的绿原酸对照品25mg,精密称定,用pH=6的磷酸盐缓冲液溶解,定容于50mL棕色容量瓶中,精密量取上述溶液12.5mL,置50mL棕色容量瓶中,以pH=6的磷酸盐缓冲液稀释至刻度,摇匀,即得质量浓度为0.134mg/mL的对照品溶液,避光低温保存。杜仲叶经粉碎机粉碎后过20目筛备用;称取20 g药材粉末,加60%乙醇(固液比1∶12)超声提取3次,每次40min。合并提取液,真空抽滤,即得供试品溶液。
2.1.2 测定波长选择
精密量取对照品溶液0.6mL,置10mL容量瓶中,加入配制好的硝酸钠(1mol/L)溶液、钨酸钠(0.1mol/L)溶液各1mL,摇匀,用pH=6的磷酸盐缓冲液定容,显色30min。以相应质量浓度对照品溶液的磷酸盐缓冲液稀释液作为参比,在200~500 nm波长范围内扫描,结果见图1。对硝酸钠与钨酸钠混合液进行扫描,光谱图见图2。结果显示,绿原酸在硝酸钠存在的条件下与钨酸钠反应后在367 nm波长处出现最大吸收,硝酸钠与钨酸钠混合液在此处无吸收,不干扰测定。故选择367 nm为测定波长。

图1 绿原酸与钨酸钠反应后差示光谱图
2.1.3 标准曲线制备
精密量取对照品溶液 0.1,0.2,0.4,0.6,0.8 mL 各 2 份,其中1份置10mL容量瓶中,直接用pH=6的磷酸盐缓冲液稀释至刻度,作为参比液;另1份加入1mol/L硝酸钠溶液,0.1mol/L钨酸钠溶液各1mL,再以pH=6的磷酸盐缓冲液稀释至刻度,摇匀,作为样品溶液。将以上配得的系列标准供试品溶液,显色30min后,前1份置参比池,后1份置样品池,在367 nm波长处测定吸光度差值ΔA。以吸光度差值(ΔA)对检测浓度(C)进行线性回归,得回归方程 ΔA=0.031 6C -0.004 2(r=0.999 7)。结果表明,绿原酸质量浓度在1.34~10.72μg/mL范围内与吸光度差值(ΔA)呈良好线性关系。
2.1.4 回收率试验
精密量取药材提取液0.15mL,置3个10 mL容量瓶中,分别加入 0.4,0.2,0.05mL 对照品溶液,然后加入配制好的硝酸钠溶液、钨酸钠溶液各1 mL,用pH=6的磷酸盐缓冲液稀释至刻度,摇匀,作为系列样品溶液。同法各制作3份,按2.1.3项下方法测定,计算回收率。结果见表1。
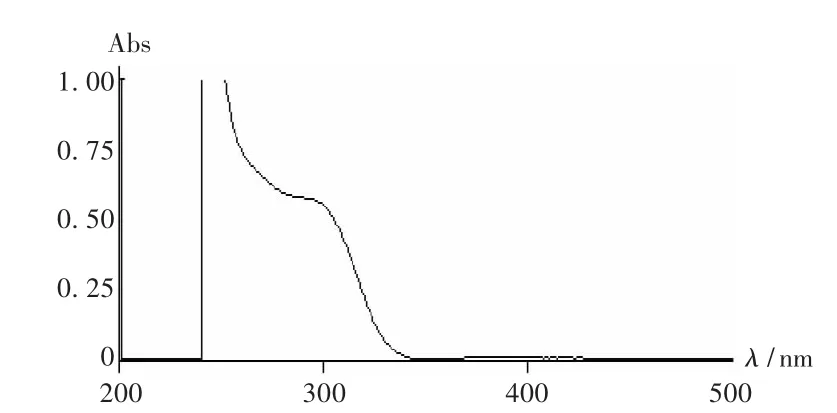
图2 硝酸钠与钨酸钠混合液光谱图

表1 绿原酸加样回收试验结果(n=9)
2.1.5 样品含量测定
精密量取供试品溶液0.5mL,共10份,分别置10mL容量瓶中,按2.1.3项下方法分别测定吸光度差值(ΔA),根据回归方程计算提取液中绿原酸的含量。
2.2 超声提取工艺考察
2.2.1 单因素试验
浸泡时间:称取20 g杜仲叶粉末6份,加60%乙醇(固液比为 1 ∶10)分别浸泡 0,2,4,6,8,10 h后,于 40 ℃ 超声提取 3 次,每次40 min。各自合并提取液,真空抽滤,依法测吸光度。计算绿原酸提取率,绿原酸提取率(%)=提取液中绿原酸总量/所用原料总量×100%。结果见图3A,随着浸泡时间延长,绿原酸提取率反而降低,故提取时药材以不浸泡为宜。
乙醇体积分数:改变乙醇体积分数,各组分别加入20%,40%,60%,80%,95%乙醇,固定其他条件不变。结果,随着乙醇体积分数的增加,绿原酸的提取率逐步升高,60%乙醇时绿原酸提取率最高;随后,绿原酸的提取率随乙醇体积分数的增加反而降低,当乙醇体积分数为95%时,绿原酸的溶出明显受到抑制(见图 3B)。
固液比:各组分别用 60% 乙醇 1 ∶6,1 ∶8,1 ∶10,1 ∶12,1 ∶14体积比提取,固定其他条件。结果见图3C,随着溶剂量的增加,绿原酸提取率逐渐增高,当固液比在1∶10以上时,固液比继续增加对绿原酸提取率影响不大。从节约溶剂用量角度考虑,选择1∶10为最佳提取固液比。
提取次数:固定其他条件,改变提取次数。结果见图3D,随着提取次数的增加,绿原酸的提取率逐渐增高,提取3次后杜仲叶中的活性物质已基本提取完全,增加提取次数,含量无显著增加。反复多次提取有利于植物体内天然产物的提取,但从工作量、生产成本等多种因素考虑,选择提取次数为3次较合理。
超声时间:固定其他条件,改变提取时间为每次20,30,40,50,60,70min,计算绿原酸提取率。结果见图3E,随着提取时间的增加,绿原酸的提取率增加,超声提取50min后绿原酸得率不再增加,反而由于长时间受热,部分绿原酸会被分解、破坏,长时间提取,含量有所下降。
提取温度:改变超声提取温度,其他条件不变。结果见图3F,随着温度的升高,绿原酸的提取率呈增加趋势,同时杂质溶出量也相应增大,活性成分易被破坏。鉴于活性物质的热稳定性及杂质的溶出问题,本试验选择温度范围为50℃左右。

图3 单因素试验结果(n=3)
2.2.2 超声提取工艺参数优化
在单因素考察基础上,选取乙醇体积分数(A)、固液比(B)、提取次数(C)、超声提取时间(D)为考察因素,以绿原酸的提取率为指标,优选杜仲叶中绿原酸的提取工艺。结果见表2至表4。由表3和表4可知,4个因素对绿原酸提取率的影响趋势与单因素考察结果基本一致,因素影响的大小为提取次数>乙醇体积分数>固液比>提取时间,就绿原酸提取率而言,乙醇体积分数与提取次数为显著性影响,根据正交试验结果、方差分析结果确定最佳工艺条件为A2B2C3D2,即60%乙醇,固液比1∶10,提取3次,每次提取50min。

表2 因素水平表

表3 正交试验结果
2.2.3 工艺验证试验
为考察最佳工艺条件的重现性,按A2B2C3D2条件重复6次试验。结果绿原酸的提取率分别为 2.43% ,2.37% ,2.41% ,2.44% ,2.35% ,2.40%,平均 2.40% ,RSD=3.7%(n=6),表明优选的工艺合理、可行。
3 讨论
超声波提取是利用超声波具有的机械效应、空化效应及热效应,通过增大介质分子的运动速度,增大介质的穿透力以提取中药有效成分的方法。超声提取所需温度低,避免了中药常规煎煮法、回流法长时间加热对有效成分的不良影响,同时也节约了能源。
通过单因素及正交试验结果分析,超声提取杜仲叶中绿原酸的最佳工艺为乙醇体积分数60%,固液比1∶10,提取次数3次,提取时间50min。工艺验证结果显示,优选的工艺合理、可行,可用于杜仲叶绿原酸的提取。
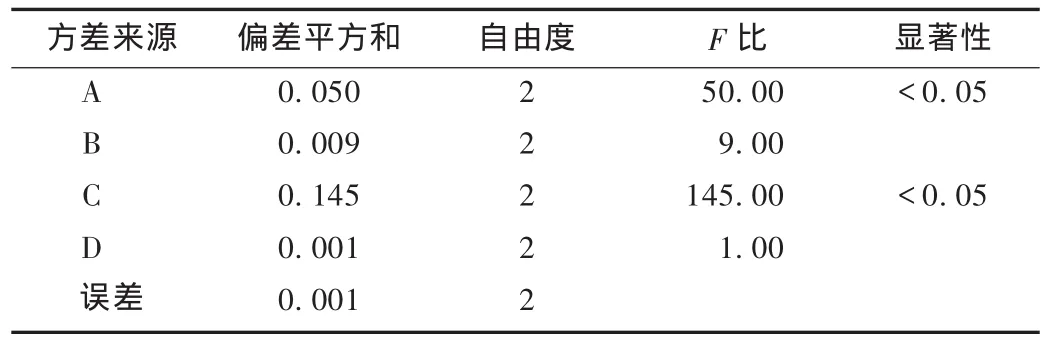
表4 方差分析结果
[1]刘军海,任惠兰,裘爱泳.杜仲叶中绿原酸的提取研究[J].时珍国医国药,2008,19(5):1 184-1 186.
[2]张凌裳,王红连,杜郭君,等.杜仲叶粉提取绿原酸工艺的优化[J].安徽农业科学,2009,37(17):8 162 -8 164.
[3]王柏强.差示分光光度法测定杜仲叶提取液中绿原酸的含量[J].川北医学院学报,2008,23(5):461-463.
