阵发性心房颤动环肺静脉电隔离术后随访及复发因素的研究
2013-09-14崔永亮刘启明
崔永亮,刘启明
心房颤动(房颤)是现今临床最常见的心律失常之一,经导管射频消融术是近来在房颤治疗领域的重大进展,且有逐步替代药物治疗的趋势。然而尽管手术方式有着长足的革新,但较高的术后复发率仍然是困扰术者的难题。本研究通过对环肺静脉电隔离术(CPVI)后的阵发性房颤患者随访,并行单因素及多因素分析,以期发现房颤早晚期复发的预测因素,提高房颤射频消融的成功率。
1 资料与方法
1.1 临床资料 回顾性入选2007年1月—2009年6月在湘雅二医院行三维电解剖标测系统(CARTO,Biosense-Webster)指导下进行环肺静脉电隔离术的阵发性房颤患者。患者术前常规行经食管超声心动图排除左心耳血栓。对于有心房血栓者,给予华法林抗凝治疗,复查血栓消失后再行电隔离手术。入选病例基本资料,年龄57.8岁±10.3岁(23岁~73岁),女44例(45.8%),房颤史63.9月±71.0月(1月~384月);体重指数(BMI)24.5kg/m2±2.9kg/m2(18.0kg/m2~30.7kg/m2);左房内径(LAS)35.4mm±5.5mm(25mm~55mm);左室射血分数(63.6±8.5)%(22%~77%);左心耳617.9mm2±215.4 mm2(252mm2~1 144mm2);P波最大时程(Pmax)96.4±15.1(60~128);P波离散度(Pd)40.1±9.8(20~88);白细胞计数(WBC)6.5×109/L±1.1×109/L(4.4×109/L~9.9×109/L);C反应蛋白(CRP)3.2mg/L±5.0mg/L(0.52mg/L~24.90mg/L);合并高血压4例,心脏瓣膜病8例;早期复发32例,晚期复发28例。
1.2 方法
1.2.1 手术方法 所有患者签署手术同意书。常规房间隔穿刺后肝素静脉注射,并持续滴注抗凝,送入Swartz L1鞘管,行左心房造影,Lasso环状电极依次放置在各个肺静脉口5mm以内,温度预设定43℃~45℃,能量35W~40W,盐水以17 mL/min灌注下导管消融环同侧肺静脉前庭电隔离,每一点放电至局部双极心内膜电图振幅降低50%以上。
1.2.2 观察指标 年龄、性别、房颤病史、LAS、左室射血分数、BMI、Pmax、Pd、合并器质性心脏病、合并高血压、CRP、术前WBC计数、左心耳大小。
1.2.3 术后随访 患者消融后心电监护24h,填写房颤症状发作的日常记录。所有患者术后2周内及6月后电话及门诊随访,内容包括患者房颤症状,门诊12导联心电图及Holter检查。平均随访时间为9.5个月±2.7个月(4个月~16个月)。1.2.4 相关定义 ①早期复发:房颤患者术后2周内再次出现症状,且被心电图或Holter证实的房性快速心律失常。②P波离散度及P波最大时程:将患者术前窦性心率12导联心电图经扫描仪以100%平扫转存入电脑,并使用photoshop图像处理软件将图像进行1∶1校正。确定P波测量起点为P波起点与等电位线交点,P波终点与等电位线交点为P波测量的终点。Pmax与Pmin差值即为P波离散度。
1.3 统计学处理 采用SPSS17.0软件分析。计量资料以均数±标准差(±s)表示,采用独立样本t检验;计数资料以百分率表示,采用χ2检验。单因素分析显示P<0.1的指标进一步行Logistic多因素回归分析,计算其相对风险(RR)及95%可信区间(95%CI)。双侧P<0.05为有统计学意义。
2 结 果
2.1 消融终点 所有患者均通过CPVI术实现肺静脉电隔离。
2.2 随访结果 共观察96例患者。早期复发心律失常(Ata)32例(33.3%),其中房颤18例(18.8%),房速8例(8.3%),房扑6例(6.3%),早期Ata复发时间3.9d±3.4d。在其后208 d±125d随访,这32例中20例早期复发患者无Ata发生,Ata消失平均时间20d±11d(1d~30d);其余12例仍有Ata发作。在首次消融术后2周内未曾发作Ata的70例患者中,有16例(16.7%)在3个月之后复发Ata。因此,至随访9.5±2.7(4~16)个月时,总计有28例(29.2%)在术后晚期复发ATa,其中房颤16例(16.7%)、房颤合并房速8例(8.3%)、房速4例(4.2%)。
2.3 CPVI术后早期复发的预测因素 单因素分析未见P<0.1的分析指标,年龄(P=0.130)所得结果最接近。未能发现CPVI早期复发的预测因素。详见表1。
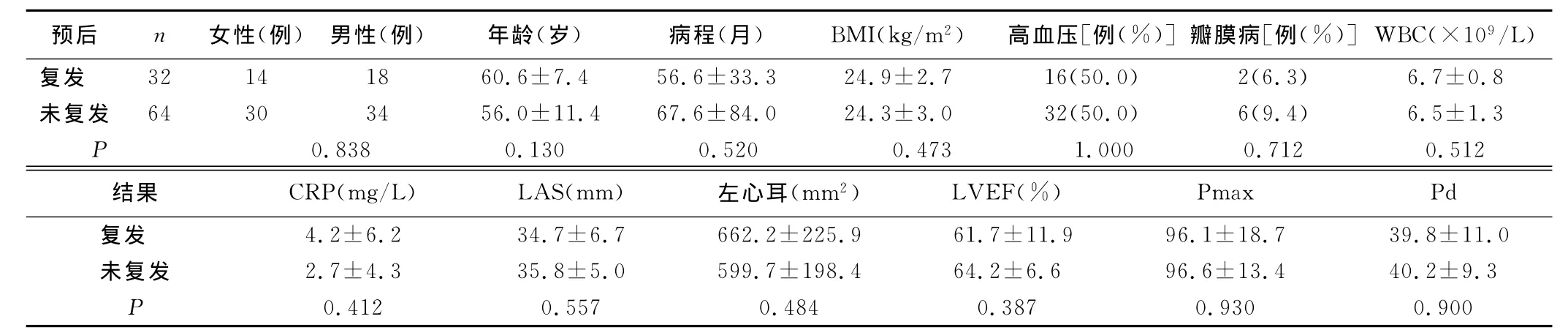
表1 CPVI术后早期复发的预测指标
2.4 CPVI术后晚期复发的预测因素 年龄、合并高血压、C反应蛋白、P波最大时程和P波离散度是术后晚期复发的预测因素(见表2)。进行多因素回归分析后发现仅有合并高血压(P=0.023;OR:0.051;95%CI:0.004~0.668)、P波离散度(P=0.003;OR:1.267;95%CI:0.004~0.668)是术后晚期复发的独立预测因素(见表3)。
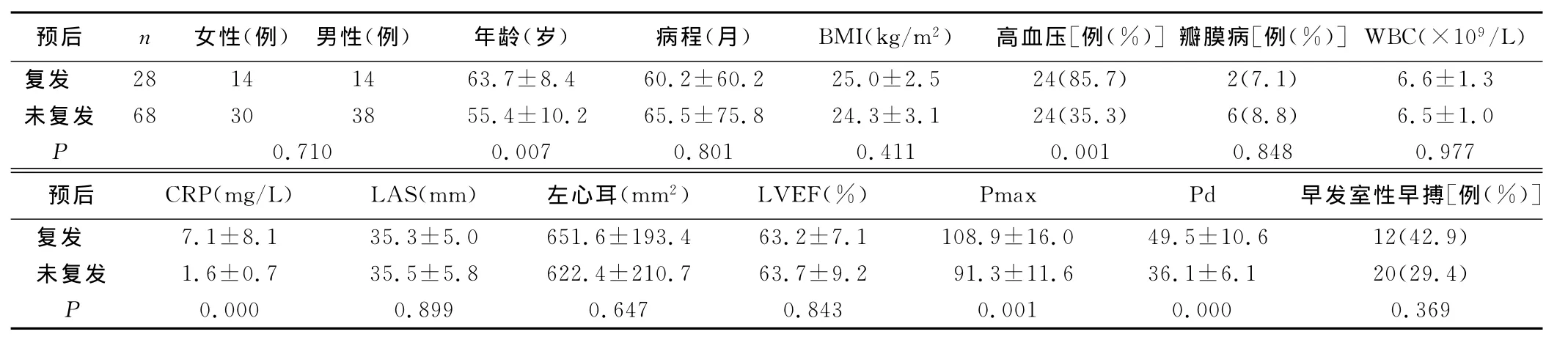
表2 CPVI术后晚期复发的预测指标(单因素分析)

表3 CPVI术后晚期复发的预测指标(多因素回归分析)
3 讨 论
环肺静脉电隔离术目前已成为症状性、复发性及难治性房颤的首选方案[1,2],但对于其术后复发预测因素的研究尚不充分。本研究分析发现,合并高血压、P波离散度是术后晚期复发的独立预测因素。而对于早期复发却未发现明显的独立预测因素,但单因素分析显示年龄对早期复发有一定的参考价值。
本研究房颤早期复发时间定义为术后2周内的任何一次房颤复发。这是由于射频消融具有一定延迟效应,射频能量可引起急性炎症反应,而一般在术后2周左右可形成消融电隔离带。国外学者[3,4]报道高龄患者术后复发率明显提高。Berruezo等[5]对148例接受CPVA手术患者(其中阵发性房颤60.8%,持续性房颤23.6%,永久性房颤15.5%)持续6个月的随访,单因素分析发现房颤术后复发的风险随年龄增加而增大(HR 1.03;95%CI 1.00~1.06,P=0.031)。随年龄增长心肌细胞出现凋亡、传导组织老化、间质纤维化等心房肌的退行性变导致心房肌的电生理趋于不均一性,形成多发子波折返并维持;左心房随年龄增长多存在扩大,所致房颤多为持续性,这可能也为老龄患者术后房颤易早期复发的原因之一。本研究入选案例较少可能为年龄与早期复发无明显相关的原因之一。在随后的随访中有一部分早期复发的患者房颤症状逐渐消失,这种延迟愈合现象在各电生理中心十分普遍[6,7],故早期复发并不一定意味着手术失败。本研究中早期复发与晚期复发交叉分析显示(P=0.369),早期复发32例患者有12例(42.9%)出现晚期复发。早期房颤复发患者中并非后期均会复发,故认为对于早期复发的患者不宜在短期内再次消融,而应给予其延迟愈合的“机会”,至少观察3个月左右再进一步决定是否再次手术。而年龄对于再次手术的时机掌握及术后延迟愈合的预测具有一定的参考价值。
P波离散度既往曾被用来预测房颤和房性心律失常发生[8],其主要机制是当心房肌电活动出现紊乱时,心房的除极、复极会随之减慢,且心房不同部位兴奋性及自律性的差异会随之增大,从而导致心房电活动不同部位的空间向量及弥散度出现显著差异,这些差异在12导联心电图上的反映为P波时间持续延长和不同导联P波时间的差异即P波离散度加大,这是引起AF的重要电生理基础。自Dilaveris等[9]发现阵发房颤患者P波离散度较正常人增大后,P波离散度被纳入不同的房颤研究人群。李岩等[10]研究发现,术前P波离散度≥46ms是阵发性房颤术后复发的预测因素,灵敏度和特异度分别为87%和92%。本研究通过将心电图放大3倍后用专门测量软件测量P波离散度,测量结果在缩小3倍至实际数值,误差值可缩小9倍,大幅度提高测量准确度,发现术后复发患者术前体表心电图P波离散度较未复发者明显增大,若以41ms为界值,术前P波离散度预测阵发性房颤射频消融术后复发的敏感性为86%,特异性为54%。故可以推测,P波离散度增大的患者是房颤术后复发的高危人群。
Vidaillet等[11]报道指出房扑、房颤等心律失常患者中59%伴有高血压病。房颤发生率为正常者1.42倍。国外大规模的LIFE研究(Losartan Intervention for End Point Reduction in Hypertension)[12]通过入选8 851例高血压患者随访发现,收缩压水平(每升高10mmHg风险增加6%)为可以预测房颤风险的4个主要因素之一。Letsas等[13]对72例行PVI术的患者(其中36%持续性,64%阵发性)术后随访1年,并行多元Cox回归分析发现,高血压(HR 3.127;95%CI 1.269~7.706,P=0.013)是房颤术后复发的独立预测因子。本研究单因素与多因素分析均提示高血压与房颤肺静脉电隔离术后晚期复发有密切关系。故高血压对于筛选房颤术后晚期复发的高危人群具有一定的意义。
[1]Piccini JP,Lopes RD,Kong MH,et al.Pulmonary vein isolation for the maintenance of sinus rhythm in patients with atrial fibrillation:A meta-analysis of randomized,controlled trials[J].Circ Arrhythm Electrophysiol,2009,2(6):626-633.
[2]O’neill MD,Jais P,Hocini M,et al.Catheter ablation for atrial fibrillation[J].Circulation,2007,116(13):1515-1523.
[3]Oral H,Pappone C,Chugh A,et al.Circumferential pulmonaryvein ablation for chronic atrial fibrillation [J].N Engl J Med,2006,354(9):934-941.
[4]Haegeli LM,Duru F,Lockwood EE,et al.Ablation of atrial fibrillation after the retirement age:Considerations on safety and outcome[J].J Interv Card Electrophysiol,2010,28(3):193-197.
[5]Berruezo A,Tamborero D,Mont L,et al.Pre-procedural predictors of atrial fibrillation recurrence after circumferential pulmonary vein ablation[J].Eur Heart J,2007,28(7):836-841.
[6]Koyama T,Sekiguchi Y,Tada H,et al.Comparison of characteristics and significance of immediate versus early versus no recurrence of atrial fibrillation after catheter ablation[J].Am J Cardiol,2009,103(9):1249-1254.
[7]刘启明,周胜华,李旭平,等.心房颤动肺静脉电隔离术后早期复发的临床意义[J].临床心血管病杂志,2009,2:115-116.
[8]Perez MV,Dewey FE,Marcus R,et al.Electrocardiographic predictors of atrial fibrillation[J].Am Heart J,2009,158(4):622-628.
[9]Dilaveris PE,Gialafos EJ,Sideris SK,et al.Simple electrocardiographic markers for the prediction of paroxysmal idiopathic atrial fibrillation[J].Am Heart J,1998,135(5Pt 1):733-738.
[10]李岩,刘福强,谢勇,等.P波离散度预测阵发性心房颤动射频消融术后复发的价值 [J].医学临床研究,2011,28(7):1217-1219.
[11]Vidaillet H,Granada JF,Chyou P,et al.A population-based study of mortality among patients with atrial fibrillation or flutter[J].Am J Med,2002,113(5):365-370.
[12]Wachtell K,Lehto M,Gerdts E,et al.Angiotensin Ⅱ receptor blockade reduces new-onset atrial fibrillation and subsequent stroke compared to atenolol:The losartan intervention for end point reduction in hypertension(LIFE)study[J].J Am Coll Cardiol,2005,45(5):712-719.
[13]Letsas KP,Weber R,Burkle G,et al.Pre-ablative predictors of atrial fibrillation recurrence following pulmonary vein isolation:The potential role of inflammation [J].Europace,2009,11(2):158-163.
