糖尿病肾病大鼠蛋白尿和肾组织WT 1表达的相关性研究
2013-09-13池艳春
张 堃 池艳春 郭 静
哈尔滨医科大学附属第四医院肾内科,黑龙江哈尔滨 150001
蛋白尿是糖尿病肾病(DN)主要临床表现,也是引起肾脏损伤的独立危险因素,因此积极探讨蛋白尿的发生机制以及病理改变,对于临床DN的防治具有重大而深远的意义。近年来,足细胞的相关蛋白分子成为研究蛋白尿的发生、发展的热点,而WT1也成为影响足细胞功能的重要因子,对其研究发现可作为判定糖尿病肾病的早期指标。
1 材料与方法
1.1 实验模型的制备
雄性 Wistar大鼠 56只,体重 200~300 g,适应性饲养1周后,随机将其分为两组,对照组(6只)和模型组(50只)。除对照组,其余所有大鼠均行戊巴比妥钠腹腔麻醉(30 mg/kg)后行右肾切除术,2周后给予腹腔注射链脲佐菌素(STZ,溶于0.1 mol/L枸椽酸缓冲液中,pH=4.5,65 mg/kg);对照组仅注射相同数量的枸椽酸缓冲液。48 h后从尾静脉采血用微量血糖仪测定血糖,试纸法测定尿糖。连续3d空腹血糖≥16.7mmol/L,尿糖强阳性视为糖尿病大鼠模型成功。4周后,测定24 h尿蛋白量﹥30 mg为DN成模标准,未成功者剔除。 分别于 STZ 注射成模后第 1、2、4、8、12 周处死各模型组大鼠6只,各时间点大鼠处死前代谢笼内收集24 h尿液,-20℃保存待测;处死大鼠后用生理盐水灌冼,取左肾留取肾皮质,一部分用于病理切片观察和免疫组化检查;另一部分用于Western blot检测。对照组大鼠于第1、2、4、8、12周收集代谢笼24 h尿液测定蛋白量,12周时处死留取肾皮质分别做上述检测。
表1 对照组与各模型组大鼠24 h尿蛋白定量的比较(mg,±s)

表1 对照组与各模型组大鼠24 h尿蛋白定量的比较(mg,±s)
注:与对照组比较,*P<0.05
对照组模型组66 7.82±2.09 39.63±13.01*7.59±2.44 60.51±7.37*7.92±2.89 75.96±18.28*8.53±2.47 90.97±14.19*9.15±2.26 114.74±12.91*组别 只数 1周 2周 4周 8周 12周
1.2 仪器与试剂
STZ(美国 Sigma 公司),苯甲基磺酰氟(PMSF,美国Sigma公司),醋酸纤维膜(美国Pall公司),单克隆鼠抗WT1抗体(美国Santa公司),兔抗鼠IgG(美国Santa公司),血糖仪和试纸(美国强生公司),二辛可宁酸(BCA)蛋白检测试剂盒(美国Pierce公司),光学显微镜(日本Olympus公司),组织匀浆机(德国Heidolph公司),Singmal-15K型低温高速离心机 (德国EPPENDORF公司),紫外-可见分光光度计(日本岛津公司),BIORAD GS-800图像分析系统 (美国Bio-Rad公司),X-光胶片(美国柯达)。
1.3 检测项目
1.3.1 24 h尿蛋白定量 各组大鼠在处死前收集代谢笼内24 h尿液测定尿蛋白量,取4 mL尿液,2000 r/min离心10 min,去除沉渣并于-20℃保存,采用BCA法检测24 h尿蛋白量。
1.3.2 肾脏组织学检查 ①组织学采用光学显微镜观察:脱蜡和水化、苏木素染色、伊红染色、复染、常规脱水、封片、镜检。②新鲜组织经固定,脱水,石蜡包埋进行免疫组化检查,WT1定位。
1.3.3 Western blot 将大鼠的肾脏组织剪碎,冰上称取大鼠肾皮质 100 mg,加入 400 μL(含 PMSF)裂解液于匀浆器中进行匀浆,然后置于冰上经匀浆器和裂解仪和匀组织,提取蛋白,Braford法测定蛋白浓度。将组织液与缓冲液一起加热、上样,进行SDS-聚丙烯酰胺凝胶电泳,电泳后转膜、抗体杂交、显影、洗膜、孵育、曝光、定影后得到蛋白印迹,并用考马斯亮蓝法测定吸光光度值,内参为β-actin,从而确定WT1的含量。
1.4 统计学方法
采用统计软件SPSS 15.0对实验数据进行分析,计量资料数据以均数±标准差(±s)表示,采用方差分析,两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠的一般状态
实验过程中,对照组大鼠精神状态较好,无多食、多尿、多饮,均成活无死亡。造模成功后,模型组大鼠精神状态较萎靡,毛色晦暗无光泽,活动少反应较差,多食、多尿、多饮、消瘦等;模型组大鼠在4周时死亡1只,8周时死亡2只,12周时死亡3只。
2.2 24 h尿蛋白定量
对照组大鼠24 h尿蛋白量低于模型组(P<0.05);在第4周时,模型组大鼠的尿蛋白量开始明显增多,在第12周时达到最大量。结果见表1。
2.3 光镜观察
对照组大鼠肾小球、肾小管、肾间质无病理性改变,结果见图1。在模型组大鼠中,从第4周开始就可以发现足突变形,结果见图2;在第8周时可见足突融合,结果见图3;在第12周时可见部分肾小球体积增大,并伴有系膜细胞、基质增生,足细胞足突融合略有加重,部分上皮细胞空泡变性,肾小管扩张,间质区可见淋巴细胞等,结果见图4。
2.4 免疫组化结果
在肾小管、肾间质中几乎无WT1的表达,WT1表达在肾小球中且位于足细胞的细胞核内,染色呈灰棕色;其染色程度随着尿蛋白量的增多逐渐深染;在第12周时,足细胞的细胞核被染成咖啡色。结果见图 5、6。
2.5 Western blot结果
模型组的WT1表达量从第1周开始逐渐增加,但第1、2周模型组与对照组相比差异无统计学意义(P>0.05),从第4周开始,各模型组大鼠WT1表达量与对照组相比均增多,且差异有统计学意义 (P<0.05)。 见图7和表2。
2.6 24 h尿蛋白量与WT1的相关性结果
各模型组大鼠不同时间点的WT1表达量与24 h尿蛋白量之间存在着显著的正相关关系(r=0.723 52,P < 0.01)。
3 讨论

图1 对照组(HE染色,400×)
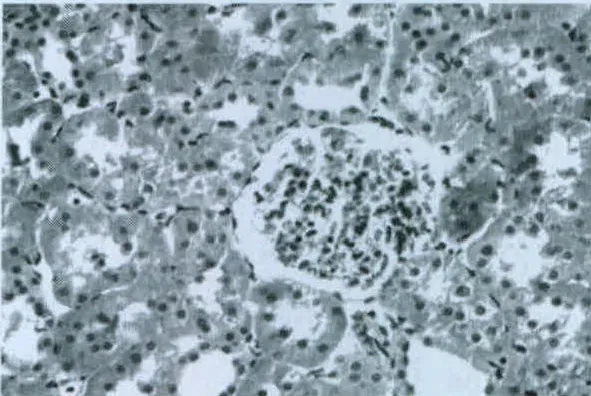
图2 模型4周组(HE染色,400×)
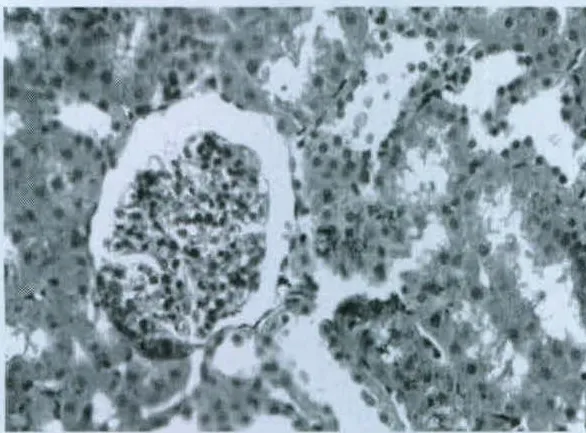
图3 模型8周组(HE染色,400×)
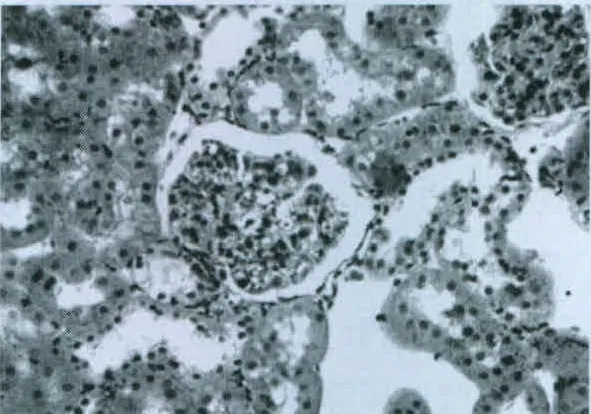
图4 模型12周组(HE染色,400×)
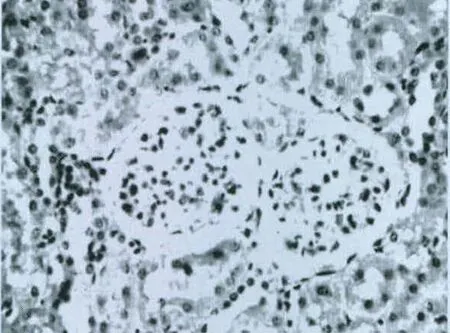
图5 对照组(12周,400×,免疫组化)
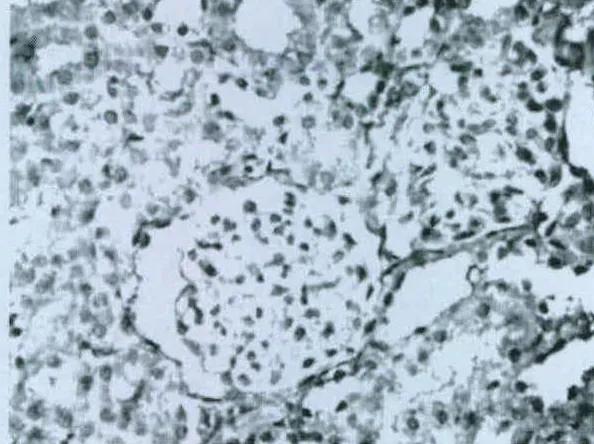
图6 模型组(12周,400×,免疫组化)
表2 对照组与各模型组大鼠WT1蛋白表达水平比较(±s)

表2 对照组与各模型组大鼠WT1蛋白表达水平比较(±s)
注:与对照组比较,*P<0.05
对照组模型1周组模型2周组模型4周组模型8周组模型12周组666666 0.19±0.12 0.43±0.41*0.56±0.36*1.04±0.45*1.51±0.79*2.02±1.06*组别 只数 WT1吸光度/β-actin吸光度
糖尿病是一种内分泌代谢性疾病,它较少直接导致死亡,其真正致死、致残的原因是其严重的并发症,DN即属于糖尿病三大并发症之一,是糖尿病全身性微血管病变之一[1]。DN患者的微血管发生病变,出现糖尿病性肾小球硬化症。DN早期肾体积增大,肾小球滤过率增加,呈高滤过状态,以后逐渐出现间隙蛋白尿或微量白蛋白尿,随着病程的延长,出现持续蛋白尿、水肿、高血压、肾小球滤过率降低,进而出现肾功能不全、尿毒症[2]。因此,若能早期诊断DN,并采取有效的预防性治疗,对阻止糖尿病肾病的发展有重要意义[3]。对已有明显肾病的患者应尽可能减慢肾小球滤过率的下降和SCr上升的速度,以减慢肾脏损害的速度[4]。
蛋白尿不仅是DN早期的主要临床表现,而且是促进DN进展的重要独立危险因素,在蛋白尿的发生中肾小球脏层上皮细胞即足细胞的改变起重要作用。足细胞分子和电荷屏障损伤在DN起始和蛋白尿、肾小球硬化发生发展中起重要作用[5]。近年发现,足细胞上的蛋白对于维持足细胞正常结构和肾小球滤过屏障的功能起着重要作用[6]。WT1是一个肿瘤抑制基因,对泌尿生殖系统的发育有重要的意义[7]。近几年的研究发现WT1与许多肾小球疾病的发生有密切关联。肾脏形成后,其表达仅限于足细胞中,对维持正常的足细胞功能起着非常重要的作用[8]。Denys-Drash综合征(以肾小球迅速发展为终末期肾病、男性假两性畸形、Wilms′肿瘤三联征为特征)是由WT1突变引起的疾病,其肾脏功能损害程度与广泛的肾小球硬化和严重的足突细胞变异有关[9]。Guo等[10]证明,WT1表达水平的减少,将导致肾小球肾炎,其严重性依赖基因量的多少。也有报道称[11],足细胞内WT1表达的减少或缺失与突变蛋白的结合能力下降程度相符。
本实验观察了WT1蛋白在DN大鼠模型中的表达,验证了WT1蛋白存在于细胞核中,与文献提到的相符。 在模型组的第 1、2、4、8、12 周,随着 DN 大鼠尿蛋白量的不断增多,肾小球系膜硬化逐步加重,足突部分融合,WT1蛋白表达水平呈现进行性上升的趋势。这一现象与Guo等[10]证明,WT1蛋白表达水平的减少,将导致肾小球肾炎,其严重性依赖基因量的多少的现象似乎是不一致的。本实验中,模型组大鼠WT1蛋白的表达量从第1周开始增加至第12周,从而可以推断足细胞的变异性改变激发WT1蛋白代偿性的增加,随尿蛋白量的增加WT1蛋白的表达呈现出增多的趋势,但是这种趋势可能是破坏了WT1蛋白原有的增殖体系,破坏了其他维系足细胞分子平衡的机制,因而导致足突的病理改变加重,其功能也随之降低,导致尿蛋白量也随之增多。但在本实验中,模型组大鼠的初、末时间观察点分别在第1周及第12周末,而在此两个观察点前后的时间段,WTI蛋白的变化并没有用实验进一步去探究,所以其变化仍不明确;虽然WT1蛋白的表达量与24 h尿蛋白量之间存在着显著的正相关关系,但是,其相关性仅为72.352%,所以以WT1蛋白来评估早期足细胞损害的程度还有欠缺之处,仍然需要探究证实。
DN治疗的关键在于早期诊断及治疗,DN的早期表现主要是尿微量白蛋白(U-mAlb)的升高,对早期DN U-mAlb的治疗可明显延缓DN进入终末期肾病的时间,DN一旦进展成临床蛋白尿期,肾损害是难以可逆的,有效控制早期DN的进展是目前DM临床的重要课题[12],所以WT1蛋白在提示足细胞早期损伤方面有着重要意义,但其与足细胞损害程度导致蛋白尿产生的相关性还有局限,需待进一步去探索证实。
[1]张愉.老年糖尿病肾病研究进展[J].中国医药导报,2011,8(32):15-17.
[2]杨小东.尿微量白蛋白测定在早期糖尿病肾病中的应用[J].中国医药导报,2011,8(4):36-37.
[3]黄昭华,曹壮,史耀勋.糖尿病肾病的早期诊断与预防[J].中国医药导报,2010,7(29):11.
[4]吴煊,云叶.双嘧达莫与阿魏酸钠联合应用治疗糖尿病肾病临床观察[J].中国医药导报,2010,7(28):64-65.
[5]陈铖,梁伟,丁国华,等.舒洛地特对老龄糖尿病大鼠足细胞的保护作用[J].中国医药导报,2010,29(10):1258-1261.
[6]Steffes MW,Schmidt D,McCrery R,et al.Glommer cell number in normal subjects and in type 1 diabetic patients[J].Kidney Int,2001,59(6):2104-2113.
[7]Lee SB,Haber DA.Wilms'tumor and the WT1 gene[J].Exp cell Res,2001,264(1):74.
[8]Mrowka AL,Schedl A.Wilms'tumor suppressor gene WT1:from structure to renal pathophysiologic features[J].Am Soc Nephrol,2001,11(16):S106.
[9]Patek CE,Fleming S,Miles CG,et al.Murine Denys-Drash sundrome:evidence of podocyte de-differentiation and systemic mediation of glomerulosclerosis[J].Hum Mbl Genet,2003,12(18):2379-2394.
[10]Guo JK,Menke AL,Gubler MC,et al.WT1 is a key regulator ofpodocytefunction:reduced expressionlevelscausecrescentic glomerulonephritis and mesangial sclerosis[J].Hum Mol Genet,2002,11,651-659.
[11]Menke AL,Schedl A.WT1 and glomerular function[J].Semin Cell Dev Biol,2003,14(4):233-240.
[12]李克儒.前列地尔联合厄贝沙坦治疗早期糖尿病肾病[J].中国医药导报,2012,9(1):65-66.
