均匀沉淀法制备纳米氧化镁
2013-09-13乔梅英陈可可
乔梅英,陈可可
(1.河南科技学院 化学化工学院,河南 新乡453002;2.新乡学院化学与化工学院,河南新乡453003)
0 引言
纳米氧化镁是一种新型无机精细功能材料,其可用作催化剂及催化剂载体[1],在催化领域中具有举足轻重的作用.早在1992年 Andersson等[2]就制备了以超细单晶氧化镁为载体的催化剂.霍超等[3]利用超声技术制备了掺钡纳米氧化镁,并以此为载体,以Ru3(CO)12为前驱体,采用浸渍法制备了一系列的钌基氨合成催化剂;后来又以纳米氧化镁为载体,分别采用UC法和UEA法制备出了Ru基氨合成催化剂[4].纳米氧化镁的制备方法大致可分为物理法和化学法两种[5-8],其中化学法中的均匀沉淀法较其他方法具有操作简便、原料易得、生产成本低、产品纯度高、易于实现规模化工业生产等优势[9].所以,笔者以尿素和六水合氯化镁为原料,以聚乙烯醇为分散剂,采用均匀沉淀法合成了超细氢氧化镁,将其煅烧制得粒度分布均匀、分散性好的纳米氧化镁粉体.并探讨了分散剂用量、反应物配比、反应时间和温度、煅烧时间和温度对产物粒径的影响,取得最佳工艺条件;利用SEM、XRD等手段对产物的粒径、结构和形貌进行了表征和分析研究.
1 实验部分
1.1 原料
MgCl2·6H2O、PVA、CH3CH2OH、NH4ClO4、CO(NH2)2,均为分析纯;实验用水均为去离子水.
1.2 纳米氧化镁粉体的制备
称取定量MgCl2·6H2O和CO(NH2)2,配成一定浓度的溶液,加入适量分散剂PVA在MgCl2溶液中,超声波震荡至完全溶解;在一定温度下,量取一定量的CO(NH2)2溶液缓缓加入强烈搅拌下的MgCl2溶液中,加入完成后继续搅拌反应一段时间,经陈化、洗涤,真空抽滤、干燥,得到疏松的白色Mg(OH)2粉体;将Mg(OH)2粉体置于马弗炉中高温煅烧得目的产物纳米氧化镁粉体.
1.3 性能表征
采用DX-2000型X射线衍射仪对产品的物相进行表征,其条件为:Cu靶Kα射线,λ=1.54 Å,管电压 40 kV,管电流 30 mA,扫描速度 5°/min,扫描范围(2θ)10 ~90°;采用荷兰飞利浦公司TECNA1G2型TEM电镜对产品的形貌、粒径和分散性进行分析研究;应用3H-2000型全自动氮吸附比表面积测试仪测量产品的比表面积.
2 结果与讨论
2.1 TG分析
图1为未经煅烧的Mg(OH)2的TG曲线.由图1可知,样品的热失重大概分两个阶段,第一阶段温度变化为:320~400℃,质量损失较大,为75.16%,吸热峰比较尖锐,主要是样品脱水及部分分解引起的;第二阶段温度变化为:400~500℃,吸热峰是氧化镁前驱物分解造成的.500℃以后,样品失重量不再有明显的变化,说明样品基本晶化完全.所以,煅烧前驱物制备氧化镁的煅烧温度要≥500℃,但煅烧温度越高、产品粒径越大,所以实验选用500℃作为制备纳米氧化镁的煅烧温度.

图1 Mg(OH)2的TG曲线Fig.1 TG curves of precursors
2.2 产品的XRD分析
采用均匀沉淀法制得的纳米氧化镁粉体的XRD谱图如图2所示.由图2知,该衍射峰峰形尖锐,峰宽很窄,且无其它杂质峰出现.将其与JCPDS标准卡片对照可知,产品为氧化镁立方晶体,且晶体纯度较高.

图2 纳米氧化镁粉体的XRD图谱Fig.2 XRD pattern of nano-MgO powder
2.3 产品的SEM形貌分析
图3所示为最优条件下制备的氧化镁纳米粉体的SEM形貌照片.由图3可知,利用均匀沉淀法制备的产品颗粒形状为类球形晶体结构,颗粒分散性较好,粒径分布窄,产物粒径在20~60 nm,平均粒径约为50 nm.

图3 纳米氧化镁的SEM图片Fig.3 SEM image of nano-MgO powder
2.4 比表面积分析
将最优实验条件下制备的产品于200℃真空脱气2 h,以He为载气,在液氮温度下吸附,采用BET方法计算比表面积.该法所制得的产品比表面积为134.99 m2/g,远远大于分析纯氧化镁的比表面积(1.88 m2/g).
2.5 反应条件的优化分析
2.5.1 反应物配比和分散剂用量对氢氧化镁收率的影响
前驱物Mg(OH)2沉淀由尿素水解生成的NH4HCO3分散在溶液中形成的OH-与Mg2+结合而得,常温下,尿素的水解极为缓慢,随着温度的升高,水解速度加快.所以,当MgCl2浓度一定时,适当增加尿素的用量可以增大混合溶液中OH-的浓度,从而使Mg2+沉淀更完全,提高氢氧化镁的收率;同时,NH4HCO3是尿素水解过程的中间产物,若一味提高尿素用量,反而会使NH4HCO3收率降低,故为使前驱物Mg(OH)2收率最大,考虑到经济因素,MgCl2和CO(NH2)2的用量有一个相对最佳的配比关系.PVA的加入量为反应溶液质量的0.5‰、混合溶液在100℃反应4 h时Mg(OH)2的收率与CO(NH2)2和MgCl2的摩尔比的关系曲线如图4(a)所示,经试验验证,当CO(NH2)2和 MgCl2的摩尔比为6∶1时所得 Mg(OH)2的收率最大.在纳米粉体的制备过程中,粒子团聚是最大障碍,需要通过加入分散剂来尽量减弱团聚.文章选用聚乙烯醇(PVA)为分散剂,PVA的加入可以使反应物混合物均匀,有效抑制晶粒的生长并防止粒子团聚,但PVA属于高分子化合物,用量过大时,分子链较长,反而会抑制反应的进行.选取CO(NH2)2和MgCl2的用量比为6∶1的混合溶液在 100℃反应4 h,Mg(OH)2的收率与PVA的加入量之间的关系曲线如图4(b)所示,经试验验证,当为反应溶液质量的0.5‰时所得Mg(OH)2的收率最大.
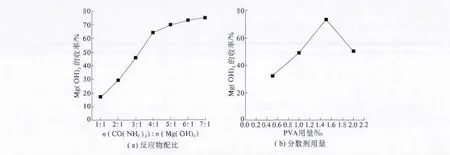
图4 反应物配比和分散剂用量对Mg(OH)2收率的影响Fig.4 Effect of Reactant ratio and Dispersant content on the yield of magnesium hydroxide
2.5.2 反应温度和时间对氢氧化镁收率的影响
由于尿素水解产生OH-的速率决定着Mg(OH)2沉淀的生成速率.而尿素水解速率随温度升高而增大,当温度高于145℃时尿素的水解速率剧增.同时,尿素在加热条件下会发生异构化,在加热至130℃以上时可发生缩合反应,从而大大减少了其水解[10-11].图 5(a)所示为 CO(NH2)2和MgCl2的摩尔比为6∶1、PVA的加入量为反应溶液质量的0.5‰、反应了4 h时,氢氧化镁的收率与反应温度的关系曲线.由图5(a)可知,氢氧化镁的收率随反应温度的升高而增大,但升温后期随着尿素异构化和缩合反应的发生,生成OH-的速率逐渐减慢,氢氧化镁收率的增幅也逐渐变小.综合考虑,选择100℃为本实验反应温度.
尿素水解过程化学反应复杂,十分耗时,具体反应过程可细化如下:

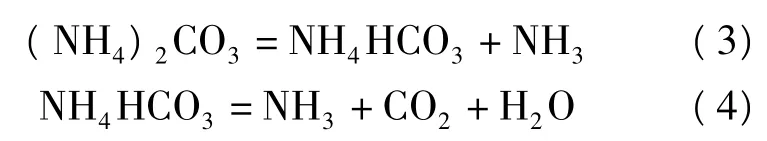
所以,尿素水解产生的OH-的浓度随反应时间的延长而增大.当到达一定的反应时间后,加入的尿素基本上已水解完全,Mg(OH)2的收率随反应时间的延长其增长幅度已不大.CO(NH2)2和MgCl2的用量比为6∶1、PVA的加入量为反应溶液质量的0.5‰、反应温度为100℃时,氢氧化镁的收率与反应时间的关系曲线如图5(b)所示,故该实验的反应时间一般控制在4 h.
2.5.3 煅烧温度和时间对氧化镁粒度的影响
纳米粉体制备过程中前驱物的煅烧至关重要.煅烧温度低、时间短,则前驱物分解不完全,产品收率低、纯度低;煅烧温度高、时间长,则产品粒径会增大.故在确保前驱物分解完全的同时尽量选择低温短时的煅烧.经试验验证,前驱物在500℃煅烧1.5 h得到的氧化镁粉体的粒径最小,平均约为50 nm.
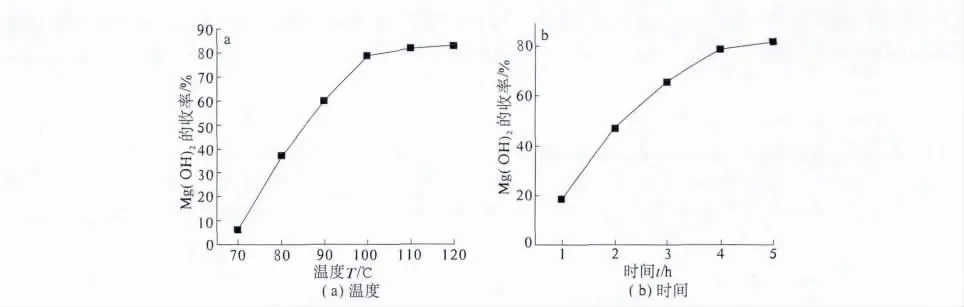
图5 反应温度和时间对氢氧化镁收率的影响Mg(OH)2收率的影响Fig.5 Effect of Reaction temperature and time on the yield of magnesium hydroxide
3 结论
利用均匀沉淀法,以六水合氯化镁为原料,尿素为沉淀剂,聚乙烯醇(PVA)为分散剂合成了氢氧化镁.通过反应条件优化分析确定了合成氢氧化镁的最佳工艺为:反应温度100℃、反应时间4 h、反应物配比尿素和六水合氯化镁的摩尔比为6∶1、分散剂用量为溶液质量的0.5‰;将合成的氢氧化镁在500℃下煅烧1.5 h得到平均粒径约为50 nm的纳米氧化镁粉体.该粉体粒度分散性好、粒径分布窄,收率较好,适合工业化生产.
[1]余润兰,邝代治,邓戊有,等.纳米催化研究进展[J].衡阳师范学院学报:自然科学版,2001,22(6):25-28.
[2]ANDERSSON A,ANDERSSON S L T,CENTI G,et al.Direct propane a mmoxidation to acrylonitrile:kinetics and nature of active phase[C]//New Frontiers in Catalysis-proceedings of the Loth International Congress on Catalysis.Budapest:Elsevier Science Publishers,1992:691-705.
[3]霍超,晏刚,郑遗凡,等.超声法制备掺钡纳米氧化镁及其负载钌基氨合成催化剂的催化性能[J].催化学报,2007,28(5):484-488.
[4]霍超,张学辉,夏庆华,等.制备方法对掺钡纳米氧化镁负载钌催化剂氨合成性能的影响[J].催化学报,2010,31(3):360-364.
[5]WATARI TAKANORI,NAKAYOSH KAZUMI,KATO A.Preparation of submicron magnesium oxide powers by vapor-phase reaction of magnesium and oxygen[J].Journal of the Chemical Society of Japan,1984,6:1075-1076.
[6]CHHOR K,BOCQUET J F,POMMIER C.Syntheses of submicron magnesium oxide powers[J].Materials Chemistry and Physics,1995,40:63-68.
[7]陈改荣,徐绍红,杨军.硬脂酸溶胶凝胶法制备氧化镁纳米微粒的研究[J].功能材料,2002,33(5):521-523.
[8]苗郁,陈改荣,王辉,等.以聚乙二醇6000为分散剂用直接沉淀法制备纳米氢氧化镁[J].河南师范大学学报:自然科学版,2011,39(5):110-113.
[9]张文龙,徐景文,吉超,等.均匀沉淀法制备纳米MgO[J].哈尔滨理工大学学报,2010,15(6):112-115.
[10]张宝林.功能性复混肥料生产工艺技术[M].郑州:河南科学技术出版社,2003:6-7.
[11]陈可可,张保林,许珂.复肥生产过程中缩二脲的生成研究[J].化工矿物与加工,2008,3:23-25,4.
