青蒿素-β-环糊精包合物的制备及表征*
2013-09-12谭清华杨江静唐艳辉段友构
谭清华,杨江静,唐艳辉,段友构
(吉首大学化学化工学院,湖南吉首 416000)
青蒿素-β-环糊精包合物的制备及表征*
谭清华,杨江静,唐艳辉,段友构
(吉首大学化学化工学院,湖南吉首 416000)
研究青蒿素-β-环糊精包合物的制备与性质,通过相溶解度法、红外光谱(IR)对其包合物进行表征.结果表明,β-环糊精可增加青蒿素的溶解度;相溶解度法测定青蒿素与β-环糊精的包合常数为77.44L/mol;IR检测到青蒿素的特征吸收峰,受包合物形成的影响其强度降低、峰形变宽、发生位移或消失等现象,青蒿素与β-环糊精可以形成稳定的包合物.
青蒿素;β-环糊精;包合物;包合常数;红外光谱
环糊精(cyclodextrin,CD)是直链淀粉在由环糊精葡萄糖基转移酶(cyclodexrtin glucosyl transefrase,CGTaes)作用于淀粉后经水解生成的环状低聚糖的总称[1],由6~12个葡萄糖基构成的环状化合物,常见的有α,β,γ3种.β-环糊精具有亲水的外围及疏水的内腔[2-3],在溶液中可与不同系列的客体分子形成包合物.因β-环糊精对客体分子的形状、大小和极性等具有选择性,从而可能形成不同物质的量之比的结构模型包合物,使其包合物分子在物理、化学及生物活性等方面上会发生很大改变[4-6].目前,β-环糊精的这种包合特性已广泛应用于医药、食品和保健品等领域[7],有提高其稳定性、溶解度、生物利用率等作用[8].
菊科植物黄花蒿(即中药青蒿素)在中国用作抗疟中药已有2 000多年的历史.中国科学工作者在20世纪70年代首次分离出一个含有过氧基团的新型倍半萜内酯药物,是无色针状结晶,其结构式为C15H22O5[9-11].青蒿素在进行大量的药理学研究后,结果表明它具有结构上的新颖性和药理作用中高效低毒等特点,有抗疟、抗感染、增强抗体免疫和提高淋巴细胞转化率等功能,临床上主要用于治疗脑型疟疾、抗氯喹疟疾及艾滋病等[12-13].随着对青蒿素研究的不断深入,其药理作用愈来愈受到重视.但青蒿素水溶性差,生物利用率低,且在光、氧、还原性物质及受热的作用下易氧化分解而变质[14-15].青蒿素的这些缺点对其作为药品、食品及保健品的贮存和应用带来阻碍.笔者根据β-环糊精分子的独特结构及特性对青蒿素分子进行包合,采用饱和水溶液法制备β-环糊精与青蒿素的包合物,通过红外光谱(IR)技术对青蒿素-β-环糊精包合物成品进行表征,并采用相溶解度法测定青蒿素和β-环糊精的包合常数,为青蒿素制剂的研究与改进提供参考.
1 实验部分
1.1 材料与设备
1.1.1仪器与设备 DF-101S集热式恒温磁力搅拌器(郑州长城科工贸有限公司),GZX-9070MBE数显鼓风干燥箱(上海博迅实业有限公司),抽滤装置,电子天平(上海民桥精密科学仪器有限公司),紫外分光光度计(上海金力电器有限公司),傅里叶变换红外光谱仪Nicolet IS10(美国Thermo fisher).
1.1.2 材料与试剂 β-环糊精(分析纯),丙酮(分析纯),青蒿素(湘西华立制药有限公司),二次蒸馏水,KBr(光谱纯).
1.2 实验方法
1.2.1 测定波长选择 取青蒿素、β-环糊精,加蒸馏水溶解,以蒸馏水作为对照,分别在紫外分光光度计200~400nm进行扫描,β-环糊精在此范围内无吸收,青蒿素在264nm处有较大吸收,所以选择264nm为青蒿素测定波长.
1.2.2 标准曲线的绘制 精确称取青蒿素0.028 2g溶于10mL丙酮中,用蒸馏水定容到100mL,作为储备溶液.再用储备溶液配制浓度为0.01~1mmol/L系列溶液,以蒸馏水为空白,在波长为264nm处测定吸光度,以吸光度(A)对青蒿素浓度(C)进行线性回归[16].
1.2.3 β-环糊精对青蒿素的增溶作用 分别配制不同浓度梯度的β-环糊精溶液,将青蒿素加入使之达到饱和.溶液经滤纸过滤,在264nm波长处测定各滤液的吸光度,通过测定青蒿素的含量考察环糊精的浓度对青蒿素溶解度的影响.
1.2.4 青蒿素与β-环糊精的包合常数测定 β-环糊精与客体分子形成包合物的包合常数计算方法有多种,通过测定包合常数可以深入探讨β-环糊精分子对青蒿素的包合作用强度.经查阅相关资料并结合本实验实际情况,选取相溶解度法测定青蒿素与β-环糊精包合物的包合常数[17-18].分别配制不同浓度梯度的β-环糊精溶液,加青蒿素使之达到饱和.溶液经滤纸过滤,室温检测,利用紫外吸收光谱在264nm处测定其吸光度.
包合常数的计算根据Higuchi和Connors等[19]提出的方法,稳定常数可以由相溶解曲线的直线部分的斜率计算而得.
1.2.5 青蒿素-β-环糊精包合物的制备及红外光谱测定 β-环糊精与青蒿素形成包合物的制备方法有多种,笔者利用饱和水溶液法制备青蒿素-β-环糊精包合物.25℃条件下,准确称取青蒿素56.4mg,溶于8mL的丙酮中,再准确称取β-环糊精227.0mg溶于60℃的10mL水中,溶液由乳白色变成澄清溶液,在不断搅拌的条件下将丙酮溶液缓慢地加入β-环糊精溶液中,60℃条件下搅拌5h以确保包合反应进行完全.取出,静置1晚,有晶体析出,再用抽滤器抽滤,用水洗涤3次,除去残留的主体,将抽滤后得到的滤饼放入干燥箱中60℃干燥5h,即制得青蒿素-β-环糊精包合物晶体.
同时,按β-环糊精与青蒿素的物质的量比为1∶1进行简单机械搅拌均匀,作为物理混合物,样品经干燥后备用.
采用KBr压片法测定青蒿素、β-环糊精、两者物理混合物和青蒿素-β-环糊精包合物的红外光谱[20],分辨率为2cm-1,4 000~400cm-1全谱扫描.
2 结果与讨论
2.1 标准曲线的绘制
将1.2.2节中的不同样品经紫外分光光度计检测后,以吸光度(A)对浓度(C,mol/L)进行线性回归(图1),回归方程为A=6 282.5C+0.003 4,r=0.998 8.结果表明,青蒿素在0.01~1mmol/L范围内,浓度和吸光度线性关系良好,β-环糊精存在时,青蒿素吸收强度不受影响,故标准曲线可以用于青蒿素与β-环糊精共轭体系下青蒿素的测定.
2.2 β-环糊精对青蒿素的增溶作用
将1.2.3节中不同样品经紫外分光光度计检测后所得β-环糊精对青蒿素的增溶作用的光谱,如图2所示.从图2可知,随着β-环糊精浓度的增加,青蒿素的溶解度逐渐增大,β-环糊精对青蒿素有明显的增溶作用.
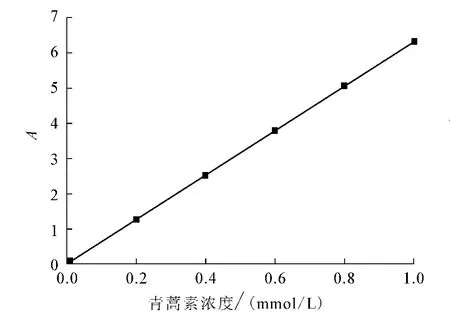
图1 青蒿素的标准曲线
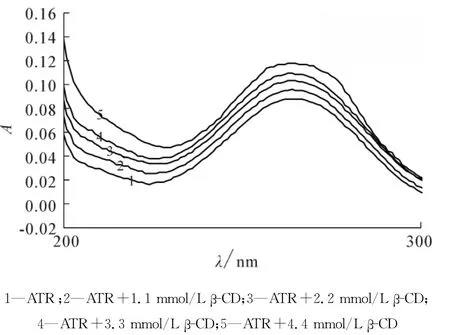
图2 青蒿素在不同浓度β-环糊精溶液中的紫外光谱
2.3 青蒿素与β-环糊精的包合常数测定
由图3可知,青蒿素的溶解度随β-环糊精的加入呈线性增加.根据Benesi-Hildebrand公式,确定青蒿素与β-环糊精的包合计量比为1∶1,则相溶解度方程为
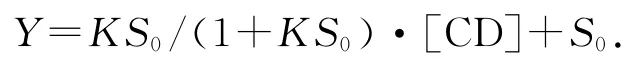
其中:[CD]为β-环糊精的总浓度;Y为β-环糊精存在下客体青蒿素分子的总浓度;S0为客体青蒿素分子的固有溶解度(曲线的截距);K为包合物的形成常数.以客体浓度对β-环糊精浓度作图(图3),由图中的斜率和截距可获得包合物的形成常数K,K=斜率/截距(1-斜率).
青蒿素与β-环糊精形成的包合常数由表1给出,K=7 7.44L/mol.
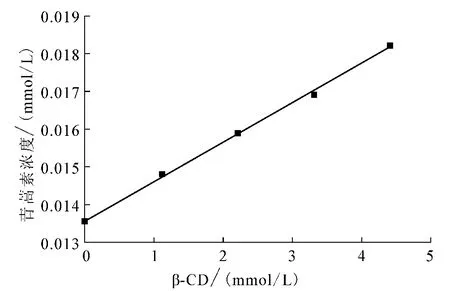
图3 青蒿素在β-CD溶液中的相溶解度(25℃)
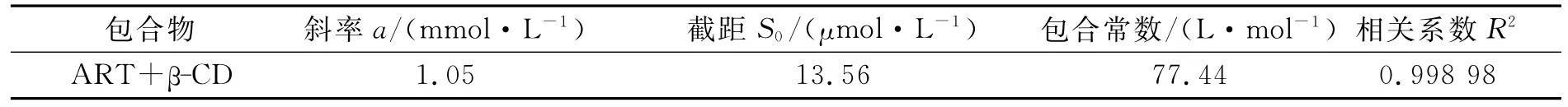
表1 青蒿素-β-环糊精的包合常数
2.4 青蒿素-β-环糊精包合物的红外光谱分析
对青蒿素、β-环糊精、两者物理混合物和青蒿素-β-环糊精包合物进行红外光谱分析,所得图谱见图4.
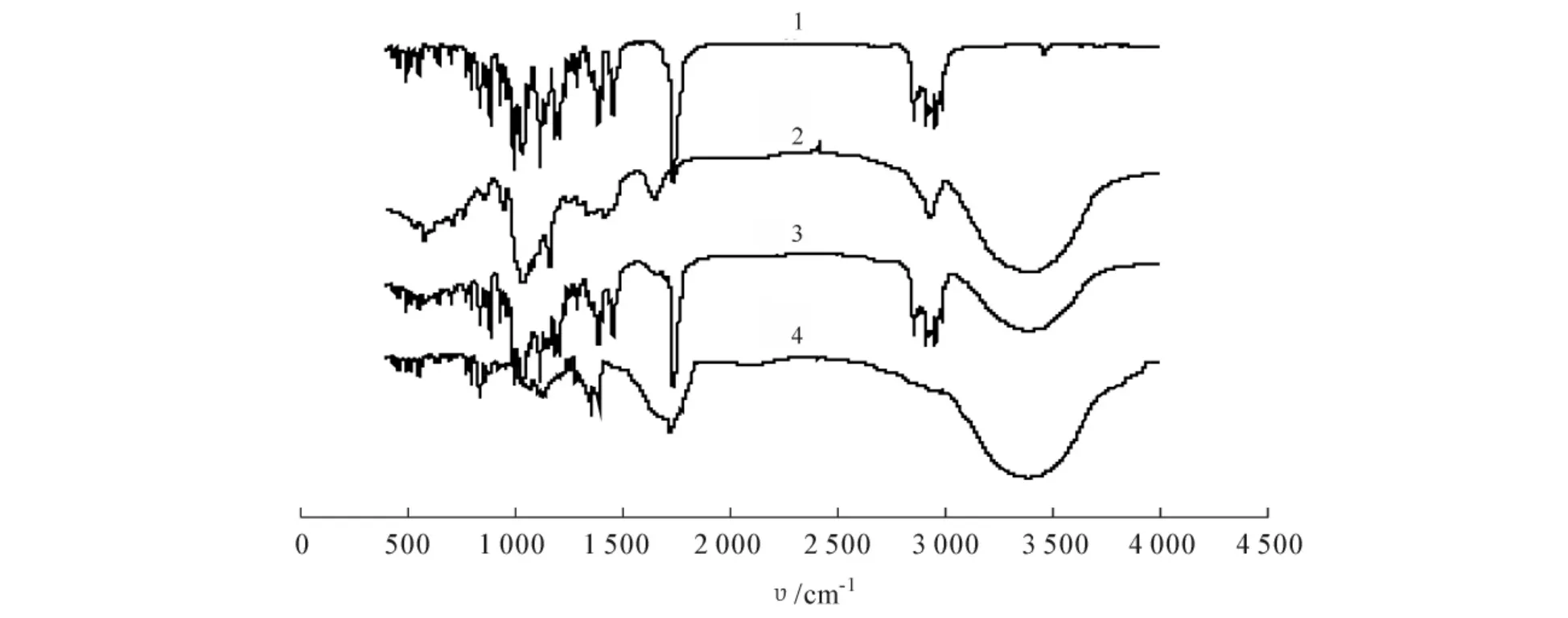
图青蒿素、环糊精、两者物理混合物和青蒿素环糊精包合物的红外光谱
从β-环糊精(β-CD)的红外光谱图4a)可以看出主要特征吸收峰:3 400cm-1,多缔合体—OH的弯曲振动;2 937cm-1,甲基、亚甲基C— H的伸缩振动;718cm-1,亚甲基的平面摇摆振动;1 647cm-1,结合水伸缩振动;1 417cm-1和1 259cm-1,—OH的平面弯曲振动;1 367cm-1和1 336cm-1,C— H弯曲振动;1 085cm-1,醚C—O—C键的伸缩振动.
从青蒿素的红外光谱图4b)可以看出主要特征吸收峰:1 738cm-1,内酯中C== O的伸缩振动;1 116cm-1C—O—C的伸缩振动;724cm-1,O— O的伸缩振动;2 870~3 000cm-1,C— H的伸缩振动;1 450~1 380cm-1,有C— H键的弯曲振动峰;1 116cm-1的C—O—C伸缩振动附近有其他吸收峰,而7 24cm-1的O— O伸缩频率吸收强度较弱,只有1 738cm-1的C== O伸缩振动峰强度较大,峰形较好,周围无其他干扰峰.
从青蒿素和β-环糊精的混合物红外光谱图4c)可以看出主要特征峰:3 400cm-1,多缔合体—OH的弯曲振动;2 870~3 000cm-1,甲基、亚甲基C— H的伸缩振动;1 738cm-1,羧酸酯的C== O键伸缩振动;1 450~1 380cm-1,有C— H键的弯曲振动峰;1 116cm-1的C— O伸缩振动和1 085cm-1的醚C—O—C键伸缩振动叠加.总之,青蒿素的吸收峰基本上都明显存在,只是叠加了β-CD的某些吸收峰.
从青蒿素-β-环糊精包和物的红外光谱图4d)可以看出主要特征峰:3 400cm-1,多缔合体—OH的弯曲振动;1 738cm-1,羧酸酯的C== O键伸缩振动;还有在1 390,1 116,724cm-1等处出现吸收峰.
比较图4c)与4d)可发现2红外光谱图明显不同.这表明青蒿素进入β-环糊精的疏水腔中,主客体分子间相互作用,由于三维空间排列的相互匹配性、范德华力、色散力、静电作用力、氢键、疏水作用等因素的影响,没有形成新的化学键,因此青蒿素-β-环糊精包合物的客体分子的吸收强度降低,峰形变宽,并有较弱的吸收峰消失,表明青蒿素与β-环糊精可以形成稳定的包合物.
3 结语
通过相溶解度法测定了青蒿素与β-环糊精的包合常数为77.44L/mol,并用饱和水溶液法制备青蒿素-β-环糊精包合物,对其包合物进行红外光谱测定.结果表明,青蒿素与β-环糊精可以形成较稳定的包合物,β-环糊精可提高青蒿素的溶解度,并进一步通过红外光谱表征方法分析确定了青蒿素-β-环糊精包合物已经形成.实验结果对青蒿素制剂的研究和改进具有重要的指导意义.
[1] 杨 阳.环糊精包合技术在药物制剂中的应用[J].黑龙江科技信息,2011(7):63.
[2] 杨 郁,张国梅,双少敏,等.环糊精包合作用及其分子识别功能的研究进展[J].光谱实验室,2003,20(2):169-180.
[3] 雍国平,李光水,郑 飞,等.β-环糊精包合物的结构研究[J].高等学校化学学报,2000,21(7):1 124-1 126.
[4] 朱士龙,李 勇,林卫红,等.青藤碱-环糊精包合工艺的优化及包合常数测定[J].食品科学,2012,33(8):54-59.
[5] 朱士龙.青藤碱的稳定性及与环糊精包合物的性质分析[D].吉首:吉首大学化学化工学院,2012.
[6] 朱士龙,陈迪钊,李 勇,等.青藤碱-β-环糊精包合物的制备及表征[J].中草药,2012,43(7):1 328-1 332.
[7] 肖作兵,吕翠翠,冯 涛.β-环糊精/香精包合物研究进展[J].粮食与油脂,2010(3):1-6.
[8] 杜 鹏,张永萍.包合计术在药物研究中的应用[J].贵阳中医学院学报,2008,30(6):62-64.
[9] 李金贵,朱 奎.青蒿素包合物的表征及其对鸡球虫病的防治评价[J].中国兽药杂志,2007,42(2):36-38.
[10] 刘静明,倪慕云,樊菊芳,等.青蒿素的结构和反应[J].化学学报,1979,37(2):129-141.
[11] 王宗德,孙芳华.青蒿素理化性质及其测定方法的研究进展[J].江西农业大学学报,1999,21(4):606-611.
[12] 刘春朝,王玉春,欧阳藩.青蒿素研究进展[J].化学进展,1999,11(1):41-48.
[13] 刘春朝,王玉春,欧阳藩.青蒿素生物合成研究进展[J].天然产物研究与开发,1999,12(1):83-86.
[14] 凌立新,张国芬,姚 晨.青蒿素提取工艺研究[J].亚太传统医药,2009,5(2):37-38.
[15] 吴 慧,朱 奎,李金贵,等.青蒿素-β-环糊精包合物的制备及鉴定[J].黑龙江畜牧兽医,2006(12):94-95.
[16] 欧阳洋,楼紫阳,赵由才.紫外吸光度与渗滤液COD浓度的关系研究[J].苏州科技学院学报,2003,16(3):6-10.
[17] 金小江,周建平.环糊精包合特性及包合常数的测定和预测[J].药学进展,2005,29(11):491-497.
[18] 双少敏,郭祀远,潘景浩,等.相溶解度法测定β-环糊精-芦丁包合物的形成常数[J].分析化学研究简报,1998,2 6(5):564-567.
[19] BENESI H A,HILDEBRAND J H.A Spectrophotometric Investigation of the Interaction of Iodine with Aromatic Hydrocarbons[J].J.Am.Chem.Soc.,1949,71:2 703-2 707.
[20] 张叔良,易大年,吴天明.红外光谱分析与新技术[M].北京:北京医药科技出版社,1993.
(责任编辑 易必武)
Preparation and Characterization of Inclusion Complex Arteannuin withβ-Cyclodextrin
TAN Qing-hua,YANG Jiang-jing,TANG Yan-hui,DUAN You-gou
(College of Chemistry and Chemical Engineering,Jishou University,Jishou 416000,Hunan China)
The preparation and characterizations of the inclusion complex of arteannuin(ART)withβ-cyclodextrin(β-CD)were investigated.The properties of arteannuin withβ-cyclodextrin were characterized and analyzed by phase solubility analysis and infrared spectrography(IR).Results showed thatβ-cylcodextrin could increase the solubility of arteannuin;the inclusion constants of arteannuin withβ-cylcodextrin(β-CD)was calculated as 77.44L/mol;IR spectra showed that the intensity of a few characteristic absorption peak of ART decreased,the peak shape was widened and the displacement changed or disappeared under the influence of inclusion complex.It is concluded arteannuin andβ-cylcodextrin can form stable inclusion complexes.
arteannuin;β-cyclodextrin;inclusion complex;inclusion constant;infrared spectrum(IR)
R283.6
A
10.3969/j.issn.1007-2985.2013.04.016
1007-2985(2013)04-0072-05
2013-03-15
吉首大学研究性学习和创新性实验计划项目(2012ZXJJ06);湖南省教育厅资助项目(JG2011B041);湖南省普通高等学校教改项目(2012);吉首大学重点科研项目(201205-2)
段友构(1954-),男,吉首大学化学化工学院教授,硕士生导师,E-mail duanyougou@126.com.
