医疗器械重复接触全身毒性试验方法研究
2013-09-12侯丽施燕平山东省医疗器械产品质量检验中心山东省医疗器械生物学评价重点实验室济南250101
侯丽 施燕平 山东省医疗器械产品质量检验中心;山东省医疗器械生物学评价重点实验室 (济南 250101)
0.引言
GB/T 16886系列标准是我国医疗器械生物学评价与检验的主要依据。一直以来, 如何正确理解实施GB/T 16886系列标准是医疗器械生物学评价与检验人员和医疗器械生产商所共同关注的问题。 尤其近几年陆续有标准进行版本更新,为使业内人士对新版标准中变动部分较快理解和应用,本文从实际应用的角度,根据2012年4月在美国圣地亚哥召开的国际标准化组织医疗器械生物学评价标委会(ISO/TC194)第23届年会中WG7(Systemic toxicity)工作组的会议内容,结合工作经验对刚刚发布的GB/T 16886.11-2011(ISO10993-11:2007)部分中较为关注的重复接触全身毒性试验进行了解读,并针对标准实施中存在的误区和产生的问题进行了研究并展开讨论,以便更好地贯彻实施GB/T 16886.11标准。
与GB/T16886.11-1997不同,GB/T 16886.11-2011全面修改了全身毒性试验,给出了总则、试验设计、评价指标和最终报告的要求。全身毒性试验包括急性全身毒性试验和重复接触全身毒性试验,后者又可分为亚急性、亚慢性和慢性全身毒性试验。急性毒性与一次剂量(或限制性接触)的不良作用有关,而许多医疗器械更常见的人体接触方式是重复或持续接触形式。重复或持续接触可能会由于化学物在组织内的积聚或其他机制产生反应,长期试验(亚急性、亚慢性、慢性)对于鉴别此类作用是非常重要的。由于慢性全身毒性试验一般是亚慢性试验在时间上的再延长,根据人体接触周期来确定, 记录和报告的很多参数是相同的,因此本文以亚急性、亚慢性毒性试验为例,对不同因素分别进行介绍。
1.试验选择
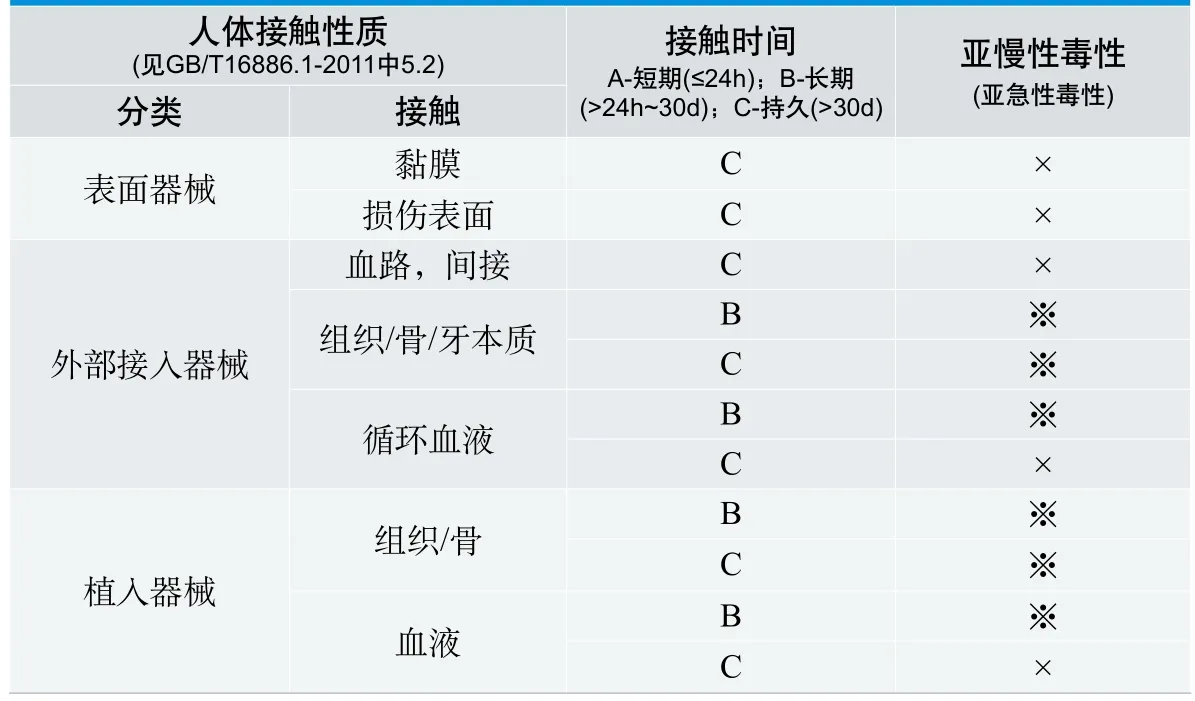
表1. 要考虑的评价试验(亚慢性毒性(亚急性毒性))
按照GB/T 16886.11-2011的要求,与黏膜、损伤表面持久接触的表面器械,与血路间接持久接触、与组织骨牙本质、循环血液长期及持久接触的外部接入器械,与组织骨、血液长期及持久接触的植入器械可能要进行亚慢性亚急性毒性试验。由于标准中将亚慢性和亚急性毒性试验放在一起进行论述,因此如何选择亚慢性和亚急性毒性试验是企业标准制定中面临的问题。无论选择哪种试验,临床累积接触的最长时间应该能覆盖动物的受试物接触时间。表1是GB/T16886.1-2011中考虑要进行亚慢性毒性(亚急性毒性)的器械类型。
2. 接触时间的选择
GB/T 16886.11-2011中关于重复接触全身毒性试验的定义如下:
亚急性全身毒性:在24h~28d内多次或持续接触试验样品后发生的不良作用。时间周期大多选择14d~28d,并考虑合理的方法。其中,亚急性静脉研究一般规定接触时间 >24h,但< 14d。
亚慢性全身毒性:反复或持续接触试验样品后在动物寿命期的某一阶段发生的不良作用。其中,非静脉接触途径下,啮齿动物亚慢性毒性研究一般为90d,其他种属动物在不超过其寿命期的10%的阶段内。静脉研究一般规定接触时间为14d~28d。

表2. 啮齿类和非啮齿类动物的接触周期
慢性全身毒性:在动物的主要寿命期内反复或持续接触试验样品后发生的不良作用。接触时间一般为6~12个月。
从以上定义中可以看出根据选择的动物种类、接触途径不同,不同类型的毒性研究的接触时间也不尽相同。但是以上定义未对其不同给出具体的时间选择。目前在我国进行的试验中(以亚慢性毒性试验为例),一般选用啮齿类动物进行试验,接触方式为静脉注射的试验周期为14~28天不等,为评价带来了难度。在2012年举办的ISO/TC194年会上,WG7工作组专家对以上定义提出了将啮齿类和非啮齿类动物的静脉接触方式的周期分开,见表2 。
3.接触途径
GB/T 16886.11-2011中规定,医疗器械或其可沥滤物可通过多种接触途径进入人体,亚慢性(亚急性)全身毒性试验最好采用具有临床相关性的接触途径,如采用其他接触途径应予以论证。选择接触途径时考虑下列因素:(1)人体实际接触途径和作用时间;(2)医疗器械的理化性质和用途;(3)毒性试验目的。
附录A中提到的接触方式有皮肤、植入、吸入、皮内、肌内、腹腔、静脉、经口、皮下等。ISO 10993-1:2003推荐扩展植入试验方案, 在植入试验中同时进行全身毒性方面的评价, 特别适用于植入类器械。值得注意的是经腹腔途径的全身毒性试验适用于液路器械,或腹腔接触环境导致化学物溶出的器械,也适用于不宜经静脉途径的浸提液,如非极性油浸提液以及含有微粒的浸提液。腹腔途径优于试验样品过滤后静脉注射。
关于浸提介质的选择,标准规定最好选用极性和非极性两种介质。但选用非极性油介质时,需考虑油性介质重复性给药对动物生理指标的影响,因此ISO/TC194工作组推荐将极性介质(NS)和非极性介质(如芝麻油)应用在同一只动物体内(同一动物双重途径给药法,“duel routes of administration - same animal” model),即 iv 每天给药一次,ip3~4天给药一次。
目前进行该试验时,较为困难的是根据产品特点和临床接触方式选择不同的接触剂量和接触途径。但这并不意味着动物的接触方式就一定要和临床人体接触条件完全一致,大部分毒性试验的设计是基于临床应用,由于临床应用是针对人体设计而成的,在用于医疗器械的检验时不宜完全照搬,而是要根据器械具体特性进行适当的修改,使之能反映器械的毒性大小。WG7工作组组长Dr. Daniel McLain认为和组织接触的器械也可以以植入的方式接触动物,如引流系统、可吸收性止血纱布、透明质酸凝胶、体外循环管路等。
4.接触剂量
4.1 剂量组大小
试验周期越长,实验组的动物数量就越多,这样在试验终结时保证每组能有足够的动物进行有效的生物学评价。但是,基于GB/T 16886.2-2011中动物福利的要求,采用最少的动物来获取有效结果。GB/T 16886.11-2011给出了推荐的各接触途径的最少动物数量(见表3)。验组动物完全一致。由于医疗器械重复接触全身毒性试验与经典的化学物毒性试验不同,通常不会产生剂量反应作用,这样在最高剂量水平不一定产生毒性作用。采用一种适宜的试验样品剂量进行单剂量组试验可判定是否存在毒性危害(即限度试验),但其他多剂量或剂量反应试验要求多
4.2 剂量组数
GB/T 16886.11-2011规定,对于较长期试验,宜包括至少三种剂量水平和适当的对照组。对照组动物除了不接触试验物质,其他处置方式与试个剂量组来判定毒性反应。试验所采用的剂量范围将会提供有效的人体安全应用界限评估。其中,慢性全身毒性试验可在亚慢性毒性试验的基础上增加剂量组,包括卫星剂量组。

表3. 推荐的剂量组最少动物数量
如准备采用加严剂量,可增加剂量组。剂量加严时可考虑下列参数:临床接触表面积的倍数;接触周期的倍数;浸提分数或具体化学物的倍数;24 h接触期的倍数等。
4.3 剂量频率
剂量频率应具有临床相关性,在重复接触试验中,试验周期内动物最好每周7日接触试验样品,也可采用其接触方式(如较长期重复接触试验每周5日接触),但应进行论证。
4.4 剂量体积
GB/T 16886.11-2011中附录B规定试验样品接触最大剂量体积,但不应做为常规接触剂量的选择。以静脉给药为例,大鼠40ml/kg一般为静脉滴注的形式,给药时间越快,就越应注意给药速度对实验动物循环系统的影响(比如采用静推的方式可以适当降低剂量体积)。
5.结果评价
亚慢性毒性(亚急性毒性)试验是一个综合性试验,评价内容包括体重和饲料/水消耗、临床观察、临床病理学(包括采用血液学和临床生化分析来研究组织、器官和其他系统的毒性反应)、大体病理学、器官称重、组织病理学等。这并非要求每个试验的所有观察指标都毫无例外地进行检测。各种试验可根据器械或其浸提液的具体情况选做部分指标。原则是选择能反映试验动物的一般机体状况,能反映器械或其浸提液作用特性、靶器官功能损伤的指标。选取的指标应尽可能全面,但又不因检查过多使动物受到额外的损伤。此外,还可根据预试验中动物的中毒表现,结合医疗器械、或其浸提液的理化特点选择增加某些特征性指标。观察次数和间隔时间可根据毒性反应的性质和严重程度、反应速度和恢复周期来确定,在试验的早期阶段尤其在急性试验中,可能需要增加观察次数。毒性迹象出现和消失的时间、持续时间和动物死亡时间都是很重要的,特别是出现不良反应迹象或延迟性死亡的现象,这种情况下可采用人道方法处死动物以避免使动物遭受不必要的痛苦。表4给出了各类型试验至少应观察的项目。
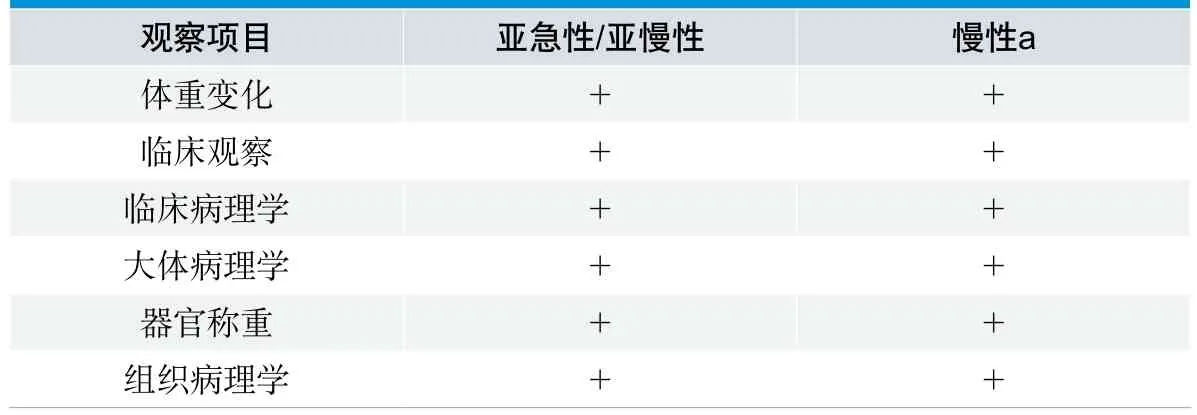
表4. 观察项目
应当注意的是,本文中的表4和GB/T 16886.11-2011中表2略有不同,标准提及的观察项目中亚慢性和慢性毒性指标放在一起,与标准正文的观点不一致。为使评价指标表达更清楚,ISO/TC194WG7工作组专家一致决定将亚慢性和亚急性毒性放在一起,并去掉本列观察项目里的脚注。
但是,由于不同实验室的理解和操作规程不同,有些实验室可能会选择不同的指标参数,比如GB/T 16886.11-2011附录D规定了建议的血液学、临床生化和尿液测定法,附录E规定了建议进行组织病理学评价的器官。但是由于选择的指标不统一造成评价方法不同,给毒性结果的客观性产生一定的影响。为此,ISO/TC194工作组制定了“亚急/亚慢毒性试验哺乳动物组织病理学分层法(tiered histopathology approach” for subacute/subchronic studies)”的方案。在本方案中,列出了需要观察的器官系统为循环、消化、内分泌、泌尿、免疫、肌肉、神经、生殖、呼吸和骨骼系统,每个系统按层(tier)选择一定的指标进行分析,即可先进行第一层(tier 1)的研究,若各项参数均正常则可停止下一步的测试,否则需要根据异常指标选择相关的其他指标进行验证性研究(第二层),或者选择全部指标进行测试以排除其他系统的问题(第三层)。值得注意的是,如何判断第一层(甚至第二层或全部)指标是否“正常(normal)”?即使排除测定前影响指标的诸多因素,可能仍会出现一些观察指标与阴性对照相比产生统计学意义。这时应将临床病理学、组织病理学、样品性质、接触方式和剂量等,结合以前的研究发现综合分析得出是否具有“生物学相关性”的判定后决定是否进行进一步的试验,这就要求检测和评价人员具有丰富的病理学经验和对产品、试验方法充分的理解。目前医疗器械产品种类复杂,重复接触全身毒性试验测试样品的接触方式、剂量、时间等有各种不同的观点,为重复接触长期毒性的评价带来了一定的难度。应注意此类试验的局限性,对结果进行科学的判断。
综上所述,医疗器械的重复接触毒性试验的评价方法可能还不够成熟,但随着产品种类的增多会积累更多的经验,这就需要评价、检测人员和生产企业各方共同做出努力。
[1]GB/T16886.1-2011, 医疗器械生物学评价第1部分:评价与试验[S].
[2]GB/T16886.2-2011,医疗器械生物学评价第11部分:动物福利要求[S].
[3]GB/T16886.11-2011,医疗器械生物学评价第11部分:全身毒性试验[S].
