反复紫外线照射建立皮肤光老化模型
2013-09-12江苏大学附属医院上海市第八人民医院上海200235
石 潇 陈 炜 (江苏大学附属医院上海市第八人民医院,上海 200235)
光老化指由紫外线日积月累的照射引起的皮肤老化,表现为皮肤暴露部位粗糙、皱纹加深加粗、结构异常、不规则性色素沉着、血管扩张、表皮角化不良、出现异常增殖、真皮弹性纤维变性及降解产物蓄积等〔1,2〕。而皮肤光老化可以并发和诱发多种皮肤病变,并与一些皮肤恶性肿瘤有着密切关系。此外,光老化导致皮肤过早皱缩粗糙、毛细血管扩张、色素斑形成等,严重影响外表的美观甚至人的心理。目前,皮肤光老化已经作为一个独立的疾病或者综合征成为国内外的研究热点,因此建立光老化动物模型对研究光老化的机制、预防、治疗皮肤光老化有重要的意义,并且已经有了各种相关的报道〔3,4〕。由于可以省去反复脱毛的繁琐过程以及脱毛对皮肤的刺激和损伤,因此目前国外主要以裸鼠和无毛豚鼠作为模型动物〔5,6〕,而紫外线照射建立的光老化裸鼠,其皮肤结构改变更接近于人的皮肤光老化改变。本文综合考虑国内外建立模型的优势和问题,旨在建立裸鼠局部皮肤光老化模型,为皮肤光老化研究提供更好的动物模型。
1 材料与方法
1.1 药品与仪器 手持式紫外线灯(美国路阳仪器LEB-280 L,2根8 w UVB灯,峰值308 nm);小鼠超氧化物歧化酶(SOD)试剂盒,小鼠羟脯氨酸(Hyp)试剂盒,小鼠丙二醛(MDA)试剂盒(上海恒远生物科技有限公司);普通光学显微镜 Olympus显微镜(日本)。
1.2 实验动物 BALB/c雌性裸鼠15只,6周龄,购于上海斯莱克实验动物有限责任公司。日光灯模拟自然环境(昼夜交替12 h)饲养,常规饲食和饮水,无不良因素影响,适应性饲养1 w使其适应实验室环境后开始进行实验。
1.3 实验方法
1.3.1 实验动物的分组 将15只雌性裸鼠随机分成A、B、C 3组,每组5只。在裸鼠6周龄时用10%水合氯醛(0.2 ml/100 g)麻醉,于其右侧背部用墨汁皮内标记出2.5 cm×1.5 cm大小的位置,作为紫外灯照射区域;左侧相对区域皮肤不照射紫外线,为对照组。A组照射时间为6 w,B组照射时间为8 w,C组照射时间为10 w,并进一步分为6 w实验组A1和6 w对照组A2、8 w实验组B1和8 w对照组B2以及10 w实验组C1和10 w对照组C2。
1.3.2 照射方法及处理 将适应性饲养后的7周龄裸鼠固定,充分暴露出标记区域,用厚纱布遮盖未标记区域皮肤,防止紫外线照射。将紫外灯垂直置于暴露的标记区域皮肤上方6 cm处,按Moloney〔7〕实验所述方法,第1周每次给予裸鼠紫外线照射量为180 mJ/cm2(180 mJ/cm2为最小致红斑量),第2~4周间能量较前1 w 增加1/3,分别为240、300、360 MJ/cm2,此后第5周起维持360 mJ/cm2至各组照射实验结束。此后,A组、B组、C组在各自完成最后一次照射24 h后,断颈处死裸鼠,并立刻取下紫外线照射区域皮肤和对侧等大未照射皮肤。
1.3.3 HE染色 将所取皮肤固定48 h后,取出、脱水,于石蜡包埋,切片后,进行HE常规染色。
1.3.4 SOD、Hyp、MDA检测 取下裸鼠皮肤后立即进行组织匀浆,取上清液,采用ELISA方法测定SOD、Hyp、MDA。
1.4 统计学方法采用SPSS18.0统计软件,计量资料用±s表示,采用单独样本t检验处理数据。
2 结果
2.1 裸鼠照射6 w的实验结果
2.1.1 HE染色 HE染色显示6 w实验组A1与6 w对照组A2未见明显差别,表皮细胞排列整齐,表皮、真皮分界清楚,真皮层可见波浪状纤维组织,有序排列,均匀分布。见图1。

图1 两组大鼠照射6 w皮肤组织学改变(HE)
2.1.2 ELISA检测 SOD、MDA、Hyp结果 6 w实验组 A1与6 w对照组A2大鼠血清SOD差异(P<0.05),MDA、Hyp未见明显差异(P>0.05)。见表1。
表1 照射6 w SOD、MDA、Hyp的变化( ± s,n=5)

表1 照射6 w SOD、MDA、Hyp的变化( ± s,n=5)
与A1组比较:P<0.05
组别SOD Hyp MDA 6 w实验组A1 72.73±3.55 21.40±2.08 6.39±0.24 6 w对照组A2 88.73±7.451)17.87±2.91 5.65±1.07
2.2 裸鼠照射8 w的实验结果
2.2.1 HE染色 HE染色显示8 w实验组B1表皮较8 w对照组B2组稍增厚,分层部分不清,真皮组织排列较乱,分布不均,有少量炎性细胞浸润。见图2。
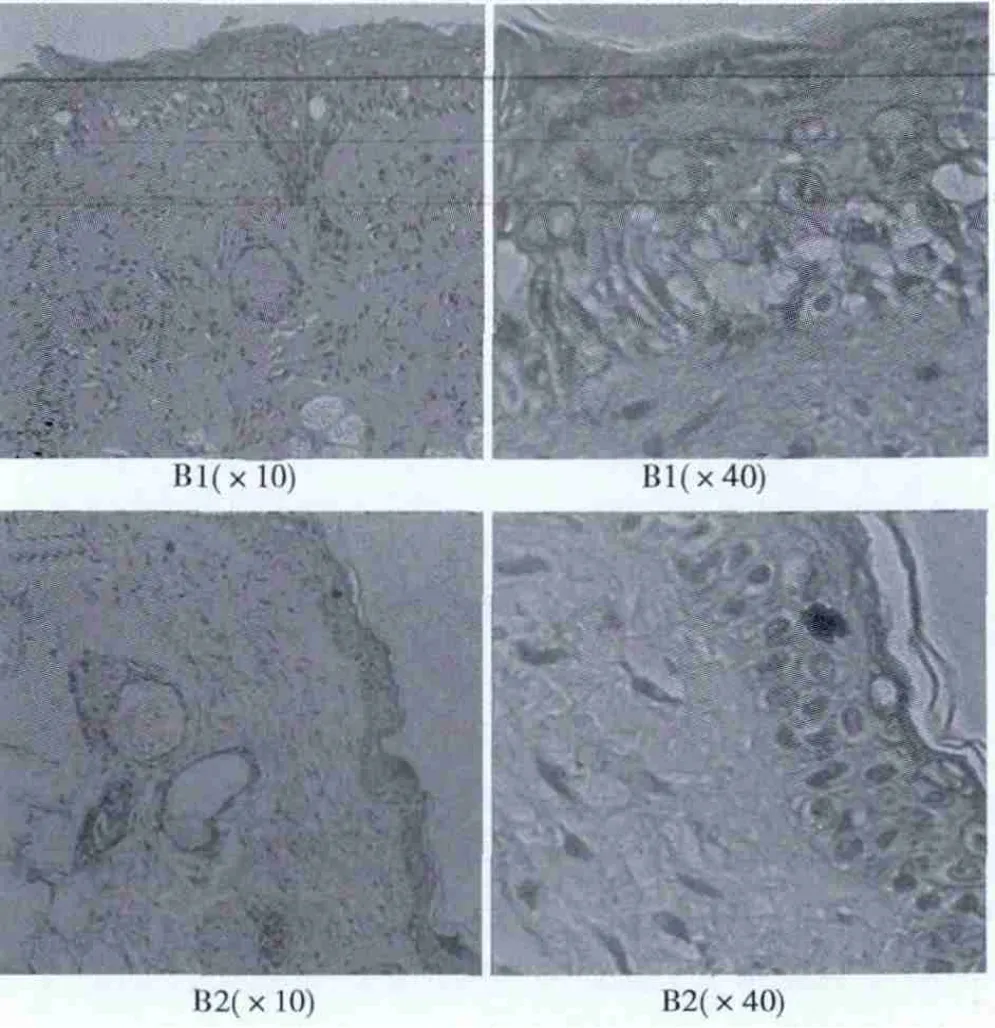
图2 两组大鼠照射8 w皮肤组织学改变(HE)
2.2.2 ELISA检测 SOD、MDA、Hyp结果 8 w实验组 B1与8 w对照组B2 SOD、Hyp差异显著(P<0.05),MDA未见明显差异(P>0.05)。见表2。
表2 照射8 w SOD、MDA、Hyp的变化( ± s,n=5)

表2 照射8 w SOD、MDA、Hyp的变化( ± s,n=5)
与B1组比较:1)P<0.05
组别SOD Hyp MDA 8 w实验组B1 90.03±10.91 25.12±3.51 8.46±1.33 8 w对照组B2 107.95±13.361)35.26±8.051)7.51±2.15
2.3 裸鼠照射10 w的实验结果
2.3.1 HE染色 HE染色10 w实验组C1棘层增厚明显,表皮结构不完整,层次不清晰,真皮层疏松,真皮纤维因发生变性、破坏,真皮组织排列紊乱,炎性细胞浸润。10 w对照组C2表皮细胞排列整齐,分界清楚,真皮层排列有序,分布均匀。见图3。
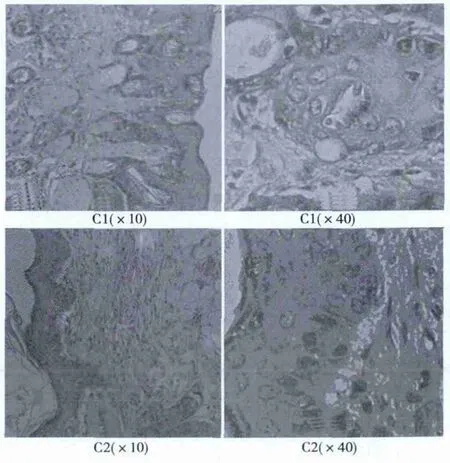
图3 两组大鼠照射10 w皮肤组织病理学改变(HE)
2.3.2 照射10 w血清SOD、MDA、Hyp结果10 w实验组C1与10 w对照组C2 SOD、Hyp及MDA差异均有统计学差异(P<0.05)。见表3。
表3 照射10 w SOD、MDA、Hyp的变化(± s,n=5)

表3 照射10 w SOD、MDA、Hyp的变化(± s,n=5)
与C1组比较:1)P<0.05
组别SOD Hyp MDA 10 w实验组C1 83.63±20.23 24.79±5.49 9.95±0.39 10 w对照组C2 115.57±11.491)33.49±4.211) 9.02±0.221)
3 讨论
目前国内外评价皮肤光老化的客观标准主要是检测衰老皮肤与正常皮肤中的与氧化相关物质(包括测定SOD、谷胱甘肽、过氧化物酶和过氧化氢酶活性,谷胱甘肽含量和MDA水平)是否存在差异。此外,通过肉眼观察到皮肤弹性减退、色素沉着增加以及皱纹形成的增多,并用组织切片观察皮肤表皮层增厚,弹性纤维卷曲、变形,血管网排列紊乱、弯曲扩张,皮脂腺不规则增生等描述性评价方法来鉴定皮肤是否光老化以及光老化的程度。
自20世纪80年代以来,很多国外研究者使用UV照射Skh-1裸鼠,成功的模拟出光老化皮肤的动物模型〔7〕,并且发现Skh-1裸鼠经UV照射后引起皮肤组织的改变非常类似于人类皮肤光老化的特性〔8~10〕。然而,由于Skh-1裸鼠价格昂贵等原因,国内学者常常使用SD大鼠脱毛后,照射UV来建立皮肤光老化模型〔4,11〕。但是,利用SD大鼠建立皮肤光老化模型存在以下缺点:①大鼠自然生长较快,随着造模时间的延长,固定大鼠的难度会越来越大,给实验增加的难度;②造模过程中需要给大鼠反复脱毛,这不仅过程繁琐,而且反复的脱毛会给皮肤带来不同程度的刺激和损伤,影响实验的结果;③由于大鼠在自然环境中,皮肤不会直接受到紫外线照射,因此,紫外线照射脱毛大鼠所造成的皮肤光老化,与人的皮肤光老化相差较大,并不适合作为模拟人皮肤光老化的造模对象。④目前造模方法都是照射鼠的全部皮肤,这不利于在光老化研究中排出实验动物间个体差异。
本文显示局部皮肤反复紫外线照射10 w可以为研究皮肤光老化提供动物模型,运用此方法建立光老化动物模型,不仅可以较好的模拟出皮肤光老化的特点,而且可以为国内学者的研究提供方便,节省科研经费,同时提供较小的动物个体间差异的实验模型。
但是,实验中也存在一些问题和缺陷需要进一步去探究:①SOD指标差异在照射6 w的裸鼠皮肤中就已经出现,并且在照射8 w和10 w的裸鼠皮肤中都存在,是否说明SOD指标较为敏感。②MDA指标的改变出现最晚,只有在照射10 w的裸鼠皮肤中出现,是否可认为MDA指标的敏感性可能不如SOD,但其特异性较高。③胶原蛋白是结缔组织的主要成分,而Hyp是胶原蛋白中主要并相对稳定的氨基酸成分。胶原蛋白含量在年轻阶段较高,而此后持续下降,在老年阶段下降尤为明显〔12〕。给予皮肤组织一定程度的刺激可以诱导胶原蛋白的增生,这可能与6 w实验组A1所测得Hyp含量高于6 w对照组A2有一定的关系。④由于裸鼠皮肤弹性较好,延展性较高,照射部位皮肤HE染色及相关生化指标提示具有光老化特征,但肉眼观察皮肤组织粗燥并不明显,且未见显著皱纹,因而导致此造模方法在某些需要通过肉眼观察皮肤粗糙程度、皱纹深浅及结构变化的实验中受到了限制。⑤虽然10 w实验组C1所制作的裸鼠光老化皮肤模型已经与光老化皮肤接近,但相对于人的暴露于紫外线中所造成皮肤光老化的时间仍然显得短暂,可以进一步延长照射周数,以使得模型动物更加完美。
1 Imayama S,Ueda S,Isoda M.Histologic Changes in the skin of hairless mice following peeling with salicvlic acid〔J〕.Arch Dermatol,2000;136(11):1390-5.
2 Gilchrest BA.A review of skin ageing and its medical therapy〔J〕.Br J Dermatol,1996;135(6):867-75.
3 刘 玮.皮肤光老化〔J〕.临床皮肤科杂志,2003;32(7):424-7.
4 郭鲁义.实用光老化动物模型建立方法的探讨〔J〕.中国美容医学,2008;2(17):235-7.
5 Harrison JA,Wallker SL,Plastow SR,et al.Sunscreens with low sun protection factor inhibit ultraviolet B and A photoaging in the skin of the hairless albino mouse〔J〕.Photodermatol Photoimmunol Photomed,1991;8(1):12-20.
6 Horio T,Miyauchi H,Asada Y.The hairless guinea pig as an experimental animal for photodermatology〔J〕.Photodermatol Photoimmunol Photomal,1991;8(1):69-72.
7 Moloney SJ.The hairless mouse model of photoaing:evaluation of the relationship between dermal elastin,collagen,skin thickness and wrinkles〔J〕.Photochemi Photobiol,1992;56(4):505-11.
8 Kligman LH.The hairless mouse model for photoaging〔J〕.Clin Dermatol,1996;14(2):183-95.
9 Hiroyuki Y,Hiromu S.Chemilumineseent detection and imaging of reactive oxygen species in live mouse skin exposed to UVA〔J〕.Biochem Biophys Res Commun,2000;269(1):131-6.
10 Svohodova A,Waherova D,Vostalova J.Ultraviolet light induced alteration tothe skin〔J〕.Biomed Pap Med Fac Univ Palacky Oiomoue Czech Republ,2006;150(1):25-38.
11 张 璃.小白鼠皮肤光老化模型的建立〔J〕.广东医学,2005;26(12):1642-3.
12 Bjorksten J,Tenhn H.The crosslinking theory of aging-added evidence〔J〕.Exp Gerontol,1990;25(2):91-5.
