Foxn1在小鼠胸腺增龄性萎缩中的作用
2013-09-12王长山金绍静朱金玲张玉萍朱喜科佳木斯大学基础医学院黑龙江佳木斯154007
王长山 李 丽 金绍静 朱金玲 张玉萍 朱喜科 (佳木斯大学基础医学院,黑龙江 佳木斯 154007)
胸腺微环境是一个高度异质性的三维网络,主要构成有骨髓淋巴造血祖细胞起源的胸腺细胞和非骨髓淋巴造血祖细胞起源的胸腺上皮细胞(TECs),为胸腺细胞的发育提供了独特的微环境。而哺乳动物在青春期后胸腺的重量与年龄增长呈负相关〔1〕,即胸腺随着年龄增长发生明显萎缩,这种现象称为胸腺增龄性萎缩。Foxn1是翼状螺旋/叉头转录因子家族成员,在皮肤和TECs表达,在胸腺器官发生中促进TECs表达并调控TECs分化和增殖。Foxn1基因缺失导致了严重的胸腺发育不全和免疫缺陷〔2〕。本项目以不同年龄阶段的C57BL/6小鼠为研究对象,探讨Foxn1的表达在胸腺增龄性萎缩调控中的作用。
1 材料与方法
1.1 动物及分组 实验选用SPF级C57BL/6小鼠,购自中国人民解放军军事医学科学院实验动物中心和四川成都达硕生物科技有限公司。许可证号分别为:SCXK-(军)2007-004;SCXK-(川)2008-24。按年龄随机分为青龄组(1月龄)、中青龄组(4月龄和6月龄)、中龄组(12月龄)和老龄组(18月龄)。每月龄组中雌雄各6只。
1.2 主要仪器与试剂 ABI 7500荧光定量PCR仪;VILBER凝胶成像仪;YJ-1450型医用净化工作台;DYY-Ⅲ2稳压稳流电泳仪。Trizol Reagent/总RNA提取液(Invitrogen公司);Trizol总RNA提取液、PrimeScriptTM RT Reagent Kit、SYBRR Premix Ex TaqTM试剂盒、Real time quantitive PCR引物(购自大连宝生物工程有限公司)。
1.3 方法
1.3.1 胸腺指数及胸腺细胞计数检测 C57BL/6小鼠称重,无菌条件下麻醉,剖开胸腔,摘取胸腺称量,按公式计算胸腺指数。胸腺指数=胸腺重量(mg)/〔体重(g)×10〕。
剪切胸腺小叶至小碎片,37℃在含有0.125%胶原酶D(roche diagnostics)、0.1%DNase I(roche diagnostics)混合物的1640培养基中处理10 min,振荡2~3次,重复此步骤2~3次至组织溶解。收集细胞,200目筛网(75 μm)滤过后1 500 r/min离心5 min,弃上清,加入500 μl PBS混匀用于细胞计数。在冷PBS中撕破胸腺被膜并振荡数次去除胸腺内的淋巴细胞。然后放入DMEM培养基中在4℃继续搅拌1 h。进一步用含有5 U/ml DNase I的1 mg/ml胶原酶Ⅳ(roche,indianapolis,IN,USA)DMEM 溶液在 37℃消化 10 min,振荡 2~3次。此步骤可以重复1~2次直到所有组织被溶解。溶解的细胞,用鼠抗CD45抗体染色,再和结合有抗鼠IgG的免疫磁珠(militenyi biotec)反应,所获得的细胞过LS磁柱收集,通过磁柱的细胞为胸腺上皮细胞。
1.3.2 Real-time RT-PCR扩增TECs内Foxn1 胸腺基质细胞总RNA提取:向收集的106~107胸腺基质细胞的Eppendorf管中加入1 ml Trizol,裂解 5 min。Eppendorf管中加入 200 μl氯仿,用力振荡,室温静置5 min。10 000 r/min 4℃离心15 min,弃上清,移至新的Eppendorf管内,加入等体积异丙醇,充分混匀,室温静置10 min。10 000 r/min 4℃离心10 min,弃上清,加入70%DEPC处理水配制乙醇1 ml,轻轻洗涤管壁。10 000 r/min 4℃离心10 min,弃乙醇,室温真空干燥5 min。加入RNase-free水(DEPC 处理水)30~50 μl,溶解沉淀。取1 μl总 RNA 用紫外分光光度计测260 nm及280 nm的吸光度值,检测提取RNA的重量及产量。总RNA-80℃保存备用。取OD260/OD280在1.8~2.0之间的RNA用于实验。
Real-time PCR反应:采用SYBR Green I荧光染料嵌合法,分别扩增目的基因(Foxn1 mRNA)和管家基因(GAPDH),引物序列如表1所示。在同一次反应中,设置样品Foxn1片段PCR组、样品GAPDH片段PCR组、阴性对照组,每组设2个平行重复。反应结束后,设定阈值,软件输出Ct值;采用比较Ct值方法进行定量,公式为:2-ΔΔCt,其中 ΔΔCt=(Ct目的基因 -Ct管家基因)实验组÷(Ct目的基因-Ct管家基因)对照组。
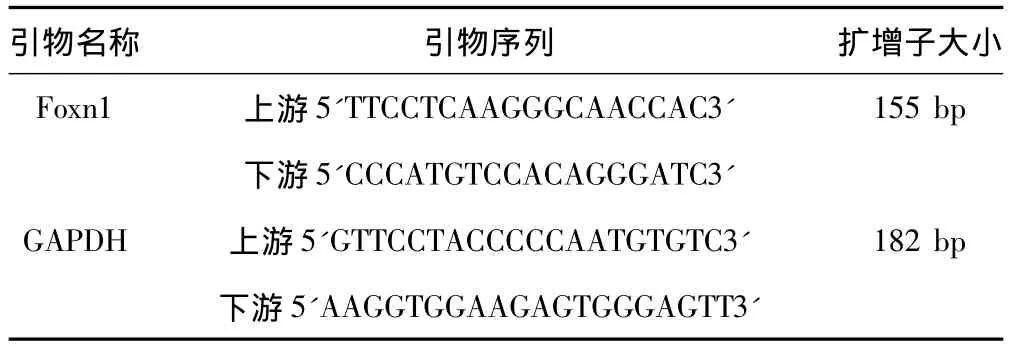
表1 Foxn1和GAPDH引物设计
1.4 统计学分析 采用SPSS17.0软件,组间比较采用t检验,组内比较采用单因素方差分析(one-way ANOVA)。P<0.05为差异有统计学意义。
2 结果
2.1 C57BL/6小鼠胸腺组织形态学结果随着月龄增加,胸腺组织体积表现为明显的逐渐减小趋势,颜色也由乳白变黄白、表面光泽度下降 (图1)。C57BL/6小鼠胸腺重量、胸腺指数和细胞数见表2。
表2 C57BL/6小鼠胸腺重量、胸腺指数及胸腺细胞数比较(± s,n=6)
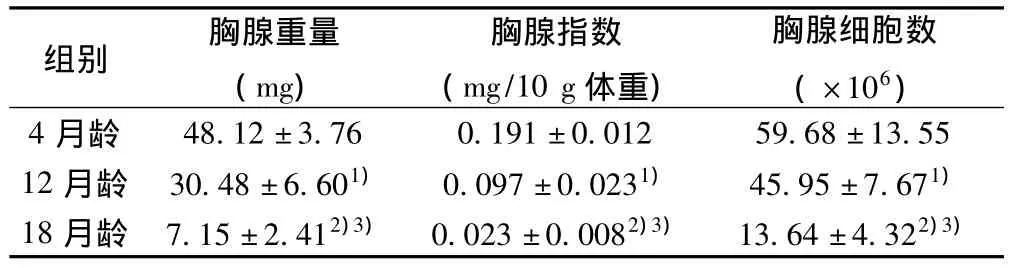
表2 C57BL/6小鼠胸腺重量、胸腺指数及胸腺细胞数比较(± s,n=6)
与4月龄组比较:1)P<0.05,2)P<0.01;与12月龄比较:3)P<0.01
组别 胸腺重量(mg)胸腺指数(mg/10 g体重)胸腺细胞数(×106)4月龄48.12±3.76 0.191±0.012 59.68±13.55 12月龄 30.48±6.601) 0.097±0.0231) 45.95±7.671)18月龄 7.15±2.412)3) 0.023±0.0082)3) 13.64±4.322)3)
4月龄较12月龄胸腺重量显著减少(P<0.05),而12月龄又显著低于18月龄(P<0.01);4月龄与12月龄胸腺指数差异显著(P<0.05),12月龄显著低于18月龄(P<0.01)。胸腺细胞计数结果显示,4月龄较12月龄显著减少(P<0.05),12月龄显著少于18月龄(P<0.01)。
2.2 C57BL/6小鼠胸腺基质发育相关基因Foxn1表达变化Real-time PCR检测小鼠胸腺基质发育相关基因Foxn1表达,基因在其特异的熔解温度有特异性熔解峰。结果表明,随着年龄的增长Foxn1基因表达呈现明显减少,1月龄(0.909±0.119),6月龄(0.689±0.108),12月龄(0.240±0.063),18月龄(0.047±0.010)(P<0.05)。

图1 C57BL/6小鼠胸腺组织体积增龄性变化
3 讨论
胸腺是哺乳动物中枢免疫器官,分泌多种胸腺激素等物质,促进T细胞分化、发育。胸腺自身没有内源性自我更新的干细胞,需要定期从骨髓招募〔3,4〕。来源于骨髓的淋巴造血祖细胞(LPCs)在胸腺与TECs相互作用发育为幼稚T细胞,再接受阳性、阴性选择,最终分化为成熟T细胞〔5,6〕。胸腺中完全发育的TECs组织包括皮质胸腺上皮细胞(cTECs)与髓质胸腺上皮细胞(mTECs)。这些区域为迁移的LPC在胸腺的发育为成熟的T细胞提供了一个独特的内环境——胸腺微环境〔7,8〕。胸腺增龄性萎缩与胸腺微环境密切相关。胸腺增龄性萎缩减少了T淋巴细胞增殖和输出,从而导致幼稚T细胞库用尽和T细胞受体组分的收缩〔9〕。老龄胸腺中胸腺细胞已发生明显退行性改变和凋亡。这样就不可避免地减少对外来抗原的应答性,导致病原体清除延迟,增加了老年人罹患癌症、自身免疫性疾病以及病毒、细菌等病原感染的危险〔10,11〕。
Foxn1是forkhead box(Fox)转录因子家族成员,Fox转录因子家族是一组翼状螺旋/叉头型转录因子家族,包含一个特有的forkhead DNA结合域。在人类发现有20多种forkhead基因,其在内胚层发育及内胚层来源的器官形成中发挥关键性调控作用。Foxn1基因位于小鼠第11号染色体,人类第17号染色体,由9个外显子(exons)构成,其中exon 1为非编码区,包括exon 1a和exon 1b。实验证明这两个外显子的上游序列存在组织特异性的启动子:exon 1a前的启动子在胸腺和皮肤中均有活化,而exon 1b前的启动子则只在皮肤中活化〔12〕。Foxn1是一个保守的转录因子,在人类和小鼠中均有648个氨基酸,其中85%的序列相同。
Foxn1是TECs发育中的转录因子,对于cTECs和mTECs的产生都是必须的,Foxn1在胸腺器官发生中促进TEC表达并调控 TEC 分化和增殖〔13,14〕,据报道,Foxn1-/-裸鼠,TECs 的发育受阻〔15〕。Foxn1-/-小鼠胸腺器官初期发育阶段正常,其原基能形成,但淋巴造血干细胞不能迁入原基内。另外,Mori等〔16〕近来研究发现,Foxn1是小鼠胚胎胸腺内血管化所必需的。实验表明,小鼠出生一周后,降低Foxn1的表达,会造成胸腺结构破坏和退化,皮髓质交界处严重损伤,TECs和T细胞产出减少等一系列生物功能影响,且这种影响是依赖于Foxn1剂量的,该依赖性对于高表达Foxn1的MHCⅡhiUEA-1himTECs尤为敏感〔17〕。Soza-Ried 等〔18〕构造了一种 loxP-fl oxed-Foxn1(fx)小鼠,其Foxn1表现为表达量逐渐减少直至消失,3~6个月fx小鼠胸腺开始萎缩,其胸腺形态大小类似于野生老龄小鼠(18~22个月),在为野生老龄小鼠胸腺提供外源性Foxn1的cDNA,结果有效缓解了胸腺萎缩和外周 CD4+细胞功能的减退。
笔者对增龄C57BL/6小鼠胸腺重量、胸腺细胞数与Foxn1表达量的关系研究结果表明Foxn1不仅对胚胎期的胸腺发育起重要作用,而且对出生后的胸腺维持及衰老时的萎缩具有显著影响。胸腺TECs提供T细胞发育成熟所必需的微环境,TECs内不同基因在特定时间和空间上的表达,形成复杂的网络调控。这些复杂的事件和严格的调控决定了胸腺的生理功能。转录因子与信号转导通路的相互作用中多数涉及Foxn1,转录因子Foxn1在胸腺TECs发育分化中起重要作用。Foxn1表达随着年龄的增长呈显著减少,可通过影响TECs分化和增殖,造成胸腺微环境恶化引起胸腺萎缩。
综上所述,Foxn1参与了胸腺的形成、发育、成熟和退化萎缩各个阶段,其表达水平在TECs不同的发育时期呈现不同的特点。对Foxn1的分子机制研究有利于阐明胸腺维持和退化萎缩机制,进一步为延缓胸腺增龄性萎缩和促进胸腺组织再生打下基础。TECs分化、发育和凋亡涉及诸多信号通路的时序调控,如Wnt和BMP通路可能对TECs的Foxn1表达发挥重要调控作用。但是,目前对于Foxn1的上游信号通路和下游靶基因的理解仍很浅,有待深入研究。
1 Elcüman EA,Akay MT.Age-dependent immunolocalization of fibronectin and histological changes in the thymus of rats〔J〕.Vet Res Commun,1998;22(8):525-32.
2 Taub DD,Longo DL.Insights into thymic aging and regeneration〔J〕.Immunol Rev,2005;205:72-93.
3 Aspinall R,Pitts D,Lapenna A,et al.Immunity in the elderly:the role of the thymus〔J〕.J Comp Pathol,2010;142(Suppl 1):S111-5.
4 Yu S,Abel L,Globerson A.Thymocyte progenitors and T cells development in aging〔J〕.Meth Ageing Dev,1997;94(1-3):103-11.
5 Hirokawa K,Utsuyama M,Kobayashi S.Hypothalamic control of development and aging of the thymus〔J〕.Mech Ageing Dev,1998;100(2):177-85.
6 Chen BJ,Cui X,Sempowski GD,et al.Growth hormone accelerates immune recovery following allogeneic T-cells-depleted bone marrow transplantation in mice〔J〕.Exp Hematol,2003;31(10):953-8.
7 Hartwig M,Steinmann G.On a causal mechanism of chronic thymic involution in man〔J〕.Mech Ageing Dev,1994;75(2):151-6.
8 Anderson G,Jenkinson EJ.Lymphostromal interactions in thymic development and function〔J〕.Nat Rev lmmunol,2001;1(1):31-40.
9 Aspinall R,Andrew D.Age-associated thymic atrophy is not associated With a deficiency in the CD44+CD25-CD3-CD4-CD8-thymocytes population〔J〕.Cells Immunol,2001;212(2):150-7.
10 Gui J,Zhu X,Dohkan J,et al.The aged thymus shows normal recruitment of lymphohematopoietic progenitors but has defects in thymic epithelial cells〔J〕.Int Immunol,2007;19(10):1201-11.
11 Schwarz BA,Sambandam A,Maillard I,et al.Selective thymus settling regulated by cytokine and chemokine receptors〔J〕.J Immunol,2007;178(4):2008-17.
12 Schorpp M,Hofmann M,Dear TN,et al.Characterization of mouse and human nude genes〔J〕.Immunogenetics,1997;46(6):509-15.
13 Wei Q,Condie BG.A focused in situ hybridization screen identifies candidate transcriptional regulators of thymic epithelial cell development and function〔J〕.PLoS One,2011;6(11):e26795.
14 Guo J,Feng Y,Barnes P,et al.Deletion of FoxN1 in the thymic medullary epithelium reduces peripheral T cell responses to infection and mimics changes of aging〔J〕.PLoS One,2012;7(4):e34681.
15 Sun L,Guo J,Brown R,et al.Declining expression of a single epithelial cell-autonomous gene accelerates age-related thymic involution〔J〕.Aging Cell,2010;9(3):347-57.
16 Mori K,Itoi M,Tsukamoto N,et al.Foxn1 is essential for vascularization of the murine thymus anlage〔J〕.Cell Immunol,2010;260(2):66-9.
17 Chen L,Xiao S,Manley NR.Foxn1 is required to maintain the postnatal thymic microenvironment in a dosage-sensitive manner〔J〕.Blood,2009;113(3):567-74.
18 Soza-Ried C,Bleul CC,Schorpp M,et al.Maintenance of thymic epithelial phenotype requires extrinsic signals in mouse and zebra fish〔J〕.J Immunol,2008;181(8):5272-7.
