益生菌治疗非酒精性脂肪性肝病的临床研究
2013-09-11姚惠香陈维雄朱金水
姚惠香,陈维雄,陈 玮,朱金水,孙 群
上海交通大学附属第六人民医院消化科,上海 200233
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)已成为威胁人类健康的一大重要病因。最新的流行病学数据显示,全球人群中NAFLD的发病率非常高,接近20%[1],且约10% ~15%的非酒精性脂肪性肝炎患者最终可以发展为肝硬化[2]。因此,有效的预防及治疗措施成为控制脂肪肝发展成终末期肝病的关键。近年来,随着微生态学研究的深入及发展,肝功能障碍、代谢性疾病与肠道微生态之间的相互联系正不断受到重视[3],新的研究显示,肠道微生态改变、肠源性内毒素血症在NAFLD发病中起着重要作用[4],因而推测益生菌可能对NAFLD具有潜在的治疗作用。本研究通过观察培菲康对NAFLD患者肝功能、肠道屏障功能及超声影像学变化,探索益生菌在治疗NAFLD中的作用及疗效。
1 对象与方法
1.1 研究对象
1.1.1 入选标准:2010年12月-2012年6月我院消化科门诊确诊脂肪肝的患者120例,年龄18~65岁,均符合中华医学会肝脏病学分会脂肪肝和酒精性肝病学组2010年修订的《非酒精性脂肪性肝病或酒精性脂肪肝诊疗标准》[5]。
1.1.2 排除标准:排除妊娠及合并心、肝、肺、肾、脑血管、内分泌等原发疾病及精神病患者,过敏体质及多种药物过敏者;除外明显的肝损伤(血清转氨酶>正常值上限2倍)。
1.2 研究方法
1.2.1 研究设计:采用随机、双盲、平行对照试验,考虑不超过20%的失访率,估算样本量为120例,签署知情同意书,治疗组和对照组均为60例,随机序列号由上海市第六人民医院临床评价中心统一装入密闭信封。
1.2.2 干预措施:符合入选条件的120例患者禁止使用调脂、降糖药物及其他微生态制剂及保肝药物。在给予健康宣教的基础上,治疗组给予口服培菲康(双歧杆菌三联活菌胶囊,上海信宜药厂)840 mg/次,2次/d,对照组不予相关药物治疗,干预过程共3个月。
1.3 观察指标
1.3.1 一般情况:测量治疗前后身高、体质量、腰围和臀围,并计算体质指数(BMI)和腰/臀围比值,记录合并用药情况。
1.3.2 血清学指标:治疗前后通过全自动生化分析仪(OLYMPUS AU2007型)检测患者空腹血清ALT、AST、GGT等指标;采用鲎试剂基质偶氮显色法测定血清内毒素(试剂盒由上海伊华医学科技公司提供);采用分光光度法测定二胺氧化酶(diamine oxidase,DAO)(邻茴香胺甲醇溶液、尸胺二氢氯化物、辣根过氧化物酶和二胺氧化酶标准液为美国Sigma公司产品)。
1.3.3 影像学检查:所有病例治疗前后均行使用A loak Prosound 5500彩色超声诊断仪(探头频率3.0 MHz)进行B超检查,采用直方图技术对脂肪肝做定量分析[6],测量同一切面不同深度的肝组织回声,计算其衰减系数,评价脂肪肝程度[7]。
1.3.4 不良反应:按《药物临床试验质量管理规范》不良反应分级标准。
1.4 统计学处理 统计分析采用SAS 9.2;计量资料用均数±标准差表示,计数资料用率表示;组间均数差异的比较采用t检验,率的比较采用χ2检验;所有统计学检验均为双侧检验,P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 共有120例非酒精性脂肪性肝病患者纳入研究,治疗组与对照组各60例,其中对照组7例中途退出试验,治疗组4例中途退出试验,1例因资料不全被剔除。完成全部治疗、资料完整的病例共108例,治疗组55例,对照组53例。两组性别、年龄、BMI、腰臀比(WHR)差异无统计学意义(P>0.05),具有可比性(见表1)。
2.2 肝功能评价(ALT、AST、GGT) 两组干预前肝功能指标差异无统计学意义(P>0.05);治疗组干预后与干预前比较,肝功能指标明显下降,差异有统计学意义(P<0.05);对照组干预前后肝功能比较,差异无统计学意义(P>0.05);干预后,治疗组较对照组肝功能指标明显下降,差异有统计学意义(P<0.05,见表2)。
表1 两组一般资料比较()Tab 1 Basal characteristics in two groups()
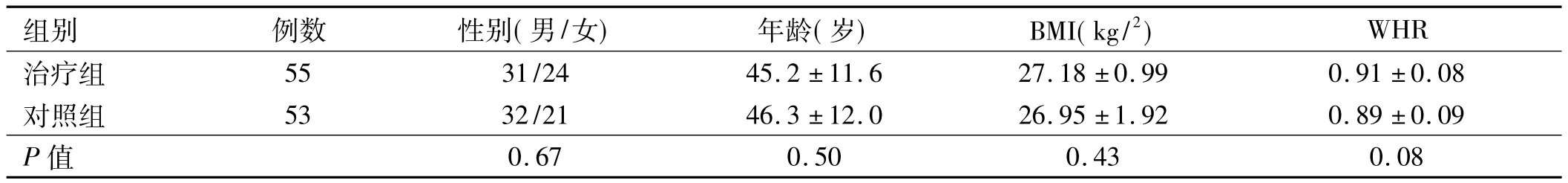
表1 两组一般资料比较()Tab 1 Basal characteristics in two groups()
表2 两组干预前后生化指标比较(,U/L)Tab 2 Liver function in two groups(,U/L)

表2 两组干预前后生化指标比较(,U/L)Tab 2 Liver function in two groups(,U/L)
注:与本组干预前比较,*P<0.05;与对照组干预后比较,#P<0.05。
2.3 肠道屏障功能评价(内毒素、DAO水平) 两组干预前内毒素、DAO水平差异无统计学意义(P>0.05);治疗组干预后与干预前比较,内毒素、DAO水平明显下降,差异有统计学意义(P<0.05);对照组干预前后内毒素、DAO水平比较,差异无统计学意义(P>0.05);干预后,治疗组较对照组内毒素、DAO水平明显下降,差异有统计学意义(P<0.05,见表3)。
2.4 超声影像学评价 两组干预前超声直方图测定肝脏衰减系数差异无统计学意义(P>0.05);治疗组干预后与干预前比较,衰减系数明显下降,差异有统计学意义(P<0.05),对照组干预前后衰减系数差异无统计学意义(P>0.05);干预后,治疗组与对照组比较,衰减系数明显下降,差异有统计学意义(P<0.05,见表4)。
表3 两组干预前后内毒素、DAO水平比较()Tab 3 Endotoxin and DAO level in two groups()
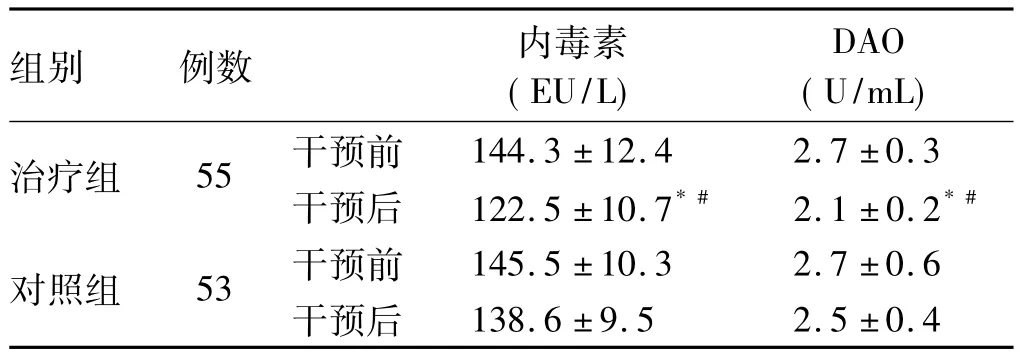
表3 两组干预前后内毒素、DAO水平比较()Tab 3 Endotoxin and DAO level in two groups()
注:与本组干预前比较,*P<0.05;与对照组干预后比较,#P<0.05。
表4 两组治疗前后肝脏超声衰减系数值()Tab 4 Attenuation coefficient in two groups()

表4 两组治疗前后肝脏超声衰减系数值()Tab 4 Attenuation coefficient in two groups()
注:与本组干预前比较,*P<0.05;与对照组干预后比较,#P<0.05。
2.5 不良反应 试验期间两组均未观察到明显不良反应。
3 讨论
最新研究发现,NAFLD的发病与肠道微生态改变、肠源性内毒素血症有关[4],为肠道微生态调节治疗NAFLD提供了理论依据。Lacono等[8]已通过小鼠实验证实了益生菌能缓解NAFLD及胰岛素抵抗,但目前仍缺少大样本的临床试验的疗效证据。为了进一步验证这一理论及证实肠道微生态治疗NAFLD的临床可行性,本研究运用了临床常用的调节肠道微生态的药物培菲康干预NAFLD患者,获得了确切的疗效。
肠道微生态系统是人体最大的微生态系统,含有人体最大的贮菌库和内毒素池,菌种达500余种,重量约1000 g,它们以一定的数量和比例,存在人体的肠道中,构成了肠道的重要生物屏障。肠道与肝脏在解剖和功能上密切相关,肠道微生态失衡,肠道生物屏障功能受损,大量内毒素进入门脉系统,促发炎症介质释放,导致了肝脏的氧化应激和炎症损伤[9-10]。因此,调节肠道微生态平衡,改善肠道屏障功能,减少肠源性内毒素吸收的药物已成为治疗NAFLD新的研究方向。培菲康为含长型双歧杆菌、嗜酸乳杆菌和粪肠球菌的微生态制剂,含活菌数不低于1.0×107CFU,这3种菌是肠道的有益菌,与宿主其他细菌处于共生状态,在肠道中对致病菌产生营养竞争、黏附竞争及生物化学抑制作用,其代谢产物能阻止致病微生物的定植和入侵,该药应用于临床已近20年,对各种原因引起的肠道菌群失调,维持肠道微生态平衡疗效确切[11],但目前在治疗NAFLD方面的临床资料尚不多见。
肠黏膜通透性改变能准确反映肠道屏障功能,通过检测血内毒素和DAO活性,可间接反映肠道黏膜的完整性和通透性变化[12-13]。本实验通过检测干预前后患者血中内毒素和DAO水平的改变,观察益生菌对患者肠道屏障功能的影响。研究结果显示,治疗组给予益生菌干预后,与干预前及对照组相比,患者ALT、AST、GGT及内毒素、DAO水平显著下降、超声肝脏脂肪定量明显减少,治疗过程中未发生不良反应,提示益生菌能有效改善NAFLD患者的肠道屏障功能,改善患者的肝功能,减少肝脏脂肪沉积,且作用安全、有效,值得临床推广。
由于受试验条件限制,本试验未采用肝脏活检标本作为肝脏脂肪定量测定标准,未观察益生菌对NAFLD患者肠道细菌谱改变的影响,对于肠道菌群改变影响肠道屏障功能机制的研究尚不够。因此,有必要通过更完备、深入的试验来解决上述问题,为益生菌治疗NAFLD提供更充分的依据。
[1]Clark JM.The epidemiology of nonalcoholic fatty liver disease in adults[J].J Clin Gastroenterol,2006,40 Suppl 1:S5-S10.
[2]Fan JG,Saibara T,Chitturi S,et al.What are the risk factors and settings for non-alcoholic fatty liver disease in Asia Pacific[J].Gastroenterol Hepatol,2007,22(6):794-800.
[3]Furrie E.A molecular revolution in the study of intestinal microflora[J].Gut,2006,55(2):141-143.
[4]Wigg AJ,Roberts-Thomson IC,Dymock RB,et al.The role of small intestinal bacterial overgrowth,intestinal permeability,endotoxaemia,and tumour necrosis factor alpha in the pathogenesis of non-alcoholic steatohepatitis[J].Gut,2001,48(2):206-211.
[5]The Chinese National Workshop on Fatty Liver and Alcoholic Liver Disease for the Chinese Liver Disease Association.Guidelines for management of non-alcoholic fatty liver disease:an updated and revised edition[J].Chin J Gastroenterol,2010,18(3):163-169.中华医学会肝病学分会脂肪肝和酒精性肝病学组.非酒精性脂肪性肝病诊疗指南(2010年修订版)[J].中华肝脏病杂志,2010,18(3):163-169.
[6]Osawa H,Mori Y.Sonographic diagnosis of fattiy liver using a histogram technique that compares liver and renal corlical echo amplitudes[J].Clin Ultrasound,1996,24(1):25-29.
[7]Wang R,Chen YQ,Zhou YC,et al.The initial analysis of the sonography histrogram for fatty liver disgnose[J].Chin J Clin Gastrogenterol,2006,18(2):91-92.王韧,陈亚青,周永昌,等.超声直方图对脂肪肝诊断的初步分析[J].临床消化病杂志,2006,18(2):91-92.
[8]Lacono A,Raso GM,Canani RB,et al.Probiotics as an emerging therapeutic strategy to treat NAFLD:focus on molecular and boechemical mechanisms[J].J Nutr Biochem,2011,22(8):699-711.
[9]Li L,Wu Z,Ma W,et al.Changes in intestinal microflora in patients with chronic severe hepatitis[J].Chin Med J(Engl),2001,114(8):869-872.
[10]Yang SQ,Lin HZ,Lane MD,et al.Obesity increases sensitivity to endotoxin liver injury:implication for the pathogenesis of steatohepatitis[J].Proc Natl Acad Sci U S A,1997,94(6):2557-2562.
[11]Zhang SC,Ren WY,Zhou K,et al.Endotoxin translocation and intestinal bacterial overgrowth in patients with hepatic cirrhosis [J].Chin J Intern Med,2002,41(9):613.张顺财,任卫英,周康,等.肝硬化时肠内毒素及细菌转位与肠细菌过度生长[J].中华内科杂志,2002,41(9):613.
[12]Ammori BJ,Leeder PC,King RF,et al.Early increase in intestinal permeability in patients with severe acute pancreatitis:correlation with endotoxemia,organ failure,and mortality [J].Gastrointest Surg,1999,3(3):252-262.
[13]Fogel WA.Mucosal mono-and polyamine oxidase activities in digestive tract are distributed complementary to diamine oxidase[J].Neural Transm Suppl,1990,32:345-349.
