抗病毒治疗对HBeAg 阴性CHB患者TGF-β1、TIMP-1、MMP-1水平的影响
2013-07-19周建亮符政远李勇忠
周建亮,符政远,邓 英,李勇忠
湖南省怀化市第一人民医院感染科,湖南 怀化 418000
近年来HBeAg 阴性慢性乙型肝炎患者比例逐渐增多,HBeAg 阴性慢性乙型肝炎患者更易进展为肝炎后肝硬化和原发性肝细胞癌,对抗病毒治疗的持久应答率更低[1]。目前主张HBeAg 阴性慢性乙型肝炎长期抗病毒治疗,但是尚不清楚抗病毒药物是否直接抑制肝纤维化的形成。肝纤维化是慢性肝病发展到肝硬化的中间阶段,近年研究发现肝纤维化及早期肝硬化可以逆转,单纯乙肝病毒DNA 转阴的慢性肝病患者,仍然有部分进展到肝硬化,所以在抗病毒治疗的同时需要抗肝纤维化治疗。但是,临床上缺乏有效的非创伤性检测方法来评价HBeAg 阴性慢性乙型肝炎患者的肝纤维化程度,从而限制了抗肝纤维化药物的研制及应用。已有的研究证实TGF-β1、TIMP-1、MMP-1 是肝纤维化形成中重要的细胞因子[2],本研究观察HBeAg 阴性CHB患者外周血TGF-β1、MMP-1、TIMP-1水平与肝组织活检纤维化分级的关系,评价抗病毒治疗对HBeAg 阴性慢性乙型肝炎患者外周血TGF-β1、MMP-1、TIMP-1 水平影响,探讨抗病毒疗效与血清TGF-β1、MMP-1、TIMP-1的关系。以期为HBeAg 阴性慢性乙型肝炎抗病毒治疗及肝纤维化的治疗提供更多理论依据。
1 对象与方法
1.1 对象及分组 我院2010年9月-2011年9月我院住院、门诊的HBeAg 阴性慢性乙型肝炎患者65例,男45例,女20例,年龄18~65岁。HBeAg 阴性慢性乙型肝炎诊断符合慢性乙型肝炎防治指南(2010年版)诊断标准[3]。HBeAg 阴性CHB 依据肝功能分为轻、中、重度组。门诊正常体检健康者血清30例设为对照组。对于有抗病毒治疗指征的慢性乙型肝炎患者50例给予抗乙肝病毒治疗,采用干扰素或核苷类药物(拉米夫定、阿德福韦酯、恩替卡韦),依据治疗48周后DNA 低于检测下限分为治疗有效组和治疗无效组。共22例进行了肝组织病理活检,其中S0 期4例、S1期6例、S2 期7例、S3 期5例、S4 期0例。
1.2 血清TGF-β1、TIMP-1、MMP-1的测定 采用酶联免疫吸附试验(ELISA)法测定,所有受试者空腹10~12 h,晨起抽肘静脉血3 ml,静置后取上清液,标本放于-20℃保存统一待检。人血清TGF-β1、TIMP-1、MMP-1 测定试剂盒购自美国RD 公司。操作步骤按试剂盒说明进行。
1.3 肝组织TIMP-1、MMP-1 检测 采用免疫组化法检测,免疫组化采用SP 法,所用试剂购自上海太阳生物技术有限公司。结果由两位病理科医师在光学显微镜和图文报告系统下双盲法阅片,MMP-1、TIMP-1染色阳性信号均呈黄色或黄棕色细颗粒状,主要位于细胞质。阳性判断的方法,随机选择10个高倍视野进行计数,根据染色程度和着色细胞百分率进行半定量积分法判断结果,具体判断如下:①阳性细胞≤5%为0 分,6%~25%为1 分,26%~50%为2 分,51%~75%为3 分,>75%为4 分:②阳性强度:无色为0分,淡黄色为1 分,黄色为2 分,棕黄色为3 分。将①、②两者积分相乘,0 分为染色阴性(-),1~4 分为染色弱阳性(+),5~8 分为染色阳性(++),9~12 分为染色强阳性(+++)。
1.4 统计学方法 应用SPSS 13.0 数据统计软件对血清学指标进行方差分析,肝脏病理学检测数据用非参数检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组血清TGF-β1、TIMP-1、MMP-1的水平及比较 HBeAg 阴性慢性乙型肝炎外周血TGF-β1、TIMP-1水平明显高于正常对照组(P<0.01),而血清MMP-1 则明显低于正常对照组(P<0.01)。随慢性肝炎轻度-重度逐渐发展,血清TGF-β1、TIMP-1的水平逐渐增高,且差异有统计学意义(P<0.05);血清MMP-1 水平逐渐下降,差异也具有统计学意义(P<0.05)。
表1 各组血清TGF-β1、TIMP-1、MMP-1的水平及比较(,ng/ml)Tab 1 The comparison of serum levels of TGF-β1,TIMP-1,MMP-1 (,ng/ml)

表1 各组血清TGF-β1、TIMP-1、MMP-1的水平及比较(,ng/ml)Tab 1 The comparison of serum levels of TGF-β1,TIMP-1,MMP-1 (,ng/ml)
2.2 肝组织TIMP-1、MMP-1 阳性表达与肝纤维化分级关系 TIMP-1、MMP-1 染色阳性物质呈黄色、棕黄色细颗粒状或片状,主要分布于肝细胞胞浆中,部分浸润汇管区血管壁和胆管壁上皮细胞也可见阳性表达(见图1)。由表2可知,TIMP-1 蛋白在肝纤维化组织的阳性表达,随肝纤维化程度的加重而增强,呈正相关(rs=0.618,P=0.002);MMP-1 蛋白在肝纤维化组织的阳性表达与肝纤维化程度无相关性(rs=0.077,P=0.732)。
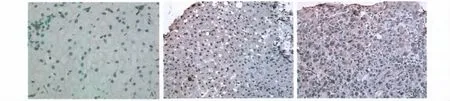
图1 肝组织TIMP-1、MMP-1 蛋白免疫组化 A:阴性对照组;B:TIMP-1;C:MMP-1Fig 1 The immunohistochemistry of TIMP-1,MMP-1 protein in the liver tissue

表2 TIMP-1、MMP-1 蛋白的表达与肝纤维化分级的关系Tab 2 Relationship between expressions of TIMP-1,MMP-1 protein and liver fibrosis
2.3 抗病毒疗效与血清TGF-β1、TIMP-1、MMP-1关系 抗病毒治疗48周后有效组血清TGF-β1、TIMP-1的含量明显下降(P<0.01);MMP-1 水平上升(P<0.01)。无效组血清TGF-β1、TIMP-1、MMP-1 水平变化不明显(P>0.05,见表3)。
3 讨论
肝纤维化病理生理过程非常复杂,主要表现为胶原蛋白为主的细胞外基质(ECM)大量增生和异常沉积,引起肝纤维化发生。细胞因子在肝纤维化进展中扮演重要角色[4]。TGF-β1 是肝纤维化形成中的一种重要的细胞因子,肝损伤时星状细胞、枯否氏细胞及其他细胞通过自分泌或旁分泌的方式产生大量的TGFβ1,炎症或损伤过程中释放的纤溶酶及其他蛋白酶可进一步增强其活性,通过自身调节机制,刺激上述细胞产生更多的TGF-β1,形成逐级放大效应,导致TGF-β1的大量生成和激活[5]。激活的TGF-β 通过与细胞膜上的TGF-βⅠ型和Ⅱ型受体结合发挥作用。已经证实TGFβ1可上调HSC 表达Ⅰ型、Ⅲ型、Ⅳ型胶原[6]及纤维连接蛋白(FN)和层粘连蛋白(LN),促进静息HSC激活。TGFβ1 不仅促进ECM 产生,且抑制基质金属蛋白酶(MMPs)合成,从而抑制ECM 降解。研究发现,TGF-β1 亦可促进HSC 表达金属蛋白酶组织抑制因子(TIMP)[7]。我们的研究表明,HBeAg 阴性慢性乙型肝炎患者外周血TGF-β1 水平高于健康人群,随着炎症由轻到重发展,TGF-β1 水平亦逐渐上升。
表3 抗病毒治疗前后血清TGF-β1、TIMP-1、MMP-1的水平变化(,ng/ml)Tab 3 The changes of serum TGF-β1,TIMP-1,MMP-1 levels before and after antiviral therapy (,ng/ml)
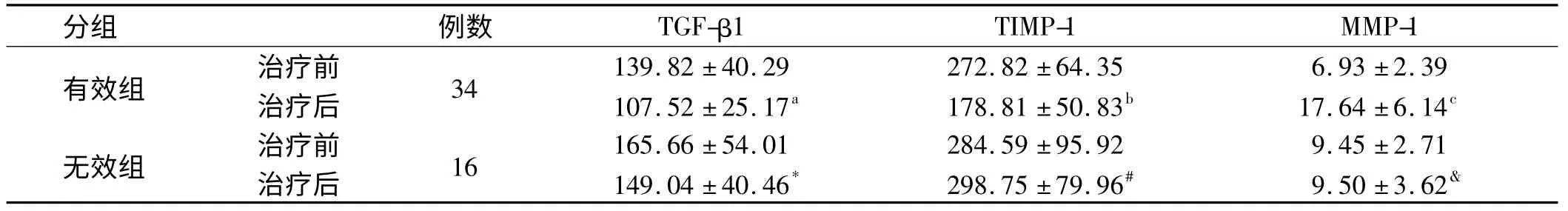
表3 抗病毒治疗前后血清TGF-β1、TIMP-1、MMP-1的水平变化(,ng/ml)Tab 3 The changes of serum TGF-β1,TIMP-1,MMP-1 levels before and after antiviral therapy (,ng/ml)
注:与本组治疗前比较,a(t=4.409,P<0.001);b(t=6.634,P<0.001);c(t=-9.758,P<0.001)与本组治疗前比较,* (t=-2.02,P=0.843);#(t=-4.17,P=0.683);&(t=-0.047,P=0.963)。
肝纤维的形成是胶原合成与降解失衡的结果,如果基质的沉积占优势,则向纤维化方向发展;如果基质降解过程增强,则肝纤维化可逆转、恢复。细胞外基质的降解过程涉及到一系列的蛋白酶类。其中基质金属蛋白酶类(MMPs)及其特异性抑制物组织金属蛋白酶抑制剂(TIMPs)在肝脏基质蛋白的降解过程中发挥十分重要的作用。MMPs 是肝内ECM 在生理和病理状态下降解的主要酶类,目前研究发现MMPs 家族包括25个成员,能降解许多种类的胶原和非胶原基质蛋白。MMP-1主要降解Ⅰ型、Ⅱ型、Ⅲ型和Ⅹ型胶原,而Ⅰ型胶原是肝纤维化时的主要细胞外基质成分[8]。TIMP 是一种能特异地抑制MMPs的糖蛋白,肝纤维化过程中基质金属蛋白酶抑制剂(TIMP)表达增加,抑制MMPs 活性,导致ECM降解不足。一般认为随肝纤维化程度加重,HSC 活化并伴随有TIMP-1 表达的升高,而MMP-1 表达及活性下降[9]。研究表明血清TGF-β1、TIMP mRNA 水平与肝组织炎症、纤维化程度呈正相关,而MMP-1 与纤维化程度呈负相关[10],外周血TIMP-1和TGF-β1可作为早期肝纤维化无创诊断的敏感指标,与肝组织活检结果对照,血清TIMP-1 水平检测肝纤维化的敏感性达100%,特异性达75%[2],与我们的研究结果一致。MMP-1 在不同阶段肝纤维化时表达的研究报道不一。Muraeaki等[11]发现血清MMP-1 水平与慢性肝炎组织学严重程度呈负相关,其活性随慢性肝病的进展而下降,我们研究发现在HBeAg 阴性CHB患者中血清MMP-1 水平随肝脏炎症活动逐渐降低。而Watanabe等[12]研究发现,在四氯化碳导致的肝纤维化大鼠模型中,肝纤维化早期时MMP-1 基因表达升高,进展至肝硬化的则发生下降。在我们的试验中,观察到组织MMP-1 蛋白表达与纤维化分期无相关性。
肝纤维化的治疗最根本的是去除病因,临床研究显示干扰素或核苷类似物抗病毒治疗不仅可减轻肝脏炎症坏死,而且肝组织病理学检查可见纤维化甚至肝硬化有所减轻。我们的研究发现,抗病毒治疗有效组血清TGF-β1、TIMP-1 明显降低,MMP-1 上升,与Guido等[13]在27例慢性丙型肝炎抗病毒治疗观察到的情况一致。Trocme等[14]在干扰素联合利巴韦林抗丙型肝炎的临床研究中发现抗病毒治疗组血清PIIINP、HA、TIMP-1 水平下降,MMP-1 水平升高,即使抗病毒治疗无应答组上述血清学指标亦有改变,Lebensztejn等[15]对47例儿童乙型肝炎患者给予IFN-α 治疗5个月,治疗结束后12个月监测发现血清TIMP-1、MMP-2、Ⅰ、Ⅲ、Ⅳ型胶原的水平显著降低,MMP-9/TlMP-1 比值升高,无应答者肝组织炎症未改善,但其肝纤维化程度显著减轻,提示抗病毒治疗可直接抑制肝纤维化的形成。在我们的观察中,抗病毒治疗无效组,血清TGF-β1、TIMP-1、MMP-1 无明显变化,可能与我们应用的抗病毒药物除了干扰素外,还包括核苷类似物,核苷类似物是否对血清TGF-β1、TIMP-1、MMP-1 有影响,有待进一步实验研究来阐明。
综上所述,联合检测TGF-β1、TIMP-1、MMP-1 是判断慢性肝病患者有无纤维组织增生的敏感而可靠的指标,动态观察上述指标的变化,对临床判断肝纤维化程度和活动度有着重要价值,同时也为临床疗效的判断提供有效的实验依据。
[1]Jia JD.Management of HBeAg negative chronic hepatitis B[J].Chin J Hepatol,2005,13(7):539.贾继东.乙型肝炎e 抗原阴性慢性乙型肝炎的治疗[J].中华肝脏病杂志,2005,13(7):539.
[2]El-Gindy I,El Rahman AT,El-Alim MA,et al.Diagnostic potential of serum matrix metalloproteinase-2 and tissue inhibitor of metalloproteinase-1 as non-invasive markers of hepatic fibrosis in patients with HCV related chronic liver disease[J].Egypt J Immunol,2003,10(1):27-35.
[3]Chinese society of Hepatology of Chinese Medical Association,Chinese Society of Infectious Diseases of Chinese Medical Association.The guideline of prevention and treatment of chronic hepatitis B (2010 Edition)[J].Chin J Hepatol,2011,19(1):13-24.中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南(2010年版)[J].中华肝脏病杂志,2011,19(1):13-24.
[4]Bataller R,Brenner DA.Liver fibrosis[J].J Clin Invest,2005,115(2):209-218.
[5]Inuzuka S,Ueno T,Torimura T,et al.The significance of colocalization of plasminogen activator inhibitor-1 and vitronectin in hepatic fibrosis[J].Scand J Gastroenterol,1997,32(10):1052-1060.
[6]Sato M,Shegogue D,Hatamochi A,et al.Lysophosphatidic acid inhibits TGF-beta-mediated stimulation of type I collagen mRNA stability via an ERK-dependent pathway in dermal fibroblasts[J].Matrix Biol,2004,23(6):353-361.
[7]Hocevar BA,Brown TL,Howe PH.TGF-beta induces fibronectin synthesis through a c-Jun N-terminal kinase-dependent,Smad4-independent pathway[J].EMBO J,1999,18(5):1345-1356.
[8]Théret N,Lehti K,Musso O,et al.MMP2 activation by collagen I and concanavalin A in cultured human hepatic stellate cells[J].Hepatology,1999,30(2):462-468.
[9]Arthur MJ,Friedman SL,Roll FJ,et al.Lipocytes from normal rat liver release a neutral metalloproteinase that degrades basement membrane(type IV)collagen[J].J Clin Invest,1989,84(4):1076-1085.
[10]Zhang BB,Cai WM,Weng HL,et al.Diagnostic value of platelet derived growth factor-BB,transforming growth factor-beta1,matrix metalloproteinase-1,and tissue inhibitor of matrix metalloproteinase-1 in serum and peripheral blood mononuclear cells for hepatic fibrosis[J].World J Gastroenterol,2003,9(11):2490-2496.
[11]Murawaki Y,Ikuta Y,Idobe Y,et al.Serum matrix metalloproteinase-1 in patients with chronic viral hepatitis [J].J Gastroenterol Hepatol,1999,14(2):138-145.
[12]Watanabe T,Niioka M,Hozawa S,et al.Gene expression of interstitial collagenase in both progressive and recovery phase of rat liver fibrosis induced by carbon tetrachloride [J].J Hepatol,2000,33(2):224-235.
[13]Guido M,De Franceschi L,Olivari N,et al.Effects of interferon plus ribavirin treatment on NF-kappaB,TGF-beta1,and metalloproteinase activity in chronic hepatitis C [J].Mod Pathol,2006,19(8):1047-1054.
[14]Trocme C,Leroy V,Sturm N,et al.Longitudinal evaluation of a fibrosis index combining MMP-1 and PIIINP compared with MMP-9,TIMP-1 and hyaluronic acid in patients with chronic hepatitis C treated by interferon-alpha and ribavirin[J].J Viral Hepat,2006,13(10):643-651.
[15]Lebensztejn DM,Sobaniec-Lotowska ME,Kaczmarski M,et al.Matrix-derived serum markers in monitoring liver fibrosis in children with chronic hepatitis B treated with interferon alpha[J].World J Gastroenterol,2006,12(21):3338-3343.
