白三叶草植物内生真菌烟曲霉及其次生代谢产物的研究
2013-09-11杨勇勋董小萍晏永明
杨勇勋,董小萍 ,晏永明,陶 明,罗 茜
1成都中医药大学药学院,中药资源系统研究与开发利用省部共建国家重点实验室培育基地,成都 611137;2西昌学院轻化工程学院,西昌 615000;3中国科学院昆明植物研究所植物化学与西部植物资源持续利用国家重点实验室,昆明 650204
白三叶草(Trifolium repens L.)为豆科多年生草本植物,富含异黄酮类化合物,主要作为优质牧草与庭园绿化。近年来,对三叶草的化感作用的研究报道不断增多,如Ross等[1]报道了7种三叶草对杂草的生长有抑制作用,而且它们对杂草的抑制作用大小不同;张晓芳等[2]报道了白三叶草的花、叶挥发物具化感作用。
当前的研究认为,植物内生菌与寄主植物形成的是一种互生关系,而且植物内生菌能增强植物的防御能力[3]。紫茎泽兰(Eupatorium adenophorum)为一种外来入侵生物物种,现还未有一条有效的生物防治方法,但在紫茎泽兰的生态学调查中,我们发现白三叶草群落中却无紫茎泽兰,说明白三叶草可能具有抑制紫茎泽兰的能力。因此,为寻找一条防治紫茎泽兰的生物防治方法,我们对白三叶草的植物内生菌及其次生代谢产物进行了研究。现从白三叶草中分离得到一株真菌,经形态及18s RNA测序,鉴定为烟曲霉(Aspergillus fumigatus),采用大米固体培养基发酵,其乙酸乙酯提取物具有抑制种子发芽的能力,因此,我们对其进行了化学成分的研究,分离得到了四个生物碱化合物,经理化性质与波谱测试,鉴定为:pyripyropene A(1)、verruculogen(2)、fumigaclavine C(3)、fumiquinazoline J(4),其中化合物1~3采用钙流模型测试了它们的生物活性,但结果显示:化合物1~3均无促进钙离子细胞内流的活性。
现代研究认为烟曲霉是引起人类肺部感染非常重要的一种曲霉菌,有从泥土[4]、海洋[5]、植物[6]中分离得到的报到。到目前为止,分离得的代谢产物至少有226个[7],许多具有很强的生物活性,例如,pyripyropene A[8]为乙酰辅酶A:胆甾醇乙酰转移酶抑制剂,具医疗应用价值,因此,白三叶草植物内生菌烟曲霉及其次生代谢产物在紫茎泽兰的生物防治及在医药中的应用前景还值得我们进一步深入研究。
1 仪器与材料
Bruker AV600 MHz及 Bruker AV400 MHz核磁共振仪(TMS作为内标,δ为 ppm,J为 Hz);Xevo TQ-S超高压三重四极杆质谱仪;柱层析用硅胶(200~300目)和薄层层析用硅胶(10~40 μm),青岛海洋化工厂生产;Rp-C18硅胶为40~60 μm,由 Daiso公司生产;MCI gel CHP 20P为日本三菱公司产品;Sephadex LH-20为GE公司产品;10%H2SO4乙醇溶液为显色剂。
白三叶草叶片于2010年12月采集于西昌学院校园,原植物由第一作者鉴定,分离的白三叶草植物内生真菌烟曲霉由云南大学微生物所李文均教授鉴定。
白菜种子(昆玉牌高抗王AC-3F1,云南省昆明市华农种业有限公司)购于昆明市茨坝农资店。
2 提取与分离
2.1 植物内生菌的分离与鉴定
白三叶草健康新鲜叶片于自来水冲洗洗净,甩干水,于75%乙醇液中浸泡5 min,取出,再于2%次氯酸钠溶液中浸泡20 min,取出,无菌水冲洗3~4次,无菌刀将其切成约0.5 ×0.5 cm的小片,贴附于PDA培养基上,37℃培养至切片边缘长出菌丝,划线分离至PDA培养基上的菌落为单一菌落,插片法观察菌落形态,18s RNA基因测序鉴定本菌种为烟曲霉(Aspergillus fumigatus),见图1。
图1 烟曲霉孢子的形态Fig.1 The morphology of Aspergillus fumigatus
2.2 发酵与提取
采用大米(5 kg)固体发酵培养基发酵,种子培养基为不加琼脂的PDA培养基,按10% ~20%的接种量接种于大米培养基,待菌丝长满,乙酸乙酯提取三次,提取液减压回收溶剂,得浸膏15 g。
2.3 种子发芽抑制实验
取0.2 g乙酸乙酯提取物,用2 mL水溶解,各移入1.0 mL放有滤纸的二个培养皿内,空白为仅有滤纸的培养皿,蒸馏水润湿滤纸,每皿中放入子粒饱满的30粒白菜种子,室温培养4天,每天观察,结果显示:提取物对白菜种子有明显的抑制其发芽的能力。
2.4 分离
浸膏用硅胶拌样上硅胶柱,切柱,分I~IV个部位,取部位II上凝胶柱,氯仿∶甲醇(3∶2)洗脱,共分七个部位,部位5~7再经Sephadex LH-20、反相硅胶、正相硅胶色谱分离纯化,最终得化合物1(9.0 mg)、2(6.0 mg)、3(78.5 mg)、4(1.5 mg),见图 2。
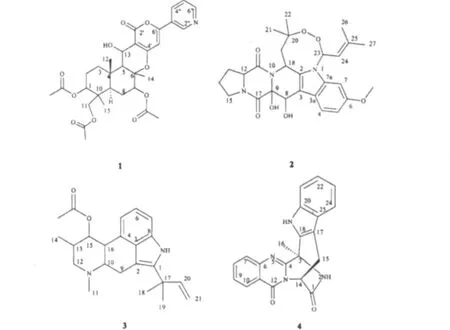
图2 化合物1~4的结构Fig.2 Chemical structures of compounds 1-4
3 结构鉴定
化合物1:白色固体(CHCl3-CH3OH);ESI-MS m/z:[M+Na]+606,[2M+Na]+1189,显示分子量为583;1H NMR(400 MHz,CDCl3)δH:4.80(1H,dd,J=11.5,4.8 Hz,H-1),1.90(1H,m,H-2a),1.82(1H,m,H-2b),2.16(1H,m,H-3a),1.30(1H,m,H-3b),1.54(1H,m,H-5),5.02(1H,m,H-7),1.63(1H,m,H-8a),1.77(1H,m,H-8b),1.61(1H,m,H-9),3.78(1H,d,J=11.9 Hz,H-11a),3.71(1H,d,J=11.9 Hz,H-11b),1.44(3H,s,H-12),5.01(1H,s,H-13),2.98(1H,s,13-OH),1.69(3H,s,H-14),0.88(3H,s,H-15),2.04(3H,s,1-O-CO-CH3),2.16(3H,s,7-O-CO-CH3),2.09(3H,s,11-O-CO-CH3),6.46(1H,m,5'-H),9.00(1H,s,2″-H),8.09(1H,ddd,J=8.0,2.4,1.8 Hz,4″-H),7.40(1H,dd,J=8.0,4.8 Hz,5″-H),8.68(1H,d,J=2.4 Hz,6″-H);13C NMR(100 MHz,CDCl3)δC:73.6(C-1),22.7(C-2),36.1(C-3),37.8(C-4),54.7(C-5),83.2(C-6),77.7(C-7),25.2(C-8),45.3(C-9),40.3(C-10),64.8(C-11),17.4(C-12),60.2(C-13),16.2(C-14),13.2(C-15),21.1(1-O-CO-CH3),170.6(1-O-CO-CH3),21.2(7-OCO-CH3),170.1(7-O-CO-CH3),20.8(11-O-COCH3),171.0(11-O-CO-CH3),164.0(C-2'),102.9(C-3'),162.2(C-4'),99.4(C-5'),157.3(C-6'),146.8(C-2″),127.1(C-3″),133.0(C-4″),123.6(C-5″),151.5(C-6″)。以上波谱数据与文献报道的pyripyropene A一致[9],因此鉴定化合物 1为pyripyropene A。
化合物2:白色固体(CHCl3-CH3OH);ESI-MS m/z:[M+Na]+534,[2M+Na]+1045,显示分子量为511;1H NMR(400 MHz,CDCl3)δH:7.99(1H,d,J=8.0 Hz,H-4),6.82(1H,dd,J=8.0,2.0 Hz,H-5),6.63(1H,d,J=8.0 Hz,H-23),6.58(1H,d,J=2.0 Hz,H-7),6.04(1H,d,J=6.4 Hz,H-18),5.65(1H,d,J=1.0 Hz,H-8),5.03(1H,m,H-24),4.74(1H,d,J=1.6 Hz,8-OH),4.45(1H,m,H-12),4.04(1H,s,9-OH),3.84(3H,s,6-OCH3),3.63(2H,m,H-15),2.50(1H,m,H-13a),2.09(2H,m,H-13b,14a),2.00(1H,m,H-19a),2.00(3H,s,H-21),1.97(1H,m,H-14b),1.73(3H,s,H-26),1.66(1H,m,H-19b),1.71(1H,m,H-27),0.99(3H,s,H-22);13C NMR(100 MHz,CDCl3)δc:131.6(C-2),105.5(C-3),120.9(C-3a),121.6(C-4),109.4(C-5),156.3(C-6),93.9(C-7),136.2(C-7a),68.9(C-8),82.5(C-9),166.2(C-11),58.7(C-12),29.1(C-13),22.6(C-14),51.1(C-15),170.7(C-17),48.9(C-18),45.4(C-19),82.2(C-20),25.7(C-21),27.1(C-22),85.8(C-23),118.4(C-24),143.2(C-25),18.9(C-26),24.2(C-27),55.8(6-OCH3)。以上波谱数据与文献报道的verruculogen一致[6],因此鉴定化合物2为verruculogen。
化合物3:白色油状液体(CHCl3-CH3OH);ESIMS m/z:[M+H]+367,显示分子量为366;1H NMR(400 MHz,CDCl3)δH:8.56(1H,s,N-H,indole),7.06(1H,d,J=8.0 Hz,H-7),6.99(1H,t,J=8.0,8.0 Hz,H-5),6.65(1H,d,J=8.0 Hz,H-6),6.06(1H,m,H-15),5.62(1H,s,H-21a),5.04(1H,s,H-21b),5.07(1H,t,J=5.6,0.8 Hz,H-20),3.86(1H,br s,H-14),3.36(1H,s,H-13),2.58(4H,m,H-9,12),2.41(3H,s,11-N-CH3),1.85(3H,s,CH3CO),1.48(6H,s,17,18-CH3),1.30(3H,d,J=7.2 Hz,14-CH3);13C NMR(100 MHz,CDCl3)δC:132.4(C-1),105.4(C-2),127.8(C-3),128.5(C-4),112.3(C-5),121.9(C-6),107.9(C-7),137.1(C-8),27.7(C-9),61.6(C-10),43.4(C-11),57.9(C-12),33.0(C-13),16.4(C-14),71.4(C-15),39.1(C-16),27.2(C-17),27.3(C-18),39.1(C-19),145.8(C-20),111.4(C-21),171.4(15-O-CO-CH3),21.0(15-O-COCH3)。以上波谱数据与文献报道的fumigaclavine C一致[10],因此鉴定化合物3为fumigaclavine C。
化合物4:白色固体(CHCl3-CH3OH);1H NMR(600 MHz,CDCl3)δH:8.27(1H,dd,J=6.6,1.2 Hz,H-10),8.08(1H,s,H-19),7.72(1H,d,J=7.2 Hz,H-8),7.62(1H,d,J=7.8 Hz,H-7),7.47(1H,d,J=8.4 Hz,H-9),7.42(1H,d,J=8.4 Hz,H-24),7.34(1H,d,J=8.4 Hz,H-2),7.20(1H,d,J=6.0 Hz,H-21),7.10(1H,d,J=7.2 Hz,H-22),6.77(1H,s,H-23),6.10(1H,d,J=1.8 Hz,H-14),3.57(1H,d,J=1.4 Hz,H-15a),3.55(1H,d,J=1.4 Hz,H-15b),2.27(3H,s,CH3-16);13C NMR(150 MHz,CDCl3)δC:170.0(C-1),160.3(C-12),153.1(C-4),147.0(C-6),134.8(C-18,C-20),134.6(C-8),128.0(C-25),127.7(C-7,C-9),127.6 (C-10),123.7(C-22),120.9(C-11),120.8(C-23),118.6(C-24),111.4(C-21),108.0(C-17),54.9(C-3),54.7(C-14),26.2(C-15),18.4(C-16)。以上波谱数据与文献报道的 fumiquinazoline J一致[5,11],因此鉴定化合物4 为 fumiquinazoline J。
4 讨论
从当前的研究来看,本论文报道的四个生物碱结构特异且均具有较强的生物活性,但化合物1~3通过钙流模型评价其生物活性的测试结果却显示它们均无促进钙离子细胞内流的活性。
虽然白三叶草植物内生真菌烟曲霉的发酵乙酸乙酯提取物显示具有抑制白菜种子发芽的活性,但分离得的四个生物碱的量少,未能进一步评价其是否就是其化感作用的活性物质,以及能否抑制紫茎泽兰的生长,这些工作拟将在以后的工作中继续开展。
1 Ross SM,King JR,Cesar Izaurralde R,et al.Weed suppression by seven clover species.Agron J,2001,93:820-827.
2 Zhang XF(张晓芳),Wang JX(王金信),Xie N(谢娜),et al.Allelopathic effects of Trifolium repens volatile and its chemical components.Acta Phytophy Sin(植物保护学报),2011,38:374-378.
3 Wang LH(王莉衡).Research advance on plant endophyte.Chem Bioeng(化学与生物工程),2011,28(3):5-7.
4 Wang SL,Chen YH,Wang CL,et al.Purification and characterization of a serine protease extracellularly produced by Aspergillus fumigatus in a shrimp and crab shell powder medium.Enzyme Microb Technol,2005,36:660-665.
5 Han XX(韩小贤),Xu XY(许晓妍),Cui CB(崔承彬),et al.Alkaloidal compounds produced by a marine-derived fungus,Aspergillus fumigatus H1-04,and their antitumor activities.Chin J Med Chem(中国药物化学杂志),2007,14:232-237.
6 Zhou F(周凤),Zhang HC(张弘弛),Liu R(刘瑞),et al.I-solation and biological evaluation of secondary metabolites of endophytic fungus Aspergillus sp.from Astragalus membranaceus.Chin J Exp Tradit Med Form(中国实验方剂学杂志),2012,18:125-128.
7 Jens CF,Christian R,Kristian FN,et al.Metabolomics of Aspergillus fumigatus.Med Mycol,2009,47:S53-S71.
8 Tomoda H,Kim YK,Nishida H,et al.Pyripyropenes,novel inhibitors of Acyl-CoA:cholesterol acyltransferase produced by aspergillus fumigatus I.production,isolation,and biological properties.J Antibiot,1994,47:148-153.
9 Kim YK,Tomoda H,Nishida H,et al.Pyripyroenes,novel inhibitors of Acyl-CoA:cholesterol acyltransferase produced by aspergillus fumigatus II.structure elucidation of pyripyropenes A,B,C,D.J Antibiot,1994,47:154-162.
10 Cole RJ,Kirksey J,Dorner JW,et al.Mycotoxins produced by Aspergillus fumigatus species isolated from molded silage.J Agric Food Chem,1977,25:826-830.
11 Zhang LM(张丽敏),Li ZL(李占林),Bai J(白皎),et al.Metabolites of Aspergillus sp.HT-2.Chin Pharm J(中国药学杂志),2011,46:1154-1158.
