采用磁微粒分离酶联免疫法构建基于KGN细胞的雌激素生物合成筛选模型
2013-09-11鲁丹枫AzimovaBahtigulJovliqizi张国林
鲁丹枫,Azimova Bahtigul Jovliqizi,张国林,王 飞*
1中国科学院成都生物研究所,成都 610041;2中国科学院研究生院,北京 100049;3乌兹别克斯坦科学院生物化学研究所,塔什干 10012,乌兹别克斯坦
雌激素是人体内一种重要的内源性物质,介导了许多重要的生理功能。雌激素主要有三类,活性最高的是雌二醇(17β-estradiol,E2),其次是雌酮(estrone,E1),活性最低的为雌三醇(estriol,E3),其生物学效应主要通过与雌激素受体(estrogen receptor α/β)相结合,激活其转录或非转录活性,在生殖、免疫、骨骼、心血管和中枢神经统中发挥重要作用。雌激素缺乏常导致骨质疏松、冠心病、阿尔茨海默症、肥胖等常见疾病,而雌激素相对过量则是诸多肿瘤(如乳腺癌)发生、发展、转移等的直接原因[1]。生物体内,胆固醇通过一系列酶促反应合成雌激素,其限速步骤是由芳香化酶催化雄激素底物转化为雌激素。芳香化酶在卵巢、脂肪组织及骨骼中均有表达,但在不同组织中使用不同启动子,其调控机制也不一样[2]。
在我国,随着社会、经济的发展,近十年来,许多老年性疾病(如心脑血管疾病、骨质疏松症及乳腺癌)的发病率、死亡率和危险因素呈直线上升趋势。例如,由骨质疏松症导致的脊柱或胯骨骨折是老年人发病和死亡的一个主要原因[3]。乳腺癌已经是患病率最高的妇女恶性肿瘤,严重影响绝经后妇女的生活质量[4]。这些疾病的发生都与雌激素在机体内的合成代谢紊乱和/或其介导的信号途径失调有关,因此发现新的雌激素合成调节剂对于这些重大疾病的治疗具有重要意义。但目前受限于小分子化合物的检测方法,针对雌激素合成的化合物筛选进展缓慢,严重限制了具有组织特异性的雌激素合成调节剂的发现。对于雌二醇的检测分析,国内外学者进行了大量研究工作,建立了诸如TLC、GC/MS、HPLC等理化分析方法[5]。但这些方法操作比较繁琐,不适用于大量样本的筛选工作[6]。目前常用方法是以同位素标记的睾酮或雄烯二酮为底物,使用人胎盘微粒体或人重组芳香化酶蛋白[7],或使用哺乳动物细胞系(如表达芳香化酶的人JEG-3或JAr细胞系),通过测量3H-水释放量,从而确定芳香化酶活性[8]。同位素方法的优点是所测结果可靠,检测灵敏度高;缺点是操作复杂,需要专门的实验设备和条件,成本高,难以做到高通量筛选。人卵巢颗粒细胞KGN细胞被发现表达较高水平的芳香化酶,由于缺乏17α-羟化酶,其本身并不产生睾酮或雌激素,且促卵泡激素(FSH)和福斯克林(Forskolin)可显著促进细胞内芳香化酶表达,是进行雌激素合成研究的良好细胞[9,10]。采用非放射性雌激素ELISA方法,能有效地检测出KGN细胞芳香化酶活性变化[9,10],具有快速、简便、灵敏、经济的特点,适合大批量样品检测[11]。但这种基于聚苯乙烯基质的酶联免疫法的抗体与聚苯乙烯材料是疏水性非特异性结合的,导致检测灵敏度低,重复性不好。而磁微粒分离酶联免疫法具有很多优点,例如磁微粒尺寸小、表面积大,共价交联结合抗体,增加了抗原-抗体反应的效率,降低非特异性结合,检测更快速,更精确[12,13]。
虽然磁微粒分离免疫法已用于检测环境污染物中的雌激素[14,15],但该方法在基于细胞的雌激素活性评价和筛选方面的应用尚有待进一步研究。本研究通过比较传统的聚苯乙烯酶联免疫法和磁微粒分离酶联免疫法的检测灵敏度和特异性差异,确定KGN细胞系的培养条件、底物睾酮处理浓度等因素,构建雌激素活性检测的筛选模型。
1 材料和方法
1.1 材料
睾酮(T)、福美司坦(FOR)及福斯克林(FSK)买自 sigma化学公司(St.Louis,MO)。睾酮、福美司坦及福斯克林用DMSO溶解稀释,配成终浓度为100 mmol/L的原始溶液,存放在-20℃。化合物溶液用DMSO依次梯度稀释10倍。DMSO在培养基中的最终浓度为0.1%(v/v)。新生小牛血清、胎牛血清及活性炭/葡聚糖处理去除内源性激素的新生小牛血清买自 GIBCO公司。有、无酚红的DMEM/F-12培养基买自Invitrogen公司。青链霉素、PBS及含EDTA的胰酶买自成都哈里生物公司。BCA蛋白检测试剂盒买自上海Bestbio公司。
1.2 试剂盒
基于磁微粒分离酶联免疫法的Ekozyme人雌二醇ELISA诊断试剂盒,北京,倍爱康生物技术有限公司。基于聚苯乙烯基质酶联免疫法的Cussabio人雌二醇ELISA试剂盒,武汉,华美生物技术有限公司。
1.3 细胞培养
KGN细胞系(解放军总医院,母义明教授提供,中国北京)在补充有5%(v/v)胎牛血清(GIBCO,Invitrogen),青霉素(100单位/mL)及链霉素(0.1 g/L)的 DMEM/F-12 培养基(Invitrogen,Carlsbad,CA),37℃,5%CO2的细胞培养箱中培养。
1.4 方法
1.4.1 芳香化酶活性检测
根据文献[10]并作适当修改,3×104KGN细胞/ml接种在24孔组织培养板中培养24 h。培养基更换成不含血清的、DMEM/F-12培养基,加入不同浓度测试化合物,培养24 h。加入底物睾酮,继续培养24 h。吸取培养基及去除培养基后裂解细胞所得溶液存于-20℃。培养基13000 rpm,离心1 min,使培养基中细胞碎片等沉淀,获得培养基上清液。用雌二醇检测试剂盒定量培养基上清液中雌二醇量。所得结果经蛋白校正,表示为对照DMSO的百分数。用BCA蛋白检测试剂盒定量裂解细胞所得溶液的蛋白含量。
1.4.2 检测方法
按各种试剂盒的使用说明书进行操作。用Thermo Scientific Verioskan Flash多功能读数仪检测吸光度。
2 结果与讨论
2.1 聚苯乙烯酶联免疫法与磁微粒分离酶联免疫法的底物特异性研究
以KGN细胞系为研究对象检测雌二醇合成变化需要以睾酮为底物,而睾酮的化学结构与雌二醇的化学结构具有较高的相似性。因此,为了研究聚苯乙烯酶联免疫法与磁微粒分离酶联免疫法在雌二醇检测中的特异性,我们检测了这两种试剂盒与底物睾酮的交叉反应。表1表明,这两种酶联免疫法的交叉反应都较低,睾酮几乎不影响雌二醇检测。即,基于聚苯乙烯酶联免疫法的ELISA试剂盒与基于磁微粒分离酶联免疫法的ELISA试剂盒的特异性都较高。
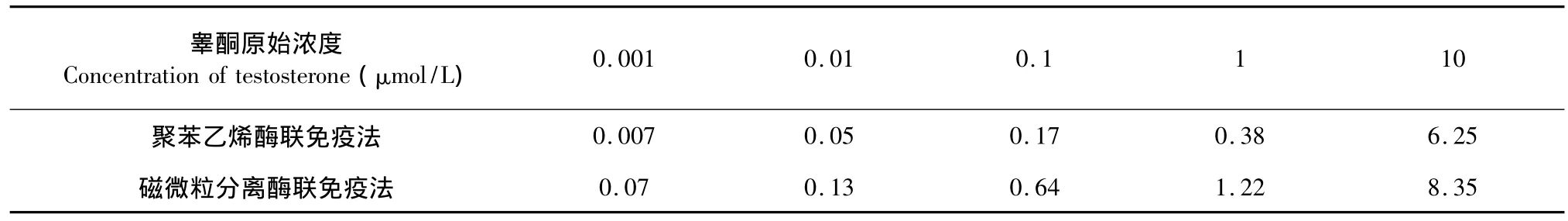
表1 雌二醇检测法的交叉反应率Table 1 The cross-reactivity of polystyrene-and magnetic particle-based 17β-estradiol assay methods(%)
2.2 聚苯乙烯酶联免疫法与磁微粒分离酶联免疫法的灵敏度研究
为了确定聚苯乙烯酶联免疫法与磁微粒分离酶联免疫法雌二醇检测灵敏度,使用这两种ELISA检测方法检测DMSO、10 μmol/L福斯克林及50 μmol/L福美司坦处理KGN细胞系后芳香化酶活性变化情况[16-18]。图1表明,同种处理条件,磁微粒分离酶联免疫法检测到更高的雌二醇量,芳香化酶活性变化更显著。上述结果表明,与传统的聚苯乙烯酶联免疫法相比,磁微粒分离酶联免疫法灵敏度更高,更适合于雌二醇检测。

图1 雌二醇检测方法比较Fig.1 The sensitivity comparison of polystyrene-and magnetic particle-based 17β-estradiol assay methods
2.3 酚红对雌二醇检测的影响
培养基所含的酚红用于指示培养基中CO2浓度变化,其颜色是粉红色。为了确定酚红颜色对检测结果的影响,我们用聚苯乙烯酶联免疫法(OD450)和磁微粒分离酶联免疫法(OD550)测量PBS溶液及酚红溶液的吸光度值,图2表明,两种雌二醇检测方法中,酚红溶液在检测波长处的吸光度值都显著大于PBS在对应波长处的吸光度值。上述结果表明,由于酚红颜色干扰,导致检测结果比真实结果更大。因此,应用不含酚红的DMEM/F-12培养基接种KGN细胞系。

图2 酚红对雌二醇检测结果的影响Fig.2 The effect of phenol red in the culture medium on quantification of 17β-estradiol in polystyrene-and magnetic particle-based 17β-estradiol assay methods
2.4 最适睾酮处理终浓度的研究
为了优化检测体系的灵敏度,我们用基于磁微粒分离酶联免疫法的ELISA试剂盒检测底物睾酮与产物雌二醇间的浓度关系。图3表明,当底物睾酮终浓度为10 nmol/L时,与DMSO相比,50 μmol/L福美司坦抑制了22%的芳香化酶活性,而10 μmol/L福斯克林增加了300%的雌二醇量。而其它睾酮处理浓度条件下,福斯克林或福美司坦激活或抑制芳香化酶活性的能力不显著。这可能因为,基于磁微粒分离酶联免疫法的雌二醇ELISA试剂盒测量范围为0~11 nmol/L,底物睾酮处理终浓度过大,造成培养基中雌二醇量超过该方法的检测极限。上述结果表明,底物睾酮处理终浓度为10 nmol/L时,基于磁微粒分离酶联免疫法的ELISA试剂盒具有最佳检测灵敏度。

图3 睾酮浓度对雌二醇合成检测结果的影响Fig.3 The effect of testosterone concentration on quantification of 17β-estradiol in magnetic particle-based 17βestradiol assay methods
2.5 筛选模型有效性研究
为了确定基于磁微粒分离酶联免疫法的检测体系有效性,我们检测底物睾酮终浓度为10 nmol/L时,不同浓度芳香化酶抑制剂及激动剂对KGN细胞系雌激素合成的影响。如图4所示,与不加底物睾酮相比,加入睾酮使培养基中雌二醇量增加了9倍,表明KGN细胞系有内源性芳香化酶蛋白表达。与加入睾酮处理的相比,加入不同浓度(1-10 μmol/L)阳性对照福斯克林,培养基中雌二醇生成量以浓度依赖方式增加,其中10 μmol/L福斯克林诱导培养基中雌二醇量增加了4.2倍左右。加入不同浓度(1~50 μmol/L)芳香化酶抑制剂福美司坦,雌二醇合成量以浓度依赖方式被抑制,其中50 μmol/L福美司坦抑制了30%左右的雌二醇合成量。以上结果表明我们成功建立雌激素筛选模型,可用于筛选雌激素合成调节剂。
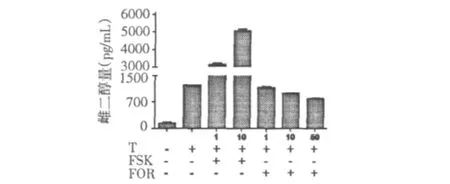
图4 KGN细胞系筛选模型有效性验证Fig.4 The validation of the screen platform in human KGN cells
3 结论
通过比较传统基于聚苯乙烯基质的酶联免疫法及磁微粒分离酶联免疫法的检测特异性及灵敏度,我们发现,虽然聚苯乙烯酶联免疫法与磁微粒分离酶联免疫法的检测特异性差别不大,但磁微粒分离酶联免疫法的灵敏度更高,更适合于雌二醇检测。通过进行酚红对检测结果影响及底物睾酮处理终浓度的研究发现,酚红颜色干扰导致磁微粒分离酶联免疫法的检测结果变大,磁微粒分离酶联免疫法的最适底物睾酮处理终浓度为10 nmol/L。通过检测筛选模型有效性确定所构建的雌激素筛选模型,即在24孔组织培养板中,使用不含酚红、含5%活性炭/葡聚糖处理去除内源性激素的新生小牛血清的DMEM/F-12培养基接种3×104KGN细胞/ml,培养24 h。加测试物处理KGN细胞系前,培养基更换成不含酚红、不含血清的DMEM/F-12培养基;24小时后,加入终浓度为10 nmol/L底物睾酮,继续培养24 h,用基于磁微粒分离酶联免疫法的雌二醇ELISA试剂盒检测培养基中雌二醇量。所建立的筛选模型避免采用放射性底物,环境友好,成本较低,适用于基于细胞的雌激素生物合成活性评价和高通量筛选,对筛选和发现具有组织特异性的雌激素合成调节剂具有重要意义。
1 Simpson ER,Misso M,Hewitt KN,et al.Estrogen-the good,the bad,and the unexpected.Endocrine Reviews,2005,26:322-330.
2 Timm GE.Final detailed review paper on aromatase.EPA,2005:1-93.
3 Nawata H,Tanaka S,Takayanagi R,et al.Aromatase in bone cell:association with osteoporosis in postmenopausal women.J Steroid Biochem mol biol,2005,53:165-174.
4 Yager JD,Davidson NE.Estrogen carcinogenesis in breast cancer.N Engl J Med,2006,354:270-282.
5 Sawaya NW,Lone KP,Husain A,et al.Screening for estrogenic steroids in sheep and chicken by the application of enzyme-linked immunosorbent assay and a comparison with analysis bygaschromatography-massspectrometry.Food Chemistry,1998,63:563-569.
6 Singh P,Ram BP,Sharkov N.Enzyme-immunoassay for screening of sulfamethazine in swine.Journal of Agricultural and Food Chemistry,1989,37:109-114.
7 Njar VCO,Grun G,Hartmann RW.Evaluation of 6,7-aziridinyl steroids and related compounds as inhibitors of aromatase(P-450arom).J Enzyme Inhibition,1995,9:195-202.
8 Lephart ED,Simpson ER.Assay of aromatase activity.Methods in Enzymology,1991,206:477-483.
9 Nishi Y,Yanase T,Mu YM,et al.Establishment and characterization of a steroidogenic human granulosa-like tumor cell line,KGN,that expresses functional follicle-stimulating hormone receptor.Endocrinology,2001,142:437-445.
10 Ohno K,Araki N,Yanase T,et al.A novel nonradioactive method for measuring aromatase activity using a human ovarian granulosa-like tumor cell line and an estrone ELISA.Toxicol Sci,2004,82:443-450.
11 Sheth HB,Sporns P.Development of a single ELISA for detection of sulfonamides.J Agric Food Chem,1991,39:1696-1700.
12 Foti AG,Herschman H,Cooper JF.A solid-phase radioimmunoassay for human prostatic acid phosphatase.Cancer Res,1975,35:2446-2452.
13 Kala M,Bajaj K,Sinha S.Magnetic bead enzyme-linked immunosorbent assay(ELISA)detects antigen-specific binding by phage-displayed scFv antibodies that are not detected with conventional ELISA.Anal Biochem,1997,254:263-266.
14 Tanaka T,Takeda H,Ueki F,et al.Rapid and sensitive detection of 17β-estradiol in environmental water using automated immunoassay system with bacterial magnetic particles.J Biotech,2004,108:153-159.
15 Shelver WL,Parrotta CD,Slawecki R,et al.Development of a magnetic particle immunoassay for polybrominated diphenyl ethers and application to environmental and food matrices.Chemosphere,2008,73:18-23.
16 Sanderson JT,Hoedijk J,et al.Induction and inhibition of aromatase(CYP19)activity by natural and synthetic flavonoid compounds in H295R human adrenocortical carcinoma cells.Toxicol Sci,2004,82:70-79.
17 Canton RF,Sanderson JT,Letcher RJ,et al.Inhibition and induction of aromatase(CYP19)activity by brominated flame retardants in H295R human adrenocortical carcinoma cells.Toxicol Sci,,2005,88:447-455.
18 Brooks JD,Thompson LU.Mammalian lignans and genistein decrease the activities of aromatase and 17β-hydroxysteroid dehydrogenase in MCF-7 cells.J Steroid Biochem Mol Biol,,2005,94:461-467.
