五种昆虫可溶性海藻糖酶活性比较
2013-09-11于彩虹林荣华王文涛
于彩虹, 黄 莹, 林荣华, 姜 辉, 王文涛, 裴 力
(1.中国矿业大学 (北京)化学与环境工程学院,北京 100083;2.农业部农药检定所环境室,北京 100125)
海藻糖(α-D-吡喃葡糖基-α-D-吡喃葡萄糖苷),由两分子葡萄糖依靠α-1,1糖苷键连接形成的二糖,不同于哺乳动物中的葡萄糖和植物中的蔗糖,它是所有昆虫的主要血糖,是主要的产能物质和大分子合成基础[1-2]。由于海藻糖不能跨膜运输,因此被细胞利用前必须要先转化为葡萄糖[2]。海藻糖水解酶,又称海藻糖酶,国际酶学编号为(EC 3.2.1.28),是昆虫当中存在的唯一能够水解1分子海藻糖为2分子葡萄糖的酶类,而葡萄糖最终作为昆虫细胞进行糖酵解的原料。在昆虫中,利用糖作为能量的来源(如飞行或渗透调节)都是由海藻糖酶来调控的。除此之外,海藻糖酶对海藻糖的代谢与昆虫的越冬、滞育、几丁质的合成以及物种的扩张和竞争适应都有作用[3-6]。本研究选取国内外没有研究的我国农业生产上5种重要害虫:亚洲玉米螟[Ostrinia furnacalis (Guenée)]、黏 虫 [Mythimna separata(Walker)]、棉 铃 虫 [Helicoverpa armigera(Hübner)]、小菜蛾[Plutella xylostella (Linnae-us 和甜菜夜蛾[Spodoptera exiguaHübner 为对象,比较研究了不同发育期的幼虫以及5龄幼虫不同组织部位中可溶性海藻糖酶的活性和分布情况,为进一步的研究奠定基础。
1 材料与方法
1.1 材料
供试昆虫:黏虫在室温(23±1)℃,相对湿度70%~80%,光周期L∥D=16h∥8h条件下采用新鲜玉米苗饲养。小菜蛾室内饲养采用蛭石萝卜苗法。棉铃虫、亚洲玉米螟和甜菜夜蛾均为室内人工饲料饲养。棉铃虫在温度(26±1)℃,相对湿度70%~80%,光照L∥D=16h∥8h完全人工饲料连续饲养[7-11]。
试剂:苯基硫脲(PTU)、牛血清白蛋白、考马斯亮蓝G-250、柠檬酸购自Sigma公司,葡萄糖测定试剂盒——GLU(液体试剂)从北京利德曼生化技术公司购得,海藻糖及其他常规化学试剂购自北京市化学试剂公司。
1.2 方法
1.2.1 幼虫不同组织的分离
血淋巴的提取:将幼虫先用水冲洗并用滤纸吸净,再将其放在冰上冰冻15min以麻醉昆虫,末端体节切开小口,用10μL移液枪的干净枪头挤压昆虫,将血淋巴吸到装有10μL饱和苯基硫脲(PTU)5mmol/L溶液中,防止血淋巴变黑。血淋巴在4℃下,9000×g离心10min,则海藻糖酶主要存在于上清液中[12-13]。
其他组织的分离:将幼虫置于冰盘上固定后,用解剖剪将其从腹部末端向前剖开,先用小型消毒镊子直接将马氏管取出,放到预冷的装有缓冲液的离心管中,置于超低温冰箱中备用;分离肠道时先将整个肠道全部取出,将肠道内的由围食膜包裹的食物剔除,分别取出前肠、后肠和中肠部分放到预冷的1.15%的KCl溶液中漂洗和透析,以除去其中从食物中摄入的过量蔗糖。透析一段时间再将前、中、后肠取出放到装有预冷缓冲液的离心管中,置于超低温冰箱中备用;将解剖后,去除以上3个部分后的幼虫,置于冰盘上,用消毒的解剖刀轻轻刮下体壁附着及游离的白色脂肪,将其放到装有预冷的缓冲液的离心管中,置于超低温冰箱中备用;以上四步完成后,用解剖刀进一步刮除残留的脂肪等物,用镊子将体壁于定性滤纸上搓揉,以彻底去除脂肪等残余物。最后将干净的体壁放到预冷的离心管中,置于超低温冰箱中备用。
1.2.2 海藻糖酶液的制备
昆虫卵、1龄、2龄、3龄、4龄幼虫直接从冰箱取出融化后,先用预冷的125mmol/L NaCl溶液洗净,并用滤纸吸干。加入一定体积的缓冲液于组织匀浆器中匀浆后,在4℃下10800×g离心30min,取上清液备用。
5龄幼虫的中肠组织、马氏管、脂肪体和体壁用预冷的缓冲液在组织匀浆器中匀浆,反复冻融3次,在4℃下10800×g离心30min,取上清液备用。血淋巴在4℃下9000×g离心10min,取上清液备用。以上两步所制酶液用0.45nm滤纸过滤去除杂蛋白和脂肪等杂质,整个过程全部在低温条件下进行。特别注意匀浆时要根据海藻糖酶的含量加入一定体积的缓冲液。
1.2.3 海藻糖酶活性的测定
海藻糖酶活性的测定参考Dahlqvist的葡萄糖氧化酶终点法[14],通过生成葡萄糖的量来进行测定,并加以改进。反应介质为pH6.0的25mmol/L磷酸氢二钠-柠檬酸缓冲液,其中含有7mmol/L的海藻糖以及60μmol/L的MnCl2。反应在30℃下水浴加热20min,反应完成后立即放入沸水浴中热变性处理5min。然后立即放入冰里防止蛋白质的重新折叠。反应产物100μL转入500μL离心管中,4℃,8700×g离心15min,取上清液2μL,加入200μL葡萄氧化酶测定试剂,37℃水浴加热10min。用紫外分光光度计,在542nm下测定样品的A值,吸光值的大小反映葡萄糖的含量,根据葡萄糖试剂盒中葡萄糖的含量5.55μmol/mL,来计算样品中葡萄糖的含量。海藻糖酶的活力以国际单位U为单位,即在最适条件下,每分钟将1μmol底物转化为产物所需要的酶量为1U,单位为mU/mg。计算公式为:酶的活 力 U =A×5.55mmol/mL×V(酶+底物)/T(min);蛋白含量=C蛋白×稀释倍数×酶液体积;酶的比活力=U/蛋白含量。
1.2.4 蛋白质含量的测定
参照Bradford[15]考马斯亮蓝G250法,用牛血清白蛋白(BSA)制作蛋白质标准曲线并测定样品A值,根据蛋白质标准曲线计算样品中蛋白的含量。
1.2.5 数据分析
对于加入不同发育阶段、不同组织中各种昆虫间可溶性海藻糖酶活性的差异,进行显著性检验,对方差分析显著的数据进一步采用LSD进行多重比较,检验不同酶活性间的差异。所有数据均用SPSS 12.0分析。
2 结果与分析
2.1 昆虫不同发育阶段海藻糖酶活性比较
图1为5种昆虫在不同发育阶段海藻糖酶活性比较,除玉米螟卵中海藻糖酶活性接近于2龄幼虫中的活性以外,棉铃虫、甜菜夜蛾以及黏虫3种虫卵的活性是本试验各个测定阶段活性最低的,其中小菜蛾因为采用萝卜苗方法饲养,卵块难以收集,因此活性未测定。玉米螟、甜菜夜蛾和黏虫幼虫从低龄到高龄呈现海藻糖酶活性增加的趋势,其中玉米螟卵、1龄幼虫、2龄幼虫的活性分别为29.25、19.76、25.35mU/mg无显著差异,随后活性出现骤增,在3龄、4龄幼虫阶段活性分别为79.64、124.07mU/mg,显著高于前阶段(P<0.05);甜菜夜蛾1~3龄活性相差不大,均为50mU/mg左右,在4龄海藻糖酶活性骤增,活性为158.43mU/mg,显著高于前阶段(P<0.05);黏虫活性最高为3龄幼虫,达到54.49mU/mg。棉铃虫和小菜蛾各龄期海藻糖酶活性变化规律不明显,棉铃虫1~4龄活性分别为26.34、32.20、14.2和40.87mU/mg,小菜蛾1~4龄幼虫活性分别为50.72、53.48、40.56和55.76mU/mg。另外,本试验测定的5种昆虫,蛹期海藻糖酶的活性均低于4龄幼虫。

图1 五种昆虫不同发育阶段海藻糖酶活性比较Fig.1 The activities of soluble trehalase in five insects in different developmental stages
2.2 昆虫5龄幼虫不同组织部位海藻糖酶活性比较
图2为玉米螟、黏虫、棉铃虫和甜菜夜蛾4种昆虫马氏管、脂肪体、体壁、血淋巴和中肠等组织部位海藻糖酶的活性,小菜蛾其成虫由于个体过小,没有进行解剖。数据表明,玉米螟5龄幼虫中肠、体壁、马氏管、脂肪体和血淋巴分别为316.17、121.25、20.78、13.86和58.86mU/mg,中肠中海藻糖酶活性显著高于其他组织(P<0.05);与玉米螟相似,棉铃虫中肠酶活性最高,为39.35mU/mg,显著高于体壁(6.01mUmg 马氏管(19.69mUmg 脂肪体(4.33mU/mg)和血淋巴(2.94mU/mg);甜菜夜蛾5龄幼虫中肠、体壁、马氏管、脂肪体和血淋巴中海藻糖酶活性分别为107.27、139.99、109.05、13.74和0.85mU/mg,中肠、体壁和马氏管中活性最高;黏虫分别为1.33、4.36、4.69、11.19和0.11mU/mg。但黏虫的脂肪体中海藻糖酶活性最高。不同昆虫间海藻糖酶的活性差异较大,玉米螟和甜菜夜蛾各组织的海藻糖酶活性较高,而黏虫总体酶活性较低。
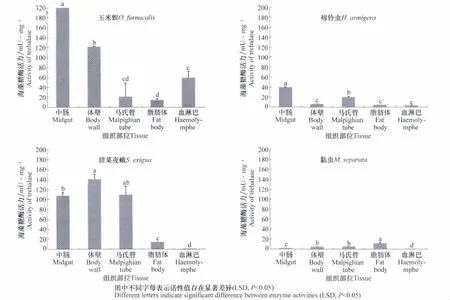
图2 四种昆虫不同组织部位海藻糖酶活性比较Fig.2 The activities of soluble trehalase in four insects in different tissues
3 讨论
在昆虫体内,海藻糖酶将海藻糖水解为葡萄糖,而葡萄糖最终被氧化分解,海藻糖酶活性的改变与昆虫生理学条件和变化时期密切相关[2]。家蚕中肠中的海藻糖酶活性在吐丝时开始升高,在幼虫化蛹蜕皮时突然增长,并在3d后达到很高水平,这样的高水平一直保持到随后的成虫发育阶段[16]。本研究所选用的5种农业生产上的重要害虫均为实验室饲养的标准试虫,其中黏虫和小菜蛾幼虫的食物为植物,其他3种昆虫的饲料为人工饲料。研究结果表明,除小菜蛾卵没有测定外,其他4种昆虫卵的活性最低,其次为蛹,进入取食阶段后部分幼虫随着龄期的增加,其体内海藻糖酶的活性有增高的趋势,这可能是由于其自身对于能量的需求增加,而海藻糖酶作为唯一能水解昆虫的主要血糖——海藻糖的水解酶类,对于调节昆虫的能量代谢起着至关重要的作用。进入化蛹期后,消化和吸收活性基本停止,取而代之的是排泄活性,因此海藻糖酶的活性比较低。以往研究表明Rhynchosciara americana在饥饿的状态其中肠内海藻糖酶的活性会降低,随着取食的增加海藻糖酶的活性也会增加[17]。
昆虫中几乎所有的组织内都有海藻糖酶[13]。在生活周期的不同阶段昆虫各组织中海藻糖酶有不同的表达水平,其中许多昆虫中肠和肌肉中活性较高[18]。在家蚕从幼虫到蛹和成虫的发育过程中,中肠中海藻糖酶的表达水平最高,其他组织中的表达水平相对较低[19]。因为幼虫阶段中肠部位是消化和吸收活性最强的部位,所以中肠组织中的海藻糖酶显示出相对较高的活性也就不足为怪了。在本研究中,小菜蛾因为个体比较小,没有进行解剖。测定玉米螟、黏虫、棉铃虫和甜菜夜蛾5龄幼虫不同组织部位海藻糖酶的活性研究表明,中肠中海藻糖酶的活性比较高,与文献研究结果一致。但不同昆虫之间中肠海藻糖酶活性差异相当大,本研究中玉米螟中肠中海藻糖酶的活性为316mU/mg,而黏虫中仅为1.336mU/mg,相差高达200多倍,以往文献中一种贪夜蛾Spodoptera frugiperda中肠海藻糖酶的活性是家蝇(Musca domestica)的约900倍[13],这可能是由于昆虫之间食物的差异以及自身代谢的差异引起的,因此,在以后的研究中可以根据自身需要选择海藻糖酶含量丰富的昆虫及组织部位。
随着人们对于昆虫中海藻糖和海藻糖酶生理功能的进一步认识,认识到海藻糖酶对于昆虫的代谢起着至关重要的作用,因此可以海藻糖酶作为害虫防治的重要靶标。昆虫中海藻糖酶的研究将越来越受到人们的重视,本文通过测定我国农业生产上重要的5种害虫海藻糖酶的活性以期对我国开展海藻糖酶方面的研究提供基础数据。
[1] Thompson S N.Trehalose-the insect‘blood’sugar[J].Advances in Insect Physiology,2003,31:203-285.
[2] Tatun N,Singtripop T,Tungjitwitayakul J,et al.Regulation of soluble and membrane-bound trehalase activity and expression of the enzyme in the larval midgut of the bamboo borer Omphisa fuscidentalis[J].Insect Biochemistry and Molecular Biology,2008,38(8):788-795.
[3] 于彩虹,卢丹,林荣华,等.海藻糖——昆虫的血糖[J].昆虫知识,2009,45(5):832-837.
[4] 雷芳,张桂芬,万方浩,等.寄主转换对B型烟粉虱和温室粉虱海藻糖含量和活性的影响[J].中国农业科学,2006,39(7):1387-1394.
[5] Chen J,Tang B,Chen H,et al.Different functions of the insect soluble and membrane-bound trehalase genes in chitin biosynthesis revealed by RNA interference[J].Public Library of Science ONE,2010,5(4):e10133.
[6] Silva M C,Ribeiro A F,Terra W R,et al.Sequencing of Spodoptera frugiperda midgut trehalases and demonstration of secretion of soluble trehalase by midgut columnar cells[J].Insect Molecular Biology,2009,18:769-784.
[7] 黄春霞,朱丽梅,倪珏萍,等.甜菜夜蛾的饲养方法介绍[J].昆虫知识,2002,39(3):229-231.
[8] 岑明.介绍一种棉铃虫饲养盒[J].昆虫知识,1983(1):43-44.
[9] 陈景芬,姜辉,顾宝根.小菜蛾的饲养方法[J].农药科学与管理,1994(4):29-30.
[10]王振营,周大荣.亚洲玉米螟在人工饲料上连续饲养多代对玉米危害能力比较[J].植物保护,1998,24(3):3-5.
[11]金翠霞,何忠.粘虫饲养方法介绍[J].昆虫知识,1965(6):369-370.
[12]Wegener G,Tschiedel V,Schloder P,et al.The toxic and lethal effects of the trehalase inhibitor trehazolin in locusts are caused by hypoglycaemia[J].The Journal of Experimental Biology,2006,206:1233-1240.
[13]Silva M C P,Terra W R,Ferreira C.The role of carboxyl,guanidine and imidazole groups in catalysis by a midgut trehalase purified from an insect larvae[J].Insect Biochemistry and Molecular Biology,2004,34:1089-1099.
[14]Dahlqvist A.Assay of intestinal disaccharidases[J].Analytical Biochemistry,1968,22(1):99-107.
[15]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle ofprotein dye binding[J].Analytical Biochemistry,1976,72:248-254.
[16]Yamashita O,Sumida M,Hasegawa K.Developmental changes in midgut trehalase activity and its localization in the silkworm,Bombyx mori[J].Journal of Insect Physiology,1974,20:1079-1085.
[17]Terra W R,Ferreira C.The physiological role of the peritrophic membrane and trehalase:Digestive enzymes in the midgut and excreta of starved larvae of Rhynchosciara[J].Journal of Insect Physiology,1981,27:325-331.
[18]Wyatt G R.The biochemistry of sugars and polysaccharides in insects[J].Advances in Insect Physiology,1967,4:287-360.
[19]Sumida M,Yamashita O.Trehalase transformation in silkworm midgut during metamorphosis[J].Journal of Comparative Physiology,1997,115:241-253.
