猪伪狂犬病病毒新流行株的分离鉴定及抗原差异性分析
2013-09-11彭金美安同庆赵鸿远刘益民陈家锃冷超粮田志军童光志
彭金美,安同庆,赵鸿远,刘益民,陈家锃,冷超粮,孙 艳,常 丹,田志军*,童光志
(1.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/猪病研究室,黑龙江哈尔滨150001;2.中国农业科学院上海兽医研究所,上海200241)
猪伪狂犬病(Pseudorabies,PR)是由 PR病毒(PRV)引起的一种猪急性传染病。PRV可以感染不同年龄段的猪,但以妊娠母猪和哺乳仔猪感染最为严重:导致妊娠母猪流产、死胎和木乃伊胎;哺乳仔猪出现神经症状、麻痹、衰竭死亡,死亡率几乎高达100%。在规模化猪场,一般采用PRV基因缺失疫苗进行防制。虽然偶尔有病毒分离的报道[1-3],但总体而言该病得到了有效的控制。但2011年以来,许多使用基因缺失活疫苗免疫的规模化猪场出现了疑似PR流行,主要表现为猪群gE抗体阳性率显著升高,母猪产弱仔、死胎,仔猪出现神经症状及死亡等。本研究对从部分省份的14个PR免疫猪场送检的153份临床样品进行PRV野毒的分离鉴定、gE基因序列分析及血清中和试验,结果初步表明这些猪场流行的PRV野毒具有某种程度的抗原变异。
1 材料和方法
1.1 病毒株及病料 PRV Bartha k61疫苗株和PRV经典强毒双城株(PRV-S)为本实验室保存。疑似PR发病猪脑组织153份,分别来自于黑龙江、吉林、辽宁、内蒙、河南等5个省14个免疫PRV Bartha k61弱毒疫苗的猪场。取适量组织进行匀浆,匀浆液一部分用于提取病毒基因组DNA做PCR鉴定,一部分用于病毒分离鉴定。
1.2 细胞及实验动物 Vero细胞为本实验室保存;BALB/c小鼠和实验猪购自哈尔滨兽医研究所实验动物中心。
1.3 引物设计及合成 根据GenBank中登录的PRV基因组序列(NC_006151)分别设计扩增部分gE基因的检测引物(gEup1:5'-GCCTGCCACCCGGACC TGGT-3'; gELow1: 5'-CACGTACAGCCCCGACTCG TCC-3')和用于gE全基因扩增和序列分析的引物(gEup2:5'-ATGCGGCCCTTTCTG-3';gELow2:5'-C GGTTCTCCCGGTATTTAAGC-3')。
1.4 病毒基因组的提取及PCR扩增 参照文献[4]的方法进行操作。
1.5 病毒分离 将PCR鉴定为阳性的脑组织匀浆液,采用0.22μm滤器过滤除菌后,取1m L接种Vero单层细胞,孵育1h后更换含2%胎牛血清的DMEM培养液,逐日观察细胞病变(CPE)。待70%左右的细胞出现CPE时收毒,冻融一次后,连续在Vero细胞中传代扩大培养。
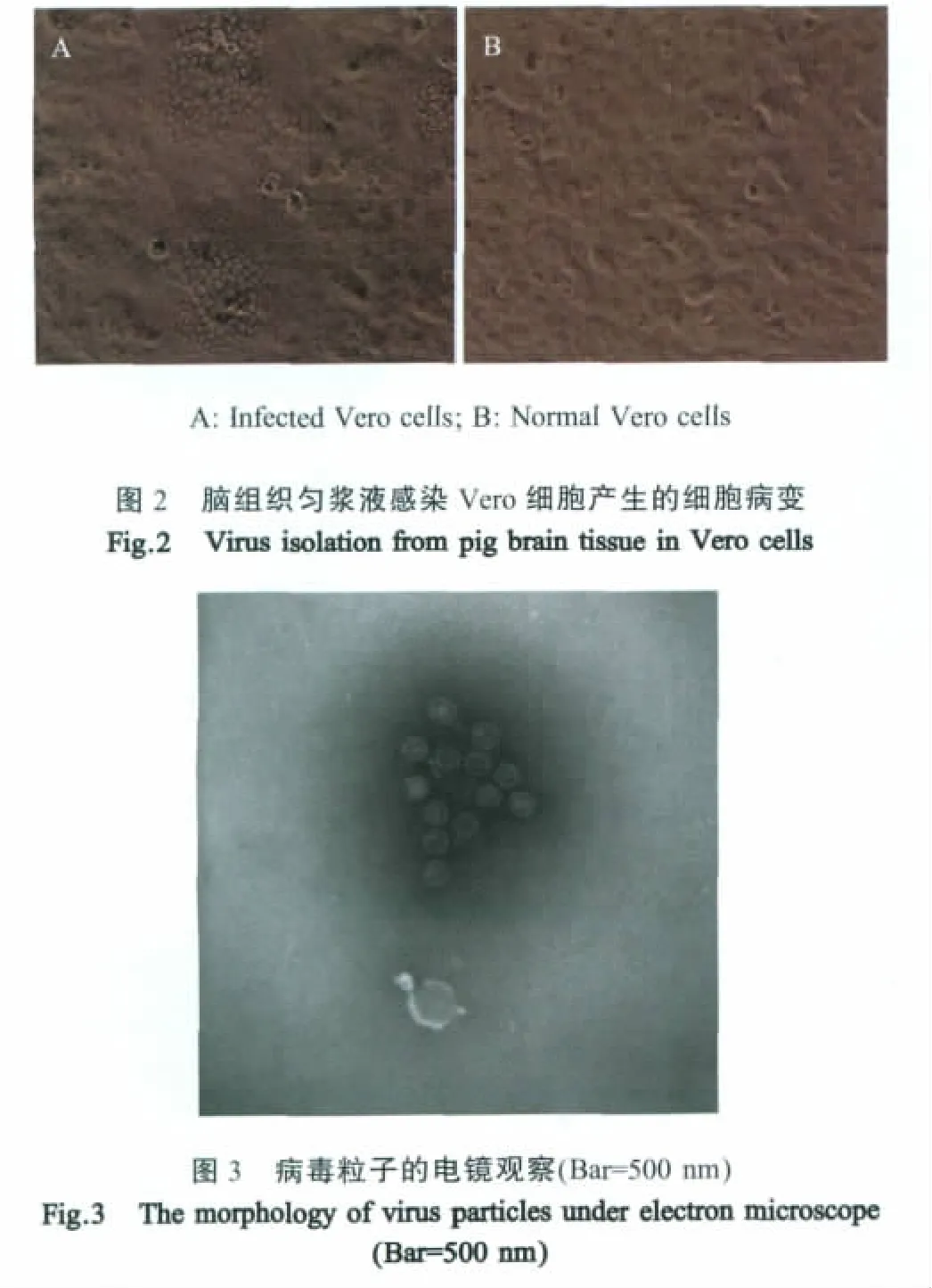
1.6 病毒粒子的电镜观察 取Vero细胞中培养的第5代病毒液用2%磷钨酸负染,在电镜下观察病毒粒子形态。
1.7 小鼠感染试验 6周龄~8周龄BALB/c小鼠65只,30只接种10×倍比稀释(101~106)的 F5代分离毒,30只接种10×倍比稀释(101~106)的PRV-S强毒株,每个稀释度5只、每只经腹股沟皮下接种0.1m L,并设5只小鼠注射等体积DMEM培养液作为阴性对照。观察小鼠临床症状及死亡情况并按Reed-Muench法计算其LD50。
1.8 病毒中和试验 采用固定病毒稀释血清法测定疫苗株Bartha k61接种猪血清和新分离病毒接种猪血清对两株病毒(Bartha k61和新分离病毒)的中和抗体效价,操作过程参照文献[5]的方法。抗血清制备:10头40日龄PRV阴性仔猪,其中5头肌注1m L含107.0TCID50的新分离PRV,5头肌注1m L含107.0TCID50的PRV Bartha k61株,每周采血分离血清,56℃灭活30min,病毒量为100TCID50/孔。
2 结 果
2.1 病料检测 将疑似PR发病猪场病料中的脑组织进行匀浆,提取总DNA,以其为模板利用PRV gE特异性引物(gEup1/gELow1)进行PCR检测。结果表明从黑龙江、吉林、辽宁、内蒙、河南5省14个猪场中检测到87份阳性病料,各猪场均存在野毒感染。图1为其中一个猪场的检测结果。

2.2病毒的分离及鉴定 将部分阳性脑组织匀浆液过滤除菌后接种Vero细胞,48h后即可以观察到网状的CPE(图2)。利用gEup1/gELow1对培养物进行PCR鉴定,能够扩增到预期大小的片段,而利用猪瘟、猪圆环病毒以及猪繁殖与呼吸综合征病毒特异性引物[6]扩增均呈阴性反应。将F5代培养物负染后进行电镜检测,可以观察到病毒粒子呈圆形,有中空和实心两种特征,有的有囊膜有的无囊膜(图3)。将其中一分离病毒命名为PRV HeN1。对 BALB/c小鼠的 LD50为 102.37TCID50,PRV-S对BALB/c小鼠的LD50为103.83TCID50。注射DMEM培养液的对照鼠无任何临床症状。

2.3 gE基因序列分析 采用gEup2/gELow2引物,以提取的阳性病料组织和细胞培养物的DNA为模板,扩增完整的gE基因编码区,克隆于pMD18-T载体中进行测序。利用生物学软件DNAStar 6.24对PRV gE核苷酸序列进行比对,结果表明本实验室最近分离的PRV均位于一个相对独立的分支中,与以前分离的病毒株亲缘关系相对较远(图4)。
2.4 小鼠感染试验 BALB/c小鼠接种PRV HeN1株和PRV-S株后均出现了典型的PR症状:发病鼠撕咬接种部位,导致局部被毛脱落、皮肤出血、严重者后肢被咬断,接种病毒量在103.0~106.0TCID50的小鼠在接种后72h内死亡。通过计算PRV HeN1
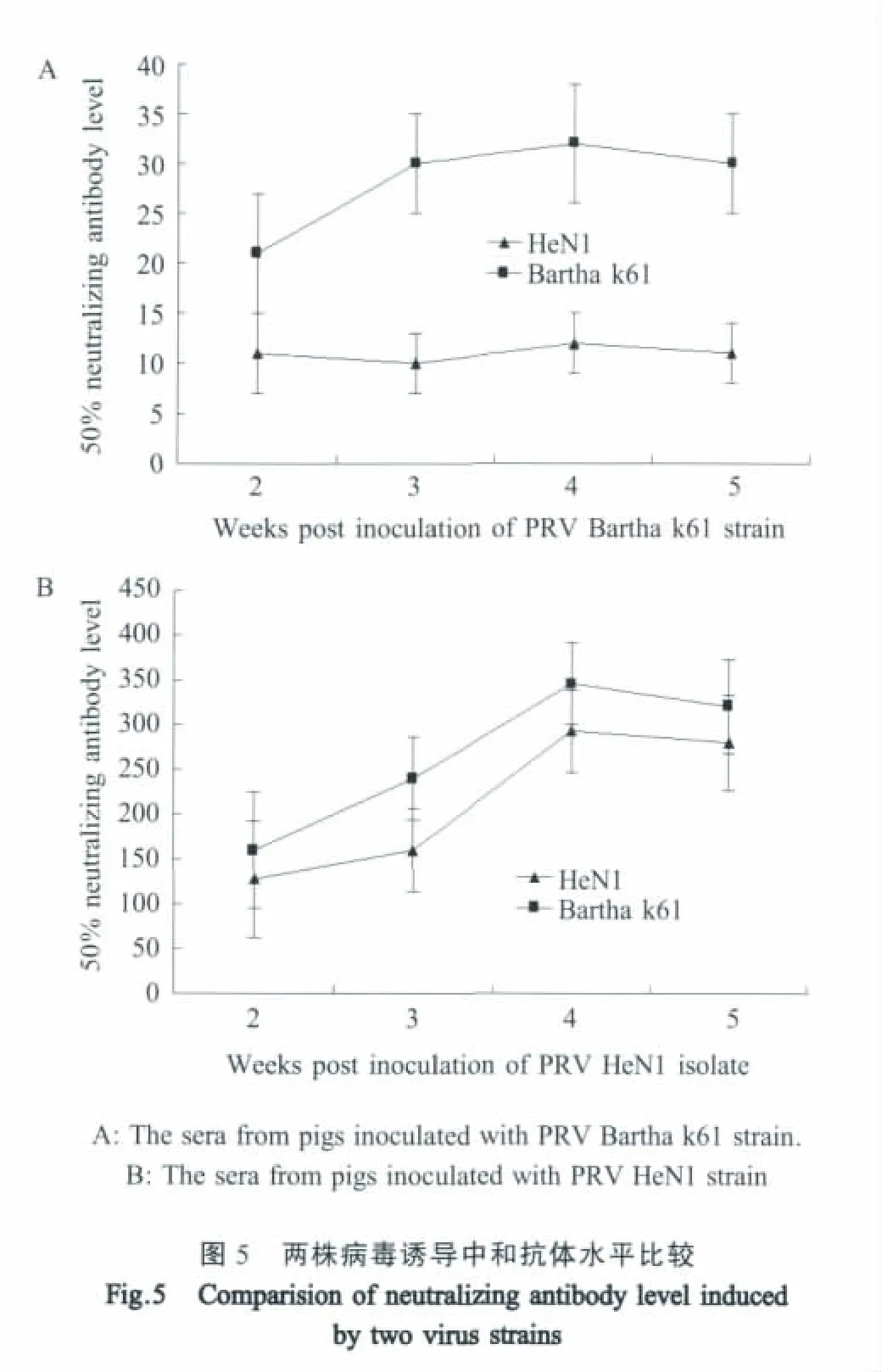
2.5 血清交叉中和试验 利用中和试验测定了PRV Bartha k61和HeN1接种猪在不同时间点采集的血清对Bartha k61和HeN1病毒的中和能力。结果表明,Bartha k61接种猪产生的中和抗体水平与HeN1接种猪相比普遍较低,能够50%中和自身病毒的血清稀释度均在1∶20~1∶40之间,对分离病毒HeN1的中和能力更低,50%中和病毒的血清稀释度在1∶10左右(图5A)。HeN1接种猪在感染后2周即能够产生高水平的中和抗体,50%中和病毒的血清稀释度均在1∶80以上,而且对两种病毒的中和能力均较高(图5B)。
3 讨 论
PR是危害养猪业的重要传染病,目前PR防制主要依靠接种基因缺失疫苗。欧盟许多国家通过使用gE-的基因缺失疫苗和与之相配套的鉴别诊断方法控制和根除了PR。我国于上世纪70年代从匈牙利引进了PRV Bartha k61株[7-8],该病毒株是公认的优良疫苗株,上世纪90年代以来国内规模化猪场普遍使用该疫苗,使PR得到了很好的控制[9-10]。但近一年多来不断有猪场发生PR流行,并且呈逐渐严重的趋势。本实验室从黑龙江、吉林、辽宁、内蒙古、河南等省的猪场送检发病猪组织中通过PCR和细胞接种证明为PRV野毒感染。这些猪场均按照正常程序接种PRV Bartha k61疫苗,因此新分离的病毒是否发生了变异有待深入研究。本实验室对检测和分离的野毒株gE基因进行了测序并与GenBank中登录的相应序列进行比对,其同源性均在97%以上,但本实验分离的PRV均在一个相对独立的分支中,是否这些病毒株形成一个新的流行毒株群还有待更多的分子流行病学数据来验证。
近期发生PR猪场的主要表现为仔猪出生后有腹泻和神经症状,死亡率较高,发生类似症状的猪场有时误诊该病为高致病性猪蓝耳病、猪瘟和流行性腹泻。另外,PRV感染猪几乎不形成病毒血症,因此在血液中检出PRV的概率很低,而我们在病料的检测过程中发现脑组织的病毒含量高,因此该病的诊断应尽量以发病猪的脑组织检测为主。PRV基因组GC含量高达70%,设计检测病毒的PCR引物难度较大,有时造成检测样品不够敏感。由于以上原因,PR目前在我国的流行现状还不清楚。
利用微量中和试验进行血清学分析表明,Bartha k61株接种猪血清产生中和抗体水平较低,对HeN1分离株的中和能力差,而HeN1分离株接种猪血清产生抗体水平高,而且对Bartha k61株也具有较高的交叉中和能力,表明PR现地流行的病毒株与疫苗株之间在抗原性存在一定的差异。但现有疫苗株对HeN1分离株免疫保护效果还有待动物试验来进一步验证。
[1]袁庆志,礼卓然,南锡,等.猪伪狂犬病病毒的分离与鉴定[J].中国预防兽医学报,1987,3(34):10-11.
[2]陈焕春,方六荣,何启盖,等.猪伪狂犬病病毒鄂A株的分离鉴定[J].畜牧兽医学报,1998,29(2):97-104.
[3]范伟兴,胡敬东,吴加强,等.猪伪狂犬病病毒鲁A株的分离鉴定[J].中国兽医学报,2003,23(6):538-540.
[4]彭金美,王瑜,田志军,等.带BAC质粒的重组伪狂犬病病毒的构建及其体外生长特性研究[J].中国预防兽医学报,2009,31(1):10-15.
[5]袁庆志,吴裕祥,李亚香,等.伪狂犬病免疫的研究Ⅰ、伪狂犬病弱毒疫苗的研究[J].中国预防兽医学报,1983,1:1-6.
[6]童光志,周艳君,郝晓芳,等.高致病性猪繁殖与呼吸综合征病毒的分离鉴定及其分子流行病学分析[J].中国预防兽医学报,2007,29(5):323-327.
[7]Lomniczi B,Blan-Kenship M L,Ben-Porat T T.Deletions in the genomes of pseudorabies virus vaccine strains and existence of four isomers of the genomes[J].J Virol,1984,49(3):970-979.
[8]Petrovskis E A,Timm ins JG,Gierman T M,et al.Deletions in vaccine strains of pseudorabies virus and their effect on synthesis of glycoprotein gp63[J].JVirol,1986,60(3):1166-1169.
[9]K lupp B G,Lomniczi B,Visser N,et al.Mutations affecting the UL21gene contribute to avirulence of pseudorabies virus vaccine strain Bartha[J].Virology,1995,212(2):466-473.
[10]童光志,陈焕春.伪狂犬病流行现状及我国应采取的防制措施[J].中国兽医学报,1999,19(1):1-2.
