SIRNA抑制PTTG表达对人结肠癌LOVO细胞增殖、凋亡及细胞周期的影响
2013-09-11王茂楠徐松柏刘玉石吉林省人民医院吉林长春3002
王茂楠 夏 昕 徐松柏 刘玉石 (吉林省人民医院,吉林 长春 3002)
近年来中国结肠癌的发病率呈上升趋势,且以每年4%的幅度递增,递增速度为世界平均水平的2倍〔1~3〕。目前,结肠癌的治疗方法主要以手术为主,辅以局部或全身放、化疗,但未能明显提高结肠癌的5年生存率,因此传统的治疗方法效果并不理想。近年来随着分子生物学及基因工程的发展,使得应用基因治疗成为提高结肠癌患者预后的一种有前景的途径〔4~6〕。本研究通过RNA干扰技术对结肠癌LoVo细胞中PTTG进行抑制,并进一步观察PTTG基因沉默对结肠癌LoVo细胞增殖、凋亡及细胞周期的影响。
1 材料与方法
1.1 细胞株和主要试剂 人结肠癌LoVo细胞株为本研究室保存。阴性对照干扰质粒 pGenesil-2.1-HK siRNA,PTTG 干扰质粒pGenesil-2.1-PTTG siRNA由本室构建并保存;胎牛血清、DMEM培养基购自Gibco公司(美国),ECL发光试剂盒购自美国BD公司。
1.2 细胞培养和转染 LoVo细胞用含10%胎牛血清的DMEM培养液,于37℃,5%CO2培养箱中培养。细胞转染采用阳离子脂质体介导法,按Lipofectamine 2000说明书进行。
1.3 pGenesil-2.1-PTTG siRNA 干扰后 LoVo细胞中 PTTG 表达 采用Western blot法,ECL发光试剂盒检测转染48 h后3组细胞中PTTG蛋白表达。
1.4 pGenesil-2.1-PTTG siRNA对 LoVo细胞增殖的影响 取对数生长期细胞制备细胞悬液,调整细胞密度为2.5×104个/L,用无双抗的DMEM培养基铺于96孔板上,每孔200 μl(相当于5 000个细胞)。实验分3组:正常对照组、阴性干扰质粒组和PTTG干扰质粒组,每组6复孔,转染后放入37℃、5%CO2孵箱培养,于培养24、48和72 h后,每孔加入MTT溶液(5 mg/ml)20 μl,继续孵育4 h。终止培养,小心吸弃孔内培养液,每孔加入150 μl DMSO振荡,并于490 nm下用酶标仪检测各孔光吸收值(A)。
1.5 pGenesil-2.1-PTTG siRNA 对 LoVo 细胞凋亡和细胞周期的影响 将LoVo细胞用无双抗的DMEM培养基铺于6孔板上,分组同上。转染后48 h收集细胞,1 200 r/min,离心5 min,0.01 mmol/L PBS洗两次,RNA酶消化,PI(碘化丙腚)4℃避光染色30 min,以流式细胞仪(BD公司,USA)检测细胞周期时相变化;用Annexin V-PI FITC凋亡检测试剂盒检测细胞凋亡变化,将LoVo细胞加入6孔板24 h后,转染PTTG siRNA干扰质粒,同时设置正常对照及HK阴性对照组。连续培养48 h,收集细胞,每个样本取5×105个细胞,加450 μl binding buffer重悬细胞,然后加入2 μl荧光标记的 Annexin V和5 μl PI,室温避光染色15 min,流式细胞仪检测,细胞凋亡数据用Modfit软件分析,记录凋亡细胞百分率。
2 结果
2.1 pGenesil-2.1-PTTG siRNA 干扰后 LoVo细胞中 PTTG 蛋白表达 如图1所示,Lovo细胞转染pGenesil-2.1-PTTG siRNA干扰质粒48 h后其内PTTG蛋白表达明显低于正常和HK阴性对照组。

图1 转染PTTG siRNA质粒后LoVo细胞中PTTG蛋白表达(Western印迹)
2.2 pGenesil PTTG siRNA对LoVo细胞增殖的影响 MTT比色分析法显示,pGenesil PTTG siRNA质粒转染LoVo细胞后,在24、48和72 h细胞增殖能力均显著低于正常对照组和阴性对照HK组(均P<0.01)(表1)。
表1 转染PTTG siRNA质粒后LoVo细胞增殖率变化(MTT法)(±s,n=6)
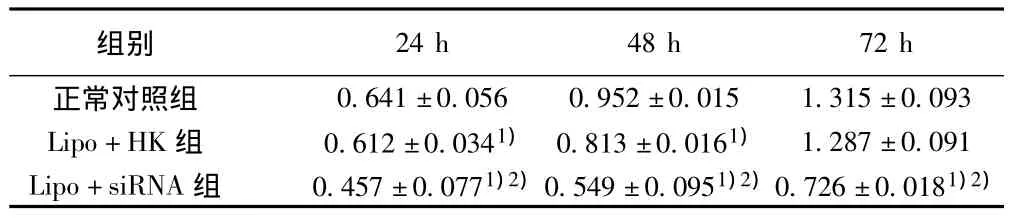
表1 转染PTTG siRNA质粒后LoVo细胞增殖率变化(MTT法)(±s,n=6)
与正常对照组比较:1)P<0.01;与HK组比较:2)P<0.01;表2同
0.641±0.056 0.952±0.015 1.315±0.093 Lipo+HK组 0.612±0.0341) 0.813±0.0161) 1.287±0.091 Lipo+siRNA组 0.457±0.0771)2)0.549±0.0951)2)0.726±0.0181)2)24 h 48 h 72 h正常对照组组别
2.3 pGenesil PTTG siRNA质粒对LoVo细胞周期和凋亡的影响 流式细胞法检测结果显示,与对照组相比,转染pGenesil-2.1-PTTG siRNA质粒后LoVo细胞G0/G1期细胞百分率均高于正常和阴性HK对照组(均P<0.01),而S期细胞百分率均低于正常和阴性HK对照组(均P<0.01),提示PTTG基因被干扰后可使LoVo细胞阻滞于 G0/G1期;Annexin V-PI双染结果显示,转染pGenesil-2.1- PTTG siRNA质粒后LoVo细胞凋亡百分率高于正常和阴性HK对照组(均P<0.01)(表2)。
表2 pGenesil PTTG siRNA质粒对LoVo细胞周期和凋亡的影响(±s,n=4)

表2 pGenesil PTTG siRNA质粒对LoVo细胞周期和凋亡的影响(±s,n=4)
Apoptosis组别 G0/G1 S G2/M 49.66±4.14 47.69±4.37 2.66±1.88 13.56±3.82 Lipo+HK组 52.67±3.24 40.0±3.11 7.33±2.03 15.81±3.07 Lipo+siRNA3组60.97±4.381)2)35.58±5.971)2)3.55±2.16 50.29±1.281)2)正常对照组
3 讨论
PTTG是一种强有力的肿瘤转化基因,是一种细胞分裂后期的抑制因子,通过抑制分裂酶的活性抑制成熟前的染色体分裂。通过这一重要的功能,PTTG参与胶质瘤细胞的有丝分裂、细胞周期的进行、DNA修复、细胞凋亡几个关键的活动〔7〕。PTTG在包括结肠癌等的大多数恶性肿瘤都有表达,且在正常组织中几乎未见表达,其异常表达与多种肿瘤的发生、发展及侵袭进程密切相关,故是结肠癌基因治疗的理想靶点之一〔8〕。沉默PTTG基因可能抑制肿瘤细胞过度增生状态,降低肿瘤的增殖活性,在整体上调解肿瘤细胞状态的同时也降低了某些癌基因的过度表达。本实验结果也支持这样的推断。pGenesil PTTG siRNA组,干扰质粒表达出针对于PTTG mRNA的siRNA,对PTTG基因直接产生沉默效应,该转染组的PTTG蛋白的表达受到明显的抑制,从客观上证明了笔者构建的干扰载体的有效性。
Pei〔9〕研究显示 PTTG蛋白与 c-myc基因的接近转录起始位置的启动子序列结合,并激活其转录,进而促进细胞增殖。这与本研究相一致。笔者发现,转染pGenesil PTTG siRNA的LoVo细胞较未转染组及空载体转染组增殖速度降低。通过细胞周期分析,发现转染pGenesil PTTG siRNA的LoVo细胞中,G0/G1期细胞所占比例明显增加,而S期细胞所占比例明显减少。pGenesil PTTG siRNA转染可能通过降低PTTG的表达,使在结肠癌LoVo细胞发生周期阻滞,从而抑制结肠癌细胞增殖。但其具体机制尚有待于进一步研究证实。
Bernal等〔10〕使用噬菌体呈现技术筛选,证明在体内或体外PTTG蛋白表达通过抑制p53基因的转录激活来抑制p53基因在MCF-7细胞诱导凋亡。在肺癌细胞系H1299,过度表达PTTG导致对p53凋亡诱导作用的抑制,并抑制p53的下游基因表达,如Bax、SFN和CDKN1A,提示PTTG抑制细胞凋亡。本研究结果显示,将PTTG基因沉默后结肠癌LoVo细胞凋亡明显增加,与对照组差异显著,间接提示了PTTG与结肠癌细胞凋亡之间的关系,但其与结肠癌细胞凋亡是否与p53相关,且其机制尚有待进一步的研究。总之,针对PTTG的研究对明确结肠癌的发病机制以及改善结肠癌的治疗均有重要意义。针对PTTG的基因治疗,可能为结肠癌的治疗提供新的策略。
1 Magalhães B,Peleteiro B,Lunet N.Dietary patterns and colorectal cancer:systematic review and meta-analysis〔J〕.Eur J Cancer Prev,2012;21(1):15-23.
2 Yuhara H,Steinmaus C,Cohen SE,et al.Is diabetes mellitus an independent risk factor for colon cancer and rectal cancer〔J〕?Am J Gastroenterol,2011;106(11):1911-21.
3 Nieuwenhuis MH,Lefevre JH,Bülow S,et al.Family history,surgery,and APC mutation are risk factors for desmoid tumors in familial adenomatous polyposis:an international cohort study〔J〕.Dis Colon Rectum,2011;54(10):1229-34.
4 Makino T,Shukla PJ,Rubino F,et al.The impact of obesity on perioperative outcomes after laparoscopic colorectal resection〔J〕.Ann Surg,2012;255(2):228-36.
5 McKay GD,Morgan MJ,Wong SK,et al.Improved short-term outcomes of laparoscopic versus open resection for colon and rectal cancer in an area health service:a multicenter study〔J〕.Dis Colon Rectum,2012;55(1):42-50.
6 Faiss S.The missed colorectal cancer problem〔J〕.Dig Dis,2011;29(Suppl 1):60-3.
7 Smith VE,Franklyn JA,McCabe CJ.Pituitary tumor-transforming gene and its binding factor in endocrine cancer〔J〕.Expert Rev Mol Med,2010;12:e38.
8 Salehi F,Kovacs K,Scheithauer BW,et al.Pituitary tumor-transforming gene in endocrine and other neoplasms:a review and update〔J〕.Endocr Relat Cancer,2008;15(3):721-43.
9 Pei L.Identification of c-myc as a down-stream target for pituitary tumortransforming gene〔J〕.J Biol Chem,2001;276(11):8484-91.
10 Bernal JA,Hernández A.p53 stabilization can be uncoupled from its role in transcriptional activation by loss of PTTG1/securin〔J〕.J Biochem,2007;141(5):737-45.
