阿司匹林对宫颈癌Hela细胞的增殖抑制作用
2013-09-11李建立邢邯英河北省人民医院妇产科河北石家庄050051
王 蓓 王 晓 李建立 秦 英 邢邯英 (河北省人民医院妇产科,河北 石家庄 050051)
阿司匹林为非甾体类消炎药,其药理作用为抑制环氧化酶的活性,降低前列腺素的合成〔1,2〕。最近流行病学研究证实,阿司匹林及其他非甾体类消炎药具有降低肿瘤发病率的作用,有文献报道阿司匹林对肿瘤细胞的生长有抑制作用〔3〕,可以抑制食管癌、胃癌、结肠癌、卵巢癌、胰腺癌、肝癌、乳腺癌、肺癌、淋巴瘤以及子宫内膜癌的生长〔4〕。本研究观察阿司匹林对体外培养的宫颈癌Hela细胞的形态及生长增殖状况的影响及作用机制。
1 材料与方法
1.1 材料 人宫颈癌Hela细胞(河北医科大学第四医院科研中心);阿司匹林、RPMI-1640细胞培养基、小牛血清、胰酶DMSO等(Gibco公司);Giemsa染液、MTT(Sigma公司)。
1.2 细胞常规培养和实验分组 接种宫颈癌Hela细胞于含10%新生牛血清的RPMI-1640培养基中,置于37℃,5%CO2饱和湿度的恒温培养箱中。细胞贴壁生长约90%融合时,以0.25%胰酶消化,每周传代2~3次。实验分为对照组和阿司匹林干预组(阿司匹林纯品溶于无水乙醇中,过滤除菌,再用RPMI-1640培养基分别配置成为不同浓度的溶液,无水乙醇最大浓度为1%)。
1.3 凋亡细胞形态学观察 取对数生长期的Hela细胞,以5×105/孔的密度接种于6孔板中,24 h后细胞贴壁良好,更换含有不同浓度0、1、5、10 mmol/L阿司匹林的RPMI-1640培养基,然后继续培养48 h。小心取出盖玻片并用PBS缓冲液冲洗两遍,以固定液(冰醋酸∶甲醇=1∶3)固定30 min,用Haden磷酸缓冲液稀释的Giemsa染液染色15 min,然后用清水冲洗多余染液,放置室温风干、树脂封片、光学显微镜下观察并摄像。
1.4 DNA提取及琼脂糖电泳 收集经过含不同浓度0、1、5 mmol/L阿司匹林培养基干预48 h的Hela细胞,将细胞分别加入1 ml细胞裂解液,震荡混匀并加入50 μl 10%的SDS及蛋白酶K至终浓度100 mg/L,55℃水浴过夜,裂解细胞消化蛋白。冷却后加等体积Tris Hcl饱和酚,充分震荡后用低温离心机,4℃ 4 000 r/min,离心15 min。小心吸取上层黏稠水相,移至另一离心管中,加等体积Tris Hcl饱和酚和氯仿=1∶1重复抽提,4℃ 4 000 r/min,离心15 min,小心吸取上清液,加等体积氯仿震荡混匀,4℃ 4 000 r/min,离心15 min,小心吸取上清液,加3~5倍体积无水乙醇,放置-20℃,过夜沉淀DNA,取出后4℃4 000 r/min,离心 15 min,离心弃上清后,用 70% 乙醇 400 μl,4℃ 4 000 r/min,离心15 min,洗去残留的有机物,室温晾干。溶于200 μl无菌去离子水中溶解DNA,取4 μl DNA溶解产物与2 μl的溴酚蓝混匀,加入1.5%的琼脂糖凝胶加样孔中,在80 V电压下电泳30 min,在凝胶成像系统下观察DNA条带。
1.5 细胞增殖抑制率检测(MTT法) 常规培养Hela细胞,取进入对数生长期的Hela细胞,经PBS缓冲液冲洗两遍并用胰酶消化后,用台盼蓝染液计数,检测细胞活力大于95%后,用RPMI-1640培养基调整细胞数,制成1×104个/ml的细胞悬液加入96孔板中,每孔加入200 μl,细胞贴壁24 h后,更换含不同浓度0、1、5、10 mmol/L阿司匹林的RPMI-1640培养基,每个剂量6个复孔,继续培养24、48、72、96 h后,取出的培养板每孔加入噻唑蓝20 μl,继续培养4 h,弃掉培养基,每孔加入二甲亚砜(DMSO)150 μl,在摇床上震荡20 min,使结晶物充分溶解,选择波长为492 nm于酶联免疫吸附仪上测定各孔OD值。增殖细胞抑制率=(1-实验组光度吸收值OD值/对照组光度吸收值OD值)×100%。细胞生长率=(实验组光度吸收值OD值/对照组光度吸收值OD值)×100%。
2 结果
2.1 阿司匹林作用Hela细胞后形态学变化 Giemsa染色后可见对照组细胞形态饱满,细胞核染色均匀,核仁清晰可见;而阿司匹林组细胞中出现细胞质浓缩、变圆,细胞核着色不均,核物质边集,细胞数量明显减少,见图1。
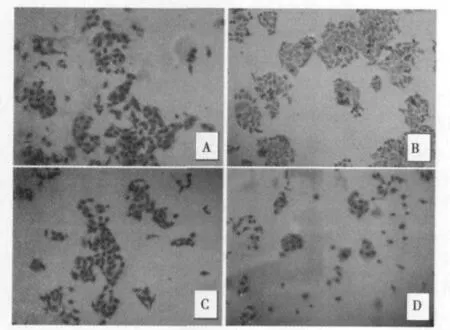
图1 各组细胞Giemsa染色(×200)
2.2 阿司匹林作用Hela细胞后细胞基因组DNA变化 不同浓度阿司匹林作用Hela细胞48 h后,提取其细胞DNA,进行1.5%琼脂糖凝胶电泳,可见明显的细胞DNA裂解带,随着作用浓度增加,DNA裂解明显,而对照组则无此变化,说明阿司匹林可诱导Hela细胞凋亡。见图2。

图2 琼脂糖凝胶电泳的DNA Ladder带
2.3 阿司匹林对Hela细胞增殖的影响 见图3,阿司匹林干预组Hela细胞生长明显出现抑制,与阿司匹林作用时间和作用浓度呈依赖性。5 mmol/L阿司匹林作用72 h后Hela细胞,增殖率为(70.31±4.96)%,10 mmol/L阿司匹林作用72 h后Hela细胞增殖率为(98.54±3.66)%,差异显著(P<0.05),见图3。对照组细胞生长正常。

图3 各组细胞增殖曲线
3 讨论
阿司匹林在临床上应用广泛。近年来发现,长期服用小剂量阿司匹林可以预防冠心病、降低胃肠道肿瘤危险性,使其成为研究焦点。朱慧明等〔5〕报道阿司匹林对结肠癌细胞株HT229、SW620和肺癌SPCA-1细胞有抑制作用。本研究发现阿司匹林对人宫颈癌Hela细胞增殖有显著的抑制作用,在不同浓度范围内呈时间-浓度依赖性关系〔6〕。一定浓度阿司匹林作用宫颈癌Hela细胞24 h后,即可明显改变细胞周期时相分布将细胞阻滞于DNA合成期,阻止DNA合成,诱导细胞凋亡;阿司匹林对Hela细胞抑制作用以诱导凋亡为主,而且药物对细胞的损伤、细胞周期时相分布的影响和诱导凋亡作用三者均有时间-浓度依赖性,且均呈正相关。本文结果提示阿司匹林作用于Hela细胞在细胞进入DNA合成后期可引起DNA损伤,使细胞停滞在G2/M期。与刘兴等研究阿司匹林对胃癌细胞株SGC-7901在G0/G1期减少,S期和G2/M期细胞增多结果相似,而朱慧明等〔5〕发现阿司匹林使人肺腺癌细胞株SPCA-1在G0/G1期增多,S期和G2/M期细胞减少。
阿司匹林抑制肿瘤生长的机制尚不明确。目前认为主要机制为阿司匹林抑制COX-2酶发挥作用〔7〕,COX-2酶能够在上皮细胞中过度表达,抑制凋亡发生,促进肿瘤细胞的浸润〔8〕;另外阿司匹林可以影响Bcl-2基因家族的调控,可以上调促进凋亡的bax、bak基因和下调抑制凋亡bcl-2基因的作用〔9〕;还可以激活诱发凋亡最关键的信号分子半胱氨酸蛋白血酶的caspase家族〔10〕。本研究发现,阿司匹林处理宫颈癌Hela细胞后,可以影响Bcl-2基因家族的调控,上调促进凋亡的Bax基因表达同时下调抑制凋亡Bcl-2基因引起细胞凋亡;此可能为阿司匹林抑制Hela细胞增殖的主要机制。
综上所述,阿司匹林在体外可抑制人宫颈癌Hela细胞增殖〔11〕,其机制可能为抑制肿瘤细胞DNA合成,改变其细胞周期时相分布有关〔12〕。
1 Xiang S,Sun Z,He Q,et al.Aspirin inhibits ErbB2 to induce apoptosis in cervical cancer cells〔J〕.Med Oncol,2010;27(2):379-87.
2 许 红,安翠平,陈瑞敏.阿司匹林对卵巢癌细胞凋亡及Bcl-2/bax基因mRNA表达的影响〔J〕.河北医药,2009;31(4):404-6.
3 Gupta RA,Tejada LV,Tong BJ.et al.Cyclooxygenase-1 is overexpressed and promotes angiogenic growth factor production in ovarian cancer〔J〕.Cancer Res,2003;63(3):906-11.
4 Li S,Miner K,Fannin R.Cyclooxygenase-1 and 2 in normal malignant human ovarian epithelium〔J〕.Gynecol Oncol,2004;92(2):622-7.
5 朱慧明,吴 铁,崔 燎.阿司匹林诱导人肺腺癌细胞株SPC-1凋亡研究〔J〕.中国药理学通报,2004;20(6):640-3.
6 Lee SK,Park MS,Nam MJ.Aspirin has antitumor effects via expression of calpain gene in cervical cancer cells〔J〕.J Oncol,2008;2008:285374.
7 郑秀娟,李淞漪.阿司匹林对宫颈癌Hela细胞COX-2mRNA表达的抑制作用〔J〕.浙江临床医学,2007;9(11):1461-2.
8 Morré DJ,Morre DM.tNOX,an alternative target to COX-2 to explain the anticancer activities of non-steroidal anti-inflammatory drugs(NSAIDS)〔J〕.Mol Cell Biochem,2006;283(1-2):159-67.
9 Kutuk O,Basaga H.Aspirin inhibits TNFα-and IL-1-induced NF-κB activation and sensitizes Hela cells to apoptosis〔J〕.Cytokine,2004;25:229-37.
10 Kim KY,Seol JY,Jeon GA,et al.The combined treatment of aspirin and radiation induces apoptosis by the regulation of bcl-2 and caspase-3 in human cervical cancer cell〔J〕.Cancer Lett,2003;89(2):157-66.
11 Kutuk O,Basaga H.Aspirin prevents apoptosis and NF-κB activation induced by H2O2in Hela cells〔J〕.Talor﹠ Francis Healthsci,2003;12:1267-76.
12 赵 健,曹泽毅,廖秦平,等.阿司匹林对宫颈癌细胞系Caski的生长抑制作用〔J〕.中国妇产科临床杂志,2003;4(1):37-9.
