氟喹诺酮类药物浓度对预防肺炎链球菌耐药的影响研究
2013-09-07任丽娜
张 艳 任丽娜
太钢总医院检验科,山西太原 030080
相对而言,肺炎链球菌对呼吸氟喹诺酮类的耐药率是比较低的,全球耐药性监测表明肺炎链球菌对左氧氟沙星的耐药率在绝大多数国家为0~2.1%,即使是青霉素耐药的菌株,对左氧氟沙星一般也保持敏感[1]。2002年美国CDC的资料,对青霉素耐药的菌株阿莫西林、四环素、红霉素、克林霉素、头孢呋辛都显示比较高的耐药率,唯有左氧氟沙星保持很好的敏感性。例外的是香港10%的耐药率[2]。本组实验检测氟喹诺酮类药物对肺炎链球菌临床耐药情况,比较防突变浓度与最低抑菌浓度间的关系,现将材料总结如下:
1 材料与方法
1.1 菌株
本组资料所用的实验菌株为我院2009年1月~2012年4月收治入院患者痰液及分泌物等标本中分离的葡萄球菌100株。质控菌肺炎链球菌ATCC49619,购自中国药品生物制品检定所。
1.2 培养基
Tryptic Soy培养基、基础培养基、Mueller-Hinton(M-H)琼脂、Todd-Hewitt肉汤,所有产品均由英国Oxoid提供。
1.3 抗菌药物
加替沙星、莫西沙星、司巴沙星、左氧氟沙星、环丙沙星等5种氟喹诺酮抗菌药物。
1.4 药物敏感试验
采用K-B纸片扩散法测定葡萄球菌对上述5种药品的敏感性,按照2010年NCCLS药敏标准进行判读[3]。
1.5 最低抑菌浓度(MIC)
采用标准琼脂二倍稀释法进行MIC测定,抗菌药物的测定浓度范围为256~0.008 mg/L,所测试的肺炎链球菌悬液浓度为>108 CFU/mL,并采用Denley多点接种仪接种,接种物悬液按1:10稀释以获得107 CFU/mL的接种浓度。采用接种物复种器可在琼脂表面接种1~2 μL的菌液,最终琼脂上的点所含的接种菌约104 CFU/mL。
1.6 防突变浓度(MPC)
采用标准琼脂平板稀释法。将>1010的细菌接种到高于MIC浓度的系列浓度平板上,观察没有细菌生长的最低抗菌药物浓度。
2 结果
2.1 抗菌药物浓度范围
在5种药物中,莫西沙星的MPC50和MPC90值最低,而环丙沙星最高,喹诺酮类对肺炎链球菌MPC所用抗菌药物浓度范围见表1。
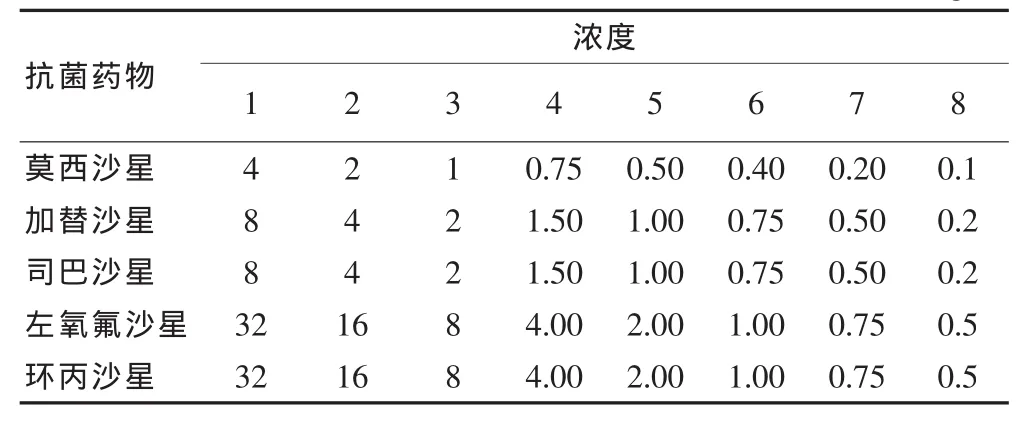
表1 测定喹诺酮类对肺炎链球菌MPC所用抗菌药物浓度范围(mg/L)
2.2 最低抑菌浓度
测定菌株对莫西沙星、左氧沙星的MPC/MIC范围主要在8~16,对加替沙星、司巴沙星的MPC/MIC范围主要在16~32,对环丙沙星的MPC/MIC范围主要在32~64。5种氟喹诺酮类药物对100株肺炎链球菌的MIC值详见表2。
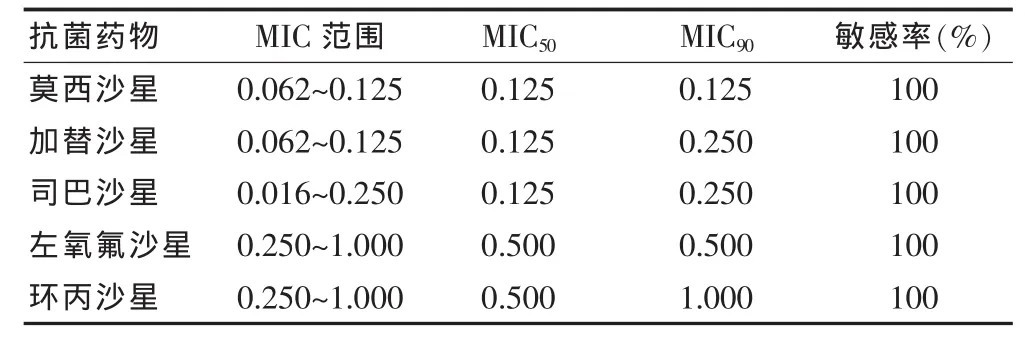
表2 5种氟喹诺酮类药物对100株肺炎链球菌的MIC值(mL/L)
3 讨论
近年来下呼吸道感染(LRTI)的预后有了很大改善。但目前其患病率及在某些年龄段病死率仍很高,所以依然是临床领域的一个治疗难点和研究热点。肺炎链球菌性疾病是由肺炎链球菌引起的,主要还是要用抗生素治疗[4]。目前,我国各医疗机构普遍存在的共性是非细菌性感染引起的疾病也用抗生素,而且是大量的、不合理的使用。这种现象一方面造成诊断困难,另一方面使得肺炎链球菌对抗生素产生了耐药[5]。喹诺酮是近年来在LRTI抗感染治疗中应用较广泛的抗菌药物,因其在抗菌活性和药代动力学等方面的优点,在LRTI治疗中占据了越来越重要的地位[6]。
喹诺酮是近年来在呼吸道感染中应用较多的抗菌药物,基于其抗菌谱广,具有良好的PK/PD参数,有效防止耐药,组织穿透力强,因而成为治疗呼吸道感染的优选药物,在CAP、HAP及AECOPD等LRTI的抗感染治疗中占据重要地位[7]。同时,也可能存在一些问题。肺炎链球菌严峻的耐药形势,使得肺炎链球菌疾病的抗生素治疗陷入一个困境。一方面患病率增加,耐药性的感染会使病程加长,病原体扩散[8]。另一方面,由于耐药率高不容易治疗,最后导致患者死亡。
综上所述,本研究中检测氟喹诺酮类药物对肺炎链球菌临床耐药的预防作用,结果显示莫西沙星、左氧沙星抗菌谱广,而且MPC值较低,莫西沙星400 mg每日1次、左氧氟沙星500 mg每日1次的给药方案有望防止肺炎链球菌突变的发生,值得临床推广。
[1]马越,李景云,姚蕾,等.1999~2003年广东和辽宁地区大肠埃希菌和肺炎克雷伯菌临床分离株耐药性比较分析[J].临床药物治疗杂志,2005,3(2):46-52.
[2]GEORGE PA,LALITAGAURI MD.Determination of the mutant selection window for clindamycin,doxyeyc-line,linezolid,moxifloxacin and trimethoprim/sulfame-thoxazole against community-associated meticillin-resist-ant Staphylococcus aureus(MRSA)[J].Inter J Anti-rnicrob Agents,2010,35:45-49.
[3]JOSE AE,ALVARO SM.First characterization of fluoroquinolone resistance in Streptococcus suis[J].AntimicrobAgents Chemother,2007,51(2):777-782.
[4]DRLICAK.Astrategyforfighting antibioticresist-ance[J].ASM News,2001,67:27-33.
[5]张菁,郁基诚,施耀国,等.左氧氟沙星药代动力学/药效学研究[J].中华医学杂志,2005,85(27):1926-1932.
[6]夏昆华,周鲁,郝丽芬.喹诺酮类抗生素的研究进展[J].国外医药抗生素分册,2004,25(3),138-141.
[7]Berrylin J,Ferguson MD,et al.Short treatment durations for acute bacterial rhinosinusitis:Five days of gemifloxacin versus 7 days of gemifloxacin[J].Otolaryngol Head Neck Surg,2002,127(1):1-6.
[8]Kleinkauf N,Ackermann G,Schaumann R,et al.Comparative in vitro activities of gemifloxacin, other quino lones, and nonquinolone antimicrobials against obligately anaerobic bacteria[J].Antimicrob Agents Chemother,2001,45:1896-1899.
