植物乳杆菌ST-Ⅲ细菌素类抑菌活性的研究
2013-09-05季红吴正钧韩瑨周方方
季红,吴正钧,韩瑨,周方方
(乳业生物技术国家重点实验室,上海 200436)
乳酸菌是众多发酵食品的生物基础[1],食品中的乳酸菌不仅保持了原料中的营养成分,并且抑制了腐败菌及病原菌的滋长[2]。乳酸菌对腐败菌及病原菌的抑制作用可能依靠其代谢产物,比如有机酸(乳酸和醋酸),过氧化氢,双乙酰和细菌素[1-3]。其中,有些细菌素只能抑制同一细菌属中的某一种细菌,而有些细菌素却能广泛抑制革兰氏阳性菌[3-6]。近年,乳酸菌的这些功能引起了研究者们的广泛兴趣,很多工作集中在细菌素产生的分离及新的细菌素的提纯。然而,乳酸菌中产细菌素菌株的检出率仅为0.2%,因此,对于细菌素产生菌的分离筛选及新的细菌素的获得,需要研究大量食品样本[7]。
本文分析了本实验室保存的10余株乳杆菌对革兰氏阴性菌和革兰氏阳性菌的抑制和杀灭作用,其中,植物乳杆菌ST-III(CGMCC 0848)可以通过产生细菌素类的物质抑制和杀灭金黄色葡萄球菌10384和肠炎沙门氏菌54001。
1 料与方法
1.1 材料
1.1.1 菌种
植物乳杆菌ST-Ⅲ(Lactobacillus plantarumST-Ⅲ);干酪乳杆菌 LC2W(Lactobacillus caseiLC2W);植物乳杆菌 9-9(Lactobacillus plantarum9-9);短乳杆菌22-22(Lactobacillus brevis22-22);鼠李糖乳杆菌 Y37(Lactobacillus rhamnosusY37);本实验室保藏菌株(经初步鉴定均为乳杆菌):编号分别为 10、13、16、17、18;金黄色葡萄球菌10384(Staphylococcus aureus10384);肠炎沙门氏菌54001(Salmonella enteritis54001)。
1.1.2 培养基
MRS液体/固体培养基:德国Merck公司;营养琼脂及营养肉汤:上海国药集团化学试剂有限公司。
1.1.3 试剂
乳酸、乙酸钠、冰乙酸、NaOH、NaCl:分析纯,上海国药集团化学试剂有限公司;过氧化氢酶、胰蛋白酶、蛋白酶K(20 mg/mL):美国Sigma公司。
1.1.4 仪器
SPECORD 205分光光度计:德国jena公司;J-30I离心机:美国Beckman公司;0.22 μm微孔滤膜:美国Millipore公司;BUG厌氧培养箱:法国Jouan公司。
1.2 方法
1.2.1 样品的制备
无细胞发酵上清液(CFS):新鲜培养菌株以3%的接种量接种于100 mL MRS液体培养基,37℃培养18 h。发酵液8 000 r/min离心20 min,上清液用0.22 μm膜过滤得无细胞上清液,4℃保存备用。
指示菌菌悬液:挑取新鲜培养的金黄色葡萄球菌10384或肠炎沙门氏菌54001单菌落接种于1 mL营养肉汤中,37℃培养12 h,发酵液以15 000 r/min离心5 min收集菌体,菌体用0.85%无菌生理盐水洗涤两次,用0.85%无菌生理盐水制备成OD600=0.7的菌悬液,0℃~4℃保存备用
含菌悬液培养基:取1 mL金黄色葡萄球菌10384菌悬液于100 mL营养琼脂,混合均匀,为样品A;取1 mL沙门氏菌54001菌悬液于100 mL营养琼脂,混合均匀,为样品B;按上述方法分别将1 mL两株菌菌悬液与100 mL营养肉汤混合,即为样品C(含金黄色葡萄球菌10384)及样品D(含沙门氏菌54001)。
MRS对照液:采用乳酸将无菌MRS液体调pH至乳酸菌发酵的终pH 4.0。
菌悬液样品:取1mL指示菌菌悬液(OD600=0.7)100 mL无菌生理盐水中,震荡均匀,即为菌悬液E(含金黄色葡萄球菌10384)及菌悬液F(含沙门氏菌54001)。
1.2.2 产细菌素乳酸菌的筛选
牛津杯法[8]:将样品A及样品B分别倾倒平板(每板10 mL),冷却后于适当位置放置2个牛津杯,分别加入100 μL待测CFS及空白对照液,37℃培养16 h。测量其抑菌圈大小,以待测液产生的抑菌圈半径大于MRS对照液的为有抑菌活性。
孔扩散法[8]:将样品A及样品B分别倾倒平板(每板15 mL),冷却后于适当位置打2个孔并挑出孔内营养琼脂,以少量空白营养琼脂封底,待封底凝固后,分别加入100 μL待测CFS及MRS对照液,37℃培养16 h。测量其抑菌圈大小,以待测液产生的抑菌圈半径大于MRS对照液的为有抑菌活性。
OD值法(复筛):分别取样品C及D 4.5 mL,一份加入0.5 mL待测CFS,另一份加入空白对照,37℃培养6 h测定OD值(600 nm)[16]。以待测CFS OD值小于其MRS对照液OD值的为有抑菌活性(对照液37℃恒温放置)。
1.2.3 代谢产物酶处理后的抑菌活性
取植物乳杆菌ST-ⅢCFS 5 mL 4份(其中一份不经处理,作为对照),分别加入过氧化物酶、胰蛋白酶、蛋白酶K,使其终浓度均为0.5 mg/mL,分别用2 mol/L的NaOH调至所用酶最适pH,37℃下孵育1 h,用2 mol/L的HCl调pH至CFS原始pH,参照牛津杯法[8]测定其抑菌活性。
1.2.4 抑菌活性研究
取0.5 mL CFS分别与4.5 mL样品C或者样品D混合均匀,以MRS对照液作为空白,于37℃分别培养2、4、6、8 h,测定 OD 值(600 nm)。
制备不同发酵时间的CFS(37℃培养6、8、12、24、32 h)。上述样品分别取0.5 mL与4.5 mL样品C或者样品D混合均匀,以MRS对照液为空白,于37℃下培养一定时间(参照上述实验结果),并测定OD值(600 nm)。
以最佳发酵时间制备CFS(参照上述实验结果),采用 1 mol/L的 NaOH 分别调 pH 至 4.0、4.5、5.0、5.5、6.0、6.5、7.0,分别取0.5 mL与4.5 mL样品C或者样品D混合均匀,以相应pH的MRS为对照液,于37℃下培养上述实验所确定最佳作用时间测定OD值(600 nm)。
分别对CFS及其相应pH的MRS进行倍半稀释,取0.5 mL与4.5 mL样品C或者样品D混合,于37℃下培养最适时间测定OD值(600 nm)。
1.2.5 杀菌作用的测定
CFS作用不同时间的杀菌性:取0.5 mL CFS(以乳酸调节pH的MRS为对照),加入4.5 mL菌悬液E或F,25℃放置30、60 min后,菌落计数(30℃,48 h)。
CFS在指示菌生长过程中的杀菌性:取0.5 mL CFS(对照同上),加入4.5 mL菌悬液培养基C或D,25℃放置30、60 min,菌落计数(30℃,48 h)。
2 结果与分析
2.1 产细菌素乳酸菌的筛选
为排除实验中有机酸对抑菌作用的干扰,以相应pH的MRS作为待测液的对照。同时,选取金黄色葡萄球菌和沙门氏菌分别作为革兰氏阴性菌和革兰氏阳性菌的代表,以孔扩散法和牛津杯法对所给菌株进行抑菌性的初筛,旨在寻求对两株指示菌均有抑菌作用且作用较显著的乳酸菌菌株。孔扩散法及牛津杯法抑菌活性结果见表1及表2,图1则列举了LC2W及ST-Ⅲ孔扩散法对金黄色葡萄球菌10384的抑菌作用。
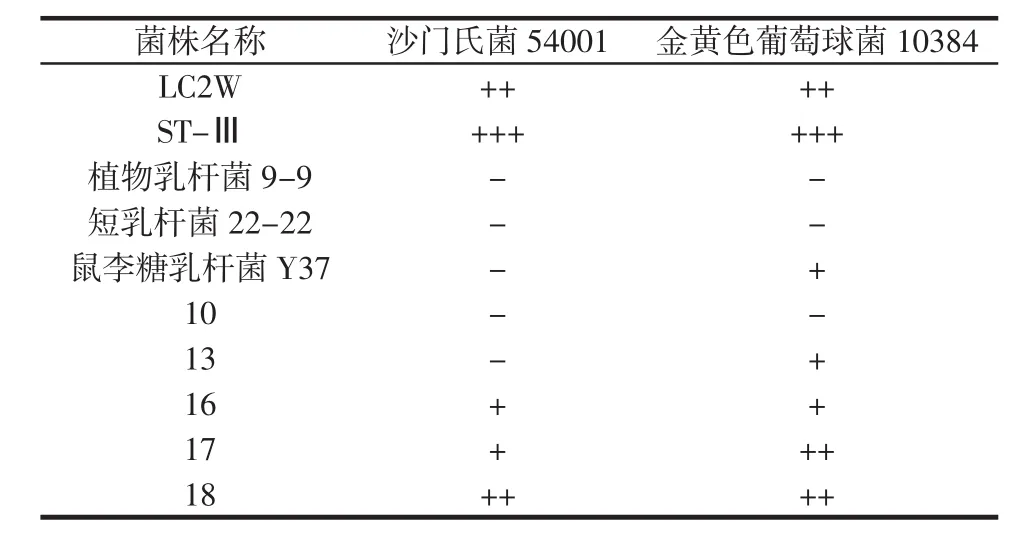
表1 10株乳酸菌孔扩散法的抑菌活性Table 1 Inhibition of S.aureus 10384 and S.enteritis 54001 by Lactobacillus with well diffusion method

表2 10株乳酸菌牛津杯法抑菌活性Table 2 InhibitionofS.aureus10384andS.enteritis54001by Lactobacilluswithdiscdiffusionmethodutilizingstainlessoxfordcups
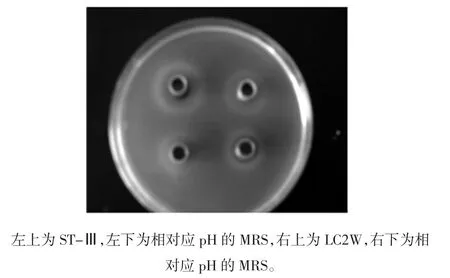
图1 孔扩散法对金黄色葡萄球菌10384的抑菌活性Fig.1 Inhibition of S.aureus 10384 by ST-Ⅲ&LC2W with well diffusion method
由表 1和表 2可见,LC2W、ST-Ⅲ、17、18对沙门氏菌54001和金黄色葡萄球菌10384均具有显著的抑菌作用,尤以植物乳杆菌ST-Ⅲ对这两株菌的抑制作用为最强。
为进一步确证这几株乳酸菌菌株对两株指示菌的抑制作用,采用了OD值法验证其抑菌效率,4株乳酸菌对两株指示菌的抑制作用见图2及图3。

图2 OD值法对沙门氏菌54001的抑制作用Fig.2 Inhibition of S.enteritis 54001 by Lactobacillus

图3 OD值法对金黄色葡萄球菌10384的抑制作用Fig.3 Inhibiton of S.aureus 10384 by Lactobacillus
由图2及图3可知,4株复筛菌株对2株指示菌的抑菌作用,与上述孔扩散法及杯碟法的结果一致,17及18菌株的作用弱于LC2W及ST-Ⅲ,对沙门氏菌54001及金黄色葡萄球菌10384抑制作用最强的仍然是植物乳杆菌ST-Ⅲ,且其对金黄色葡萄球菌10384的抑菌性大于沙门氏菌54001。因此,后续试验选取ST-Ⅲ进行深入研究。
2.2 代谢产物酶处理后的抑菌活性
乳酸菌在生长代谢过程中,有可能产生过氧化氢,从而抑制细菌的生长。将植物乳杆菌ST-ⅢCFS用过氧化氢酶处理,并对比原发酵液的抑菌活性,旨在排除该过氧化氢带来的抑菌活性,结果见表3。

表3 代谢产物酶处理后的抑菌活性Table 3 Inhibitory of S.aureus 10384 and S.enteritis 54001 after enzymolysis
在排除过氧化氢的基础上,将植物乳杆菌ST-ⅢCFS采用相关蛋白酶处理,若其抑菌活力下降,则可认为该乳杆菌在大写过程中产生了蛋白类抑菌物质,该结果同样见表3。
植物乳杆菌ST-ⅢCFS经过氧化物酶处理后,对金黄色葡萄球菌10384的抑菌圈相差不大,对肠炎沙门氏菌54001的抑菌圈略有下降,可见该菌株发酵液中主要抑菌物质不是过氧化氢,另有其他物质。经蛋白酶K及胰蛋白酶处理的植物乳杆菌ST-ⅢCFS,与对照相比,对肠炎沙门氏菌54001及金黄色葡萄球菌10384的抑制作用均有明显下降。可见发酵产物中的抑菌物质对蛋白酶比较敏感,由此可判定抑菌物质中含有蛋白成分,即细菌素。
2.3 指示菌及待测菌株的生长曲线
指示菌在营养肉汤中生长,在不加任何抑菌物质的情况下,于不同时间段下测定OD值(λ=600 nm)。植物乳杆菌ST-Ⅲ在发酵的不同时间测发酵液pH,以此判断生长程度结果见图4、图5。
由图4可知,指示菌在8 h时进入生长的稳定期,已生长完全,所以选择发酵8 h用作实验。由图5可知ST-Ⅲ在生长12 h时进入生长稳定期,到36 h时pH已经比较低,而有机酸对实验的干扰比较大,因此选择发酵12 h用作实验。
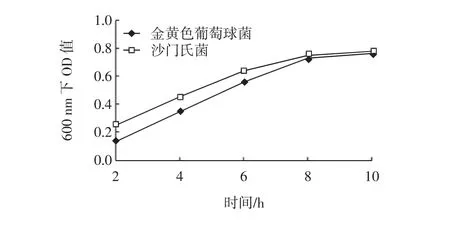
图4 指示菌生长曲线图Fig.4 Growth of S.aureus 10384 and Salmonella enteritis 54001

图5 ST-Ⅲ不同发酵时间的pH变化Fig.5 pH change of L.plantarum ST-Ⅲ
2.4 抑菌活性的测定
2.4.1 无细胞发酵上清液对两株指示菌作用不同时间的抑菌活性
细菌素的产生除了与菌株自身性质有关外,培养基成分及培养时间对细菌素的产生也有很大影响。培养基只有在一定的培养时间满足细菌生长的前提下,才能保证细菌素的大量产生和分泌[9]。本实验用发酵12 h的ST-Ⅲ无细胞发酵上清液与指示菌一起培养,在不同时间段测定OD值(600 nm),根据以下公式得出不同时间段的抑菌活性:抑菌率(%)=(对照MRS的OD值-无细胞发酵上清液的OD值)/对照MRS的OD值×100%[10],见图 6。

图6 发酵12 h所得无细胞上清液作用不同时间的抑菌活性Fig.6 Relationship between inhibition and fermentation time
由图6可知,随着时间的增长抑菌率呈上升的趋势,在8 h抑菌效果最好,而指示菌生长曲线显示8 h时指示菌已经生长成熟,因此选用发酵8 h的指示菌作为实验样本。
2.4.2 植物乳杆菌ST-Ⅲ在不同pH及不同发酵时间下对两株指示菌的抑菌活性
植物乳杆菌ST-Ⅲ在生长12 h时进入生长稳定期,但随着生长时间的增加,pH逐渐降低,存在乳酸的影响,因此以相应pH的MRS为对照排除乳酸的影响来研究不同发酵时间的无细胞上清液的抑菌活性,结果见图7。而随着发酵时间的延长,植物乳杆菌ST-Ⅲ的发酵液pH逐渐降低,为进一步研究pH变化对于抑菌活性的影响,人为将CFS调pH至4.0、4.5、5.0、5.5、6.0、6.5、7.0,分别测定抑菌活性,试验结果见图8。
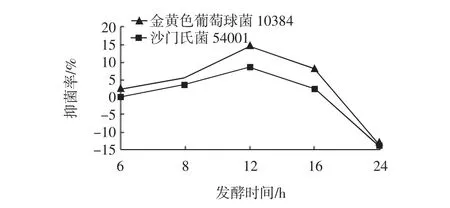
图7 发酵不同时间的无细胞上清液的抑菌活性Fig.7 Relationship between CFS of different fermentation time and inhibitory activity
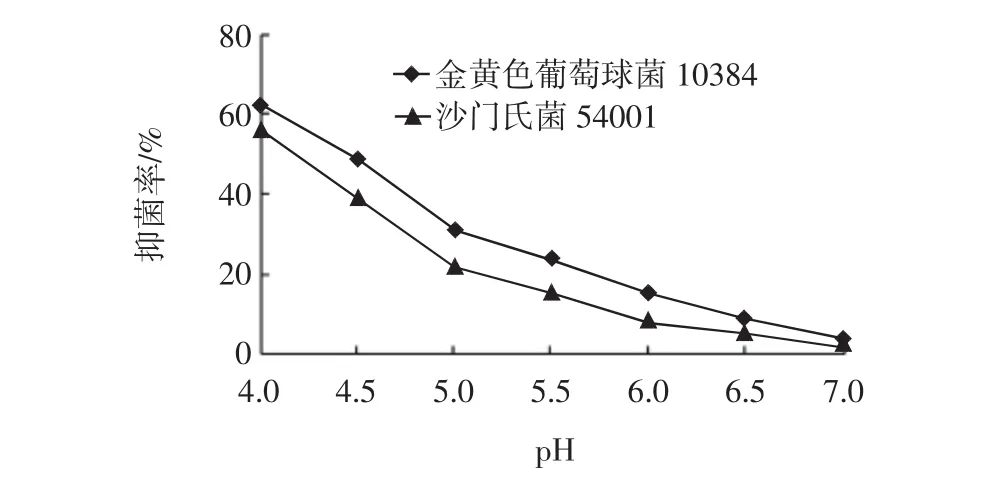
图8 不同pH下无细胞发酵上清液的抑菌活性Fig.8 Relationship between pH and inhibitory activity
由图7可知,植物乳杆菌ST-Ⅲ发酵12 h的抑菌活性最强,且对金黄色葡萄球菌的抑菌作用大于沙门氏菌,6 h到12 h抑菌率呈逐渐上升之势,而24 h时完全被乳酸的作用所掩盖。因此选用发酵12 h进行下一步的实验。
由图8可知,随着pH的上升,抑菌率呈下降的趋势,当pH达到7时,几乎没有抑菌活性,这说明ST-Ⅲ所产生的乳酸菌素在酸性或弱酸性条件下稳定,并能保持较高的抑菌活性。这与报道中许多乳酸菌产生的细菌素在低pH下具有较强的抑菌活性一致,其原因可能是pH环境会使细菌素的蛋白质结构构象发生变化,因而引起抑菌活性的变化 。另外在pH 6.0时仍有较显著的抑菌活性也可证明抑菌物质除了有机酸外,还有其他,即为乳酸菌素。
2.4.3 倍半稀释下无细胞发酵上清液对两株指示菌的抑菌活性
将无细胞发酵上清液进行倍半稀释,加入量不变,研究其具有抑菌活性的最低浓度,分别见图9及图10。

图9 不同pH倍半稀释对金黄色葡萄球菌的抑菌活性Fig.9 Inhibiton loss of S.aureus10384 due to concentration
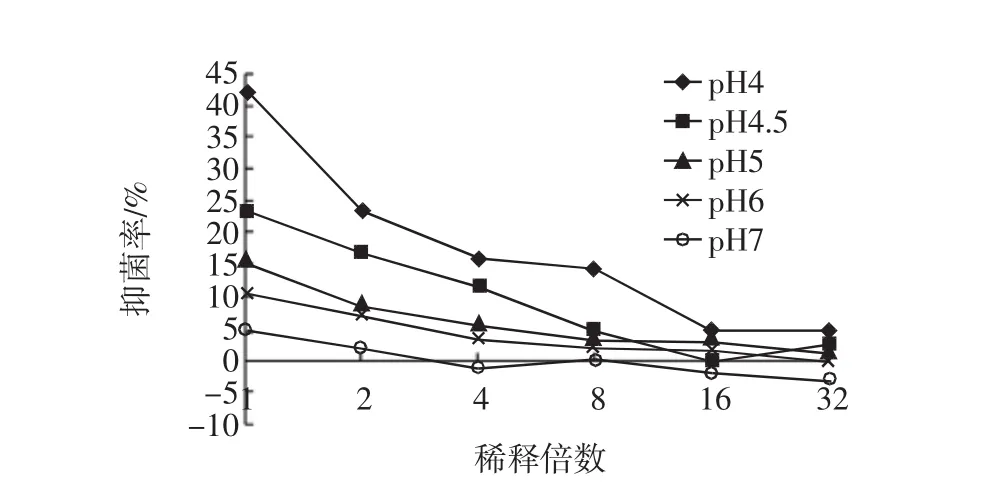
图10 不同pH倍半稀释对沙门氏菌的抑菌活性Fig.10 Inhibition loss of S.enteritis 54001 due to concentration
从不同pH的倍半稀释结果可以看出,不同pH植物乳杆菌ST-Ⅲ的CFS倍半稀释液对两株指示菌的抑菌作用变化趋势一致。在低pH,即1/2浓度,甚至有些1/4浓度的抑菌效果都较显著,1/8浓度时,抑菌效果不显著。对于高pH,其原样本身的抑菌率就不高,浓度稀释后抑菌效果更不显著,甚至接近于0。综上,乳酸菌素对指示菌的抑制作用不能低于某一浓度,否则即使在酸性条件下,抑菌作用也不显著。
2.5 植物乳杆菌ST-Ⅲ对两株指示菌的杀菌性研究
综合抑菌性实验的结果可知,植物乳杆菌ST-Ⅲ的CFS对金黄色葡萄球菌10384及沙门氏菌54001的抑菌作用显著,尤其是对沙门氏菌54001,然而其抑菌作用是抑制指示菌的生长还是能杀灭指示菌仍不得而知,于是运用平板计数法对ST-ⅢCFS的杀菌性进行初步研究。并且运用营养肉汤作为悬浮液研究CFS对指示菌生长过程中的杀菌性。金黄色葡萄球菌10384及肠炎沙门氏菌54001在生理盐水悬浮液中及在营养肉汤生长过程中的存活率分别见图11及12。

图11 金黄色葡萄球菌10384的存活率Fig.11 Survival rate of S.aureus 10384
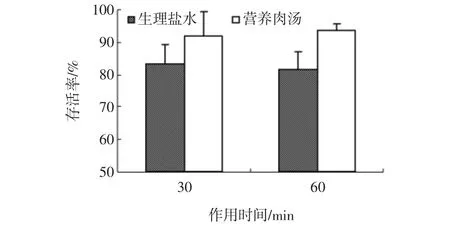
图12 肠炎沙门氏菌54001的存活率Fig.12 Survival rate of S.enteritis 54001
由图11可知,植物乳杆菌ST-Ⅲ的CFS无论是在生理盐水还是在营养肉汤中,都对金黄色葡萄球菌10384有一定的杀菌作用。在生理盐水中的杀菌作用强于营养肉汤中。这是由于营养肉汤存在的情况下,金黄色葡萄球菌仍然具有生长繁殖所需的营养。随着作用时间的延长,金黄色葡萄球菌10384在生理盐水中的存活率下降,而在营养肉汤中的存活率提高,这可能是由于其生长速率大于其死亡速率。
图12可知,肠炎沙门氏菌54001在生理盐水及营养肉汤中的存活率趋势与金黄色葡萄球菌10384一致。但其在生理盐水及在营养肉汤生长过程中的存活率均高于金黄色葡萄球菌,可见,植物乳杆菌ST-Ⅲ的CFS对肠炎沙门氏菌54001的杀菌效率低于对金黄色葡萄球菌10384的杀菌效率。这与上述实验结果显示的植物乳杆菌ST-Ⅲ的CFS对金黄色葡萄球菌10384的抑菌作用略高于肠炎沙门氏菌54001一致。
3 结论
上述实验结果表明,植物乳杆菌ST-Ⅲ的发酵产物对金黄色葡萄球菌10384及肠炎沙门氏菌54001均有不同程度的抑制作用,随着作用时间的延长,抑菌率呈上升趋势,8 h时抑菌效果最好,且对金黄色葡萄球菌10384的抑菌作用高于肠炎沙门氏菌54001。通过采用过氧化氢酶、胰蛋白酶、蛋白酶K处理,与空白MRS对比抑菌活性,排除了产物中过氧化氢的抑菌作用,并证实抑菌成分中含有蛋白类产物。通过采用乳酸等有机酸将空白MRS调pH至发酵产物相同,排除了有机酸对两株指示菌的抑菌作用,进一步证实该菌株所产抑菌物质为细菌素。植物乳杆菌ST-Ⅲ所产乳酸菌素在酸性或弱酸性条件下稳定,并能保持较高的抑菌活性,随着pH的上升,抑菌率呈下降趋势,pH为7时,几乎无抑菌活性。植物乳杆菌ST-Ⅲ所产乳酸菌素对两株指示菌的抑菌作用呈现一定的浓度要求,1/4浓度时效果仍显著,但1/8浓度时,抑菌效果已不明显。金黄色葡萄球菌10384及肠炎沙门氏菌54001分别是革兰氏阴性菌及革兰氏阳性菌两个代表菌株,而植物乳杆菌ST-Ⅲ对两者均有显著的抑菌作用。可见,植物乳杆菌ST-Ⅲ所产乳酸菌素是一类具有广谱作用的细菌素。植物乳杆菌ST-ⅢCFS杀菌作用的初步研究表明,其对金黄色葡萄球菌10384及肠炎沙门氏菌54001均有一定的杀菌作用,但不是很强烈。目前,作为新资源菌株植物乳杆菌ST-Ⅲ已批准可在食品中应用,若能在应用该菌株加工食品的过程中,综合考虑该菌株的抑菌特性,不仅能增加相关食品的保藏特性,也有助于改善传统物理杀菌方法的强度,更好的保持食品营养价值。尽管植物乳杆菌ST-Ⅲ所产乳酸菌素的抑菌作用已初步探明,将其该项特性应用于食品加工,仍有很多工作需要研究。热加工作为食品加工最常用的方法,该菌株产物的热稳定性仍需深入探讨。而起到抑菌作用的细菌素,其主要物理、化学特性、结构等仍需进一步通过分离纯化来进行深入研究,这些工作将在今后的研究过程中进行。
:
[1]Lasagno M,Beoletto V,Sesma F,et al.Selection of bacteriocin producer strains of lactic acid bacteria from a dairy enviroment[J].Microbiologia,2002,25:37-44
[2]Matilla-Sandholm T,M Mättö J,Saarela M.LAB with health claiminteractions and interference withgastrointestinal flora[J].Int Dairy J,1999,9:25-35
[3]Ennahar S,Sashihara T,Sonomoto K,et al.Class IIa bacteriocins:biosynthesis,structure and activity[J].FEMS Microbiol Rev,2000,24:85-106
[4]Conventry M J,Gordon J B,Wilcock A,et al.Detection of bacteriocin of LAB isolated from food and comparison with pediocin and nisin[J].J Appl Microbiol,1997,83:248-258
[5]Garneau S,Martin N I,Vederas J C.Two-peptide bacteriocins produced by lactic acid bacteria[J].Biochimie,2002,84:577-592
[6]McAuliffe O,Ross R P,Hill C.Lantibiotics:structure,biosynthesis and mode of action[J].FEMS Microbiol Rev,2001,25:285-308
[7]Conventry MJ,Gordon JB,Wilcock A,et al.Detection of bacteriocin of LAB isolated from food and comparison with pediocin and nisin[J].J Appl Microbiol,1997,83:248-258
[8]张艾青,刘书亮,敖灵.产广谱细菌素乳酸菌的筛选和鉴定[J].微生物学通报,2007,34(4):753-756
[9]常峰,易奎星,刘小兰,等.类细菌素高产菌CFl0的筛选诱变及发酵条件的研究[J].食品科学,2006,27(1):143-147
[10]吴惠芬,毛胜勇,姚文,等.猪源乳酸菌产乳酸及其抑菌特性研究[J].微生物学通报,2005,32(1):79-84
[11]李悦,孙玉梅,杨红,等.产细菌素乳酸菌的筛选及其发酵特性[J].大连工业大学学报,2008(1):19-21
