HPV16感染与宫颈病变组织HDAC1和P21waf表达的关系
2013-09-05苗立业李秀伟
苗立业,邢 军,李秀伟
(1 河北联合大学,河北唐山 063000;2 河北联合大学附属医院)
研究表明,高危型人乳头瘤病毒(HPV)感染是宫颈上皮内瘤样病变(CIN)和宫颈癌的主要致病因素,宫颈鳞癌患者HPV16感染较为多见[1]。组蛋白去乙酰化酶1(HDAC1)是表观遗传调控中的关键酶,能够介导核小体的结构改变和调节基因表达,参与细胞周期的进程和分化。细胞周期调控抑癌基因P21waf作为细胞周期素依赖性激酶抑制因子之一,可通过调节细胞周期进程参与细胞的生长、增殖、分化和衰老。2008年6月~2011年6月,我们对不同病变宫颈组织中HPV16感染情况及其与HDAC1和P21waf的关系进行了研究。现报告如下。
1 资料与方法
1.1 临床资料 选择华北煤炭医学院附属医院病理科2008年6月~2011年6月存档的宫颈病变组织蜡块110份,取样时患者年龄25~72岁、中位年龄44.5岁。取样前均未经放疗和化疗。均由病理科医师诊断及确定组织学分级,其中慢性宫颈炎20份(宫颈炎组);CIN 70份,包括CINⅠ22份(CINⅠ组)、CINⅡ24份(CINⅡ组)、CINⅢ24份(CINⅢ组);宫颈癌20份(宫颈癌组)。主要试剂:HDAC1兔抗体人多克隆抗体购于北京博奥森生物技术有限公司;P21waf鼠抗人单克隆抗体购于北京中杉金桥生物技术有限公司;HPV16型引物由上海生工生物技术有限公司合成。HPV16引物序列:上游为5'-TCAAAAGCCACTGTGTCCTG-3',下游为 5'-CGTGTTCTTGATGATCTGCA-3',长度为 120 bp。
1.2 相关指标测定
1.2.1 HDAC1、P21waf表达 采用免疫组化 SP法,按试剂盒说明书操作,DAB光镜下控制染色,苏木素复染,盐酸酒精分化,干燥中性树胶封片。以PBS代替一抗为阴性对照。HDAC1阳性为宫颈异常鳞状上皮细胞核和少量细胞质出现棕黄色颗粒,P21waf阳性为细胞核出现棕黄色颗粒。光镜下每张切片随机观察5个有代表性的视野,计数阳性细胞并观察染色强度,根据阳性细胞百分率及染色强度计分。阳性细胞<5%为0分,5%~25%为1分,26%~49%为2分,≥50%为3分。无着色为0分,弱着色为1分,中等着色为2分,强染色为3分。两项评分相加为0~1分判为阴性(-),2分为弱阳性(+),3~4分为中度阳性(++),5~6分为强阳性(+++),阳性细胞数 <5%的无论染色强度均判为(-)。
1.2.2 HPV16 DNA检测 采用常规方法提取组织切片中的 HPV DNA,取 25 μL 2 × PCR Master,1 μL DNA模板,上下游引物各1 μL及22 μL去离子水放入PCR反应管中,通过变性、退火、延伸、循环进行PCR扩增,扩增后PCR产物行琼脂糖凝胶电泳,染色。取5 μL PCR扩增产物,于2%琼脂糖凝胶中电泳,与DNA标准相对分子质量(600 bp)进行对照,120 bp处出现条带者为HPV16 DNA阳性。统计阳性率。
1.3 统计学方法 采用SPSS16.0软件,行计数资料的χ2检验和等级资料的秩和检验。相关性用Spearman等级相关分析。P≤0.05为差异有统计学意义。
2 结果
2.1 HPV16 DNA阳性率 宫颈炎组、CINⅠ组、CINⅡ组、CINⅢ组、宫颈癌组HPV16 DNA阳性率分别为10%(2/20)、36.4%(8/22)、50.0%(12/24)、66.7%(16/24)、75.0%(15/20),CINⅠ组、CINⅡ组、CINⅢ组、宫颈癌组阳性率均高于宫颈炎组(P均<0.05),CINⅢ组、宫颈癌组阳性率均高于CINⅠ组(P 均 <0.05)。
2.2 HDAC1、P21waf表达 宫颈炎组、CINⅠ组、CINⅡ组、CINⅢ组和宫颈癌组HDAC1表达逐渐增强,表达强度与病理级别呈正相关(r=0.529,P<0.01)。宫颈炎组、CINⅠ组、CINⅡ组、CINⅢ组及宫颈癌组P21waf表达逐渐降低,表达强度与病理级别呈负相关(r=-0.385,P <0.01)。见表1。
2.3 HPV16感染与HDAC1、P21waf的关系 各组HDAC1表达与HPV16感染均呈正相关(r=0.510,P <0.05),P21waf表达与 HPV16 感染呈负相关(r=-0.468,P <0.05)。见表2。
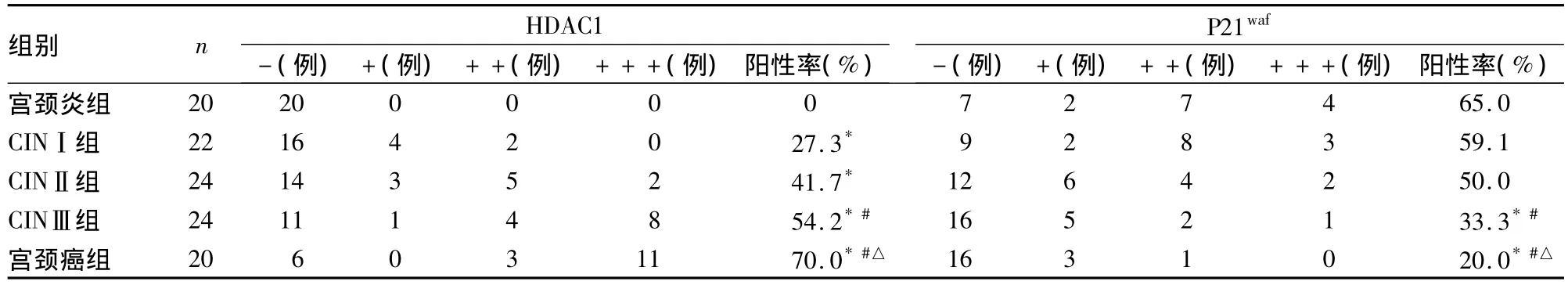
表1 各组 HDAC1、P21waf表达
2.4 HDAC1与 P21waf的关系 各组 HDAC1的表达强度与 P21waf呈负相关(r=-0.349,P <0.05)。见表3。
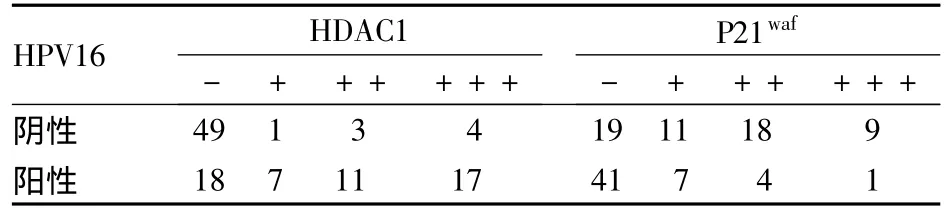
表2 HPV16感染与HDAC1、P21waf的关系(例)
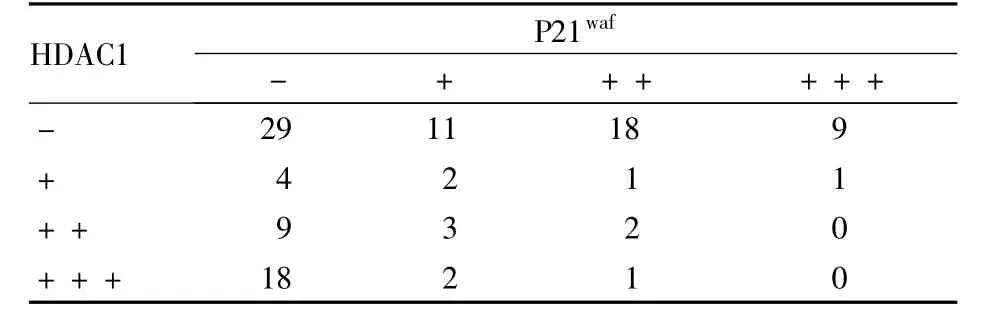
表3 HDAC1与P21waf表达的关系(例)
3 讨论
我国是宫颈癌的高发区,并且有年轻化趋势[2]。研究表明HPV16、18与宫颈癌及癌前病变关系密切,在世界范围内,50%以上的宫颈癌与HPV16感染有关[3]。HPV慢性持续感染后,其E6、E7癌基因整合入宿主细胞基因组中,产生的E6、E7癌蛋白可引起遗传基因改变,如癌基因激活、抑癌基因失活和表观遗传学组蛋白修饰改变(如组蛋白去乙酰化等),导致肿瘤的发生。本研究发现,HPV16在宫颈炎组、CINⅠ组、CINⅡ组、CINⅢ组和宫颈癌组中的感染率分别为10%、36.4%、50%、66.7%、75%,提示随着宫颈病变的加重,HPV16的感染率逐渐增加,与黄顺玲等[4]的研究结果一致。
HDAC1能够移去组蛋白Lys残基上的乙酰基,恢复组蛋白的正电性,增加组蛋白与DNA之间的吸引力,使启动子不容易接近DNA上的转录调控元件,从而抑制DNA转录。HDAC1除了移去组蛋白的乙酰基外,还可移去非组蛋白上的乙酰基,从而使部分非组蛋白失去其原有的肿瘤抑制功能,例如移去P53蛋白、Rb蛋白、P21蛋白等的乙酰基可导致其功能丧失,引起细胞周期调控紊乱,致使肿瘤发生、进展。目前研究显示,HDAC1在肿瘤细胞中高表达可明显增加肿瘤细胞的增殖能力,并且可以使肿瘤细胞的侵袭和移行能力明显增强[5]。本研究发现,宫颈炎组、CINⅠ组、CINⅡ组、CINⅢ组和宫颈癌组HDAC1的表达强度逐渐增强,且HDAC1蛋白表达强度与病变级别呈正相关,提示HDAC1与宫颈癌的发生、发展密切相关,可能作为宫颈癌演进过程中的分子标记物[6]。
HDAC和SP1竞争与P21基因启动子的结合,能够导致P21waf蛋白转录抑制,从而引起肿瘤的发生和进展,其抑制剂可以抑制HDAC和SP1竞争与P21基因启动子的结合,促进P21waf蛋白转录,抑制肿瘤的发生。目前已有研究证明,HDAC抑制剂在结肠癌、胃癌、乳腺癌、肝癌、胰腺癌中可能通过调节P21waf蛋白的转录和表达,抑制肿瘤的发生和发展。王慧等[7]将HDAC抑制剂SAHA作用于体外培养的宫颈癌细胞株Siha,发现SAHA在体外能有效抑制Siha生长,且对正常细胞无明显影响,其抗肿瘤机制之一可能是通过上调P21waf蛋白表达水平和引起G0/G1期细胞周期阻滞实现的。研究发现P21waf在宫颈病变中扮演的是肿瘤抑制基因的角色,且P21waf在宫颈癌中的失活是通过HPV16感染后癌基因E7发挥作用的[8]。本研究发现,在宫颈炎组、CINⅠ组、CINⅡ组、CINⅢ组及宫颈癌组,P21waf阳性表达率逐渐减低,表达强度与病变级别呈负相关,结合HDAC1与不同病变宫颈组织的病理级别呈正相关,说明在宫颈病变中HDAC1的高表达可能抑制P21waf蛋白的表达,促进宫颈癌的发生和进展。
综上所述,HPV16持续感染后,引起HDAC1高表达和P21waf的低表达,说明HPV16感染有可能是通过提高HDAC1水平、抑制P21waf的表达,导致宫颈癌的发生发展。三者联合检查能提高宫颈癌筛查的阳性率。
[1]唐俭,唐孝亮,李秀荣.586例健康妇女HPV16、18型感染情况分析[J].检验医学与临床,2009,6(18):248.
[2]杨小风,王雅莉,刘惠娜,等.两种宫颈锥切术治疗子宫颈上皮内瘤变效果观察[J].中国综合临床,2010,26(10):1093.
[3]Smith JS,Lindsay L,HootsB,et al.Human papillomavirus type distribution in invasive cervical cancer and high-grade cervical lesions:a meta-analysis update[J].Int J Cancer,2007,121(3):621-632.
[4]黄顺玲,王晓春,陈卫群.宫颈组织临床样本HPV16-E6的阳性率检测[J].中国现代医学杂志,2006,16(24):3720-3722.
[5]Jin KL,Pak JH,Park JY,et al.Expression profile of histone deacetylases 1,2 and 3 in ovarian cancer tissues[J].J Gynecol Oncol,2008,19(3):185-190.
[6]Huang BH,Laban M,Leung CH,et al.Inhibition of histone deacetylase 2 increases apoptosis and p21Cip1/WAF1 expression,independent of histone deacetylase 1[J].Cell Death Differ,2005,12(4):395-404.
[7]王慧,徐赛.组蛋白去乙酰化酶抑制剂联合顺铂宫颈癌细胞化疗增敏作用的研究[J].现代妇产科进展,2011,20(2):105-109.
[8]Shin MK,Balsitis S,Brake T,et al.Human papillomavirus E7 oncoprotein overrides the tumor suppressor activity of p21Cip1 in cervical carcinogenesis[J].Cancer Res,2009,15,69(14):5656-5663.
