探究馒头用酸面团中自然发酵种的最初来源
2013-09-04胡青平
张 红,胡青平
(山西师范大学生命科学学院,山西临汾041004)
馒头是我们北方日常生活中常见的一种主食。传统的制作方法是在面粉中加入一定量的水和酸面团然后和成面团,再经过发酵,揉制,成型,醒发,最后通过汽蒸熟化定形而成的一种面制食品[1]。酸面团是由谷物、水、发酵微生物经过发酵制成的一种面制品,它在发酵面食中起着非常重要的作用。它不仅可以改善面团的质构、风味、口感等,而且可以防止因真菌和细菌引起的腐败[2]。随着社会的进步,人们对馒头的质量也提出了更高的要求,替代品的作用效果远不及传统的酸面团,不能满足人们的需要,因此酸面团再度受到极大的关注[3]。目前,国外学者已分离、筛选出了酸面团中具有代表性的菌种,并研究了其特性,且研制出了一系列的产品来代替传统的酸面团[2]。而我国对于酸面团的研究还主要集中在风味物质及其发酵微生物的分离纯化等方面,如胡丽花等[3]论述了多菌种混合发酵可提高有机酸、醇类、酯类等风味物质;丁长河等[4]通过对馒头的咀嚼性,胶性,凝聚性,硬度等方面对老酵头发酵的馒头品质与工厂化生产进行了比较,证明了使用老酵头制作的馒头品质优于工厂化生产的馒头;张庆等[5]通过对4类面包的风味物质进行研究,考察了植物乳杆菌燕麦酸面团发酵剂及其冻干工艺对面包风味的影响;苏东海[6]对酸面团中的酵母进行了分离纯化等。但是对于酸面团中发酵微生物的来源及其对面团发酵速度的影响等方面还鲜有报导。本文主要探究发酵微生物的最初来源,并对分离到的酵母菌和乳酸菌做了发酵优化实验,为提高面团发酵速度提供了理论指导。
1 材料与方法
1.1 材料与仪器
面粉选用中筋粉 购于市内;PDA培养基[6]:马铃薯200g,蔗糖20g,琼脂20g,水 1000mL;MRS 培养基[7]:蛋白胨 10g,牛肉膏 10g,酵母膏 5g,葡萄糖20g,吐温 80 1.0mL,K2HPO42g,醋酸钠 5g,柠檬酸二铵 2g,MgSO4·7H2O 0.58g,MnSO4·4 H2O 0.25g,蒸馏水1000mL,pH6.2~6.6。
722S可见光分光光度计 上海菁华科技有限公司;HC-TP-12型架盘天平 生产厂家或产地;85-2恒温磁力搅拌器 国华;pHS-3C酸度计 金昌仪器;显微镜 OLYMPUS;YXQ-LS-SⅡ高压蒸汽灭菌锅 上海市博迅实业有限公司医疗设备厂;101-3BS电热鼓风干燥箱 金坛市荣华仪器制造有限公司。
1.2 实验方法
1.2.1 初探酸面团中自然发酵微生物的最初来源经121℃高压蒸汽灭菌锅内20min制备无菌面粉和无菌水适量备用。取面粉20.0g,水10.0mL揉捏至表面光滑且内部均匀没有硬块为宜[7],经保鲜膜包裹,放入无菌培养皿中,31℃培养箱中醒发48h,观察酸面团的感官指标并测定酸面团的pH。具体实验设计按照表1所示。并从发酵后面团体积、气味、粘度、气泡和pH出发设置了0~5分5个分值的感官评价表(见表2)来比较各实验组的发酵程度,分值越高发酵越明显。
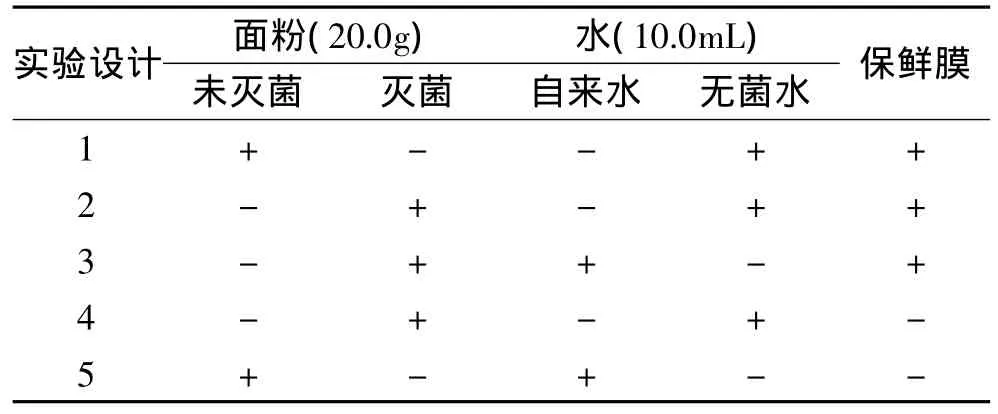
表1 初探酸面团中自然发酵微生物最初来源的实验设计Table 1 The experimental design of the original sources of natural fermentation microorganisms in sour dough

表2 面团发酵情况评分标准Table 2 The scoring criteria of the dough fermentation conditions
1.2.2 自然发酵酸面团中活性微生物的分离纯化 称取10.0g发酵面团,放入盛有90mL无菌水的烧杯中,并用磁力搅拌器搅拌30min后静止10min。分别取上清液0.2mL涂布于PDA培养基和MRS培养基中31℃培养72h。对PDA培养基上的典型的酵母菌菌落进行镜检,并采用平板划线法继续分离纯化;对MRS培养基上的典型的乳酸菌菌落进行镜检、革兰氏染色、过氧化氢酶等实验,凡是革兰氏阳性菌、过氧化氢酶阴性的菌株,采用平板划线法进行分离纯化。
1.2.3 酵母菌和乳酸菌的发酵酸面团 制备酵母菌和乳酸菌菌液各100mL,并测得它们在600nm时的OD值分别为1.740、1.630。面团的基本配方为面粉40g、菌液和水共20mL。
在面团基本配方的基础上,添加的酵母菌菌液∶乳酸菌菌液∶水的比例为 5∶0∶15、10∶0∶10、20∶0∶0、0∶5∶15、0∶10∶10、0∶20∶0、5∶15∶0、10∶10∶0、15∶5∶0、0∶0∶20。按上述方法和制的面团并等分成三个小面团,并揉捏成直径为4.5cm的扁圆形,分别放入无菌培养皿中,并用10mL的自来水将面团表面浸湿。放入31℃的恒温箱中醒发4h。
1.2.4 酸面团中pH的测定 用洁净的小刀分别切取各个实验组的发酵面团3.0g,放入盛有30mL蒸馏水的小烧杯中,用玻璃棒将面团搅碎后用磁力搅拌器搅拌10min使其充分搅匀,静置10min后用酸度计测定该混合液的 pH[7]。
1.2.5 酸面团直径的测定 将1.2.3中放置面团的培养皿取出,用刻度尺测量面团与培养皿上下皿盖接触面的直径,分别记作D1、D2。
2 结果与讨论
2.1 酸面团中活性微生物的来源
根据酸面团的制作工艺,推测酸面团的自然发酵种可能来源于面粉、水或空气中。为了探究其主要来源,设计了表1的实验,并通过表2赋予分值来比较实验组的发酵程度。具体结果见图1、表3。
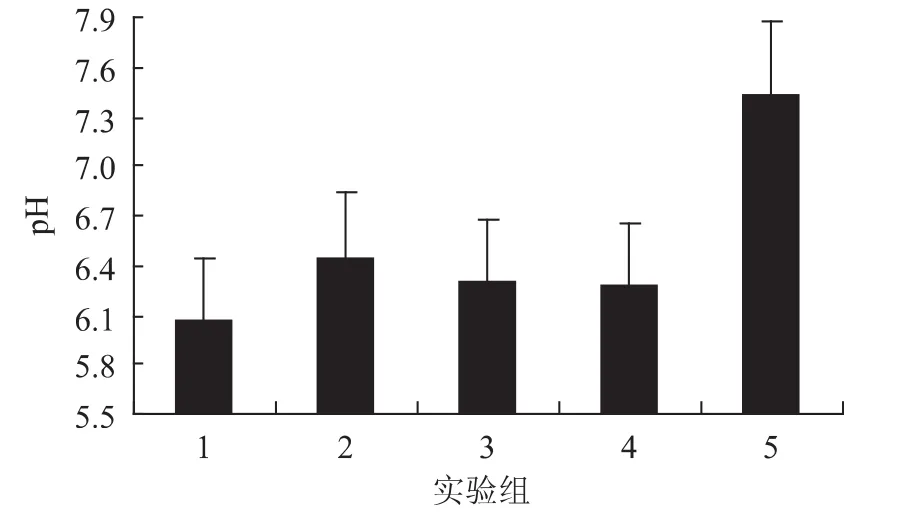
图1 酸面团的pH变化Fig.1 Changes of pH of sour dough
从图1和表3可知实验组1发酵效果最为明显。这是因为面粉本身含有淀粉酶会将淀粉转化为葡萄糖,进而可被酵母菌和乳酸菌等发酵微生物利用。而无菌面粉是面粉经过高压蒸气灭菌后所得,其面粉中酶失活,不能将淀粉分解为葡萄糖,因此不能被酵母菌和乳酸菌利用。此外,空气中含有紫外线,它具有强烈的杀菌作用,并且空气中没有微生物生长繁殖所必需的营养物、充足的水分以及其他条件。因此,它不适宜微生物的生存。水中没有供酵母菌和乳酸菌利用的营养物质,因此含量也很少。由图1可知实验2、3、4的pH下降也很明显,这是因为保鲜膜上附着着一些霉腐微生物,这些微生物会利用面粉中的淀粉产酸。由图1和表3可知,酸面团中的发酵微生物主要来自面粉当中,其次是空气和水当中。

表3 48h后面团的变化情况Table 3 Changes of sour dough after 48h
2.2 酸面团中活性微生物的分离纯化及初步鉴定
将分离到的酵母菌和乳酸菌分别标记为Yzh和Rzh。
通过图2可看出Yzh的菌落大而突起,呈乳白色,直径为1.2~2.5mm;菌落与培养基间的连接不紧密,容易挑起;菌落正反颜色、构造,以及边缘与中心的颜色、构造一致。图4为Yzh在高倍镜下的细胞形态,可观察到它是一种卵圆形的单细胞微生物,繁殖方式有出芽生殖。
通过图3可看出Rzh的菌落较小,且有小突起;菌落与培养基间的连接不紧密,容易挑起;菌落正反颜色、构造,以及边缘与中心的颜色、构造一致。经验证Rzh为无鞭毛的过氧化氢阴性菌。图5为Rzh经过革兰氏染色后在油镜下的形态,可得出它是一种短杆状的革兰氏阳性细菌。通过查阅文献[8-12]可知,酸面团中分离到的酵母菌主要是酵母菌属和假丝酵母属,乳酸菌绝大多数是乳杆菌。

图2 酵母菌群落Fig.2 Yeast community
2.3 酵母菌和乳酸菌发酵面团的实验

图3 乳酸菌群落Fig.3 Lactic acid bacteria community

图4 酵母菌的个体形态Fig.4 The individual characteristic of yeast
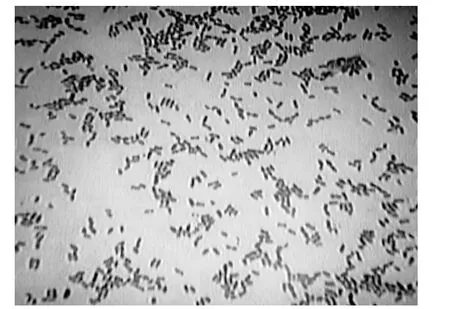
图5 乳酸菌的革兰氏染色Fig.5 The Gram stain of lactic acid bacteria
由图 6 可知,菌液比为 5∶0∶15、10∶0∶10、20∶0∶0、5∶15∶0、10∶10∶0、15∶5∶0 的实验组体积增大明显,其中20∶0∶0的实验组体积增大的幅度最大;由图7可知,菌液比为 0∶5∶15、0∶10∶10、0∶20∶0、5∶15∶0、10∶10∶0、15∶5∶0的实验组 pH 相对较低,其中 10∶10∶0 的 pH 最低。综合考虑,菌液比为 5∶15∶0、10∶10∶0、15∶5∶0 的实验组发酵效果最好。为了探究发酵最优组的菌液比,分别对体积增大明显的实验组和pH相对较低组做了统计分析见表4、表5。因20∶0∶0的实验组体积增大的幅度最大,所以能达到该体积的菌液比及为最佳比例,又由表3 可看出,菌液比为 10∶10∶0、15∶5∶0 的实验组与20∶0∶0的实验组之间没有显著性差异。因此,10∶10∶0 为最优发酵菌液比。

图6 4h后不同菌液比例下面团直径变化Fig.6 Changes of group product in different bacteria liquit ration after 4h

图7 4h后不同菌液比例下面团pH的变化Fig.7 Changes of group product in different bacteria liquid ratio after 4h

表4 4h后面团直径D2均值差分析Table 4 Analysis means difference of dough diameter D2 after 4h
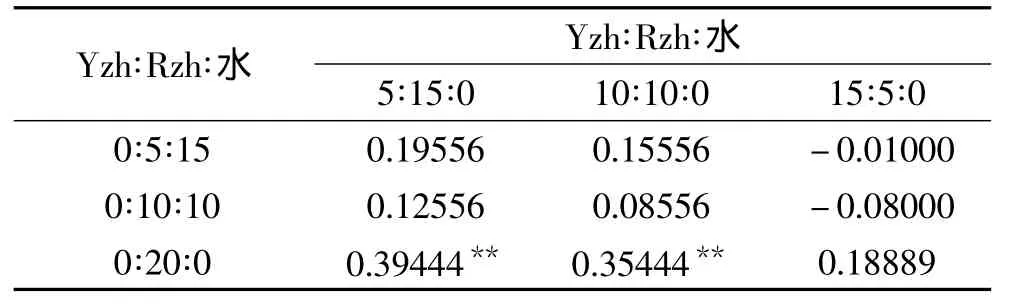
表5 4h后面团pH均值差分析Table 5 Analysis means difference of dough pH after 4h
在面团发酵期间,面粉中的淀粉酶将分解淀粉生成葡萄糖,而后酵母菌分解利用葡萄糖产生乙醇和CO2,生成的CO2一部分以气体状态存在与面团内,另一部分溶于液相的水中变成碳酸。碳酸是一种不稳定的弱酸对面团的pH影响很小[13]。因此添加酵母菌对体积增大有显著地作用,但对pH下降并没有太大的影响。对于面团pH下降的主要原因是乳酸菌利用面团中的营养物质,将葡萄糖转化为乳酸。乳酸是一种较强的有机酸,且发酵过程中产生的也较多[13],所以单一添加乳酸菌和添加混菌的面团,发酵4h后面团的pH明显减小。传统的酸面团除了含有酵母菌和乳酸菌外还含有其他种类的微生物群,它们在发酵过程中会产生少量的风味物质,如酯类,醛、酮类等[2]。传统的酸面团制作的馒头虽然好吃,但是民间发酵不是一个稳定的产品,卫生状况也令人担忧,因此尽快地实现其产业化生产是十分必要的[2]。
3 结论
本文主要通过五个实验组对酸面团中发酵微生物的来源进行探究,并对分离到的酵母菌Yzh和乳酸菌Rzh进行了发酵优化实验,结果如下:面团中的发酵微生物主要来自于面粉当中,其次是空气和水当中。使用不同比例的Yzh菌液(OD600=1.740)和Rzh菌液(OD600=1.630)发酵面团4h后,Yzh∶Rzh为10∶10时面团发酵的效果最好。
[1]苏东民.中国馒头分类专家咨询调查研究[J].粮食科技与经济,2006,5:49-51.
[2]苏东海,胡丽花,苏东民.传统主食发酵剂及其微生物的研究现状[J].农产品加工学刊,2009,3:50-52.
[3]胡丽花,苏东海,苏东民.多菌种混合发酵对主食风味的影响[J].食品科技,2010,35(3):149-152.
[4]丁长河,戚光册,张建华,等.传统起子的微生物分析及其对馒头品质的影响[J].食品科学,2007,28(4):69-74.
[5]张庆,钟京,王凤,等.植物乳杆菌燕麦酸面团发酵面包风味化合物的特征[J].北京工商大学学报,2011,29(4):12-18
[6]苏东海 .馒头酵母的分离与筛选[J].农产品加工,2008,7:82-84.
[7]潘向辉.酸面团中酵母菌筛选及发酵特性研究[D].河北农业大学,2011.
[8]Salimur Rehman,Alistair Paterson,John R.Piggott.Flavor in sourdough breads:a review [J].Trends in Food Science &Technology,2006,17(10):557-566.
[9]Luc De Vuyst,Marc Vancanneyt.Biodiversity and identication of sourdough lactic acid bacteria[J].Food Microbiology,2007,24(2):120-127.
[10]Luc De Vuyst,Patricia Neysens.The sourdough microflora:biodiversity and Metabolic interactions[J].Trends in Food Science & Technology,2005,16(1):43-56.
[11]Duygu Gocmen,Ozan Gurbuz,Aysegul Yildirim Kumral,et al.The effects of wheat sourdough on glutenin patterns,dough rheology and bread properties[J].European Food Research and Technology,2007,225(5):821-830.
[12]Elke K Arendt,Liam A M Ryan,Fabio Dal Bello.Impact of sourdough on the texture of bread [J].Food Microbiology,2007,24(2):165-174.
[13]何承云,林向阳,李光磊,等.馒头面团发酵性能的研究[J].食品研究与开发,2008,29(9):93-96.
