不同初始浓度的单增李斯特菌在营养肉汤中生长预测模型的建立
2013-09-04萨仁高娃胡文忠高春红姜爱丽
萨仁高娃,胡文忠,高春红,姜爱丽,冯 可,马 杰
(1.大连工业大学食品学院,辽宁大连116034;2.大连民族学院生命科学学院,辽宁大连116600;3.大连理工大学生命科学与技术学院,辽宁大连116024;4.甘肃农业大学食品科学与工程学院,甘肃兰州730070)
单核细胞增生李斯特菌(L.monocytogenes,LM)是一种常见的人畜共患的食源性致病菌,能引起人畜的李斯特菌病[1],广泛存在于自然界的土壤、水、植物和反刍动物、人的粪便中,这种菌主要通过污染畜禽产品、蔬菜等食物而引起人类感染致病。由于该菌在4℃下的环境中仍可生长与繁殖,冷藏食品成为引发食源性疾病的主要病源[2]。预测微生物学(predictive microbiology)是一门结合微生物学、化学、数学、统计学和应用计算机技术的交叉性学科,它采用数学的方法描述不同环境条件下,细菌数变化和外部环境因素之间的响应关系,并对微生物的生长动力学做出预测[3]。国外根据预测微生物学开发了多种预测模型软件,其中,PMP(Pathogen Modeling Program)是由美国农业部农业研究所开发的关于食品中微生物的生长预测软件,操作简捷,可用作微生物预测模型数据比较分析。目前,我国初步建立了LM的生长预测模型,大多数简单建立LM在营养肉汤、冷鲜畜禽肉及其制品上的生长预测模型。国外研究较广泛,建立了LM在畜禽及其制品,水产品和乳制品上的生长模型,近几年国外多次暴发因果蔬被LM污染而引起的食源性疾病,因此开始建立LM在新鲜果蔬(如西瓜、木瓜[4]、卷心生菜[5]、芦笋[6]等)上的生长预测模型。虽然研究范围扩大,但国内外对初始浓度对单增李斯特菌生长的影响较少。本研究旨在建立不同温度下不同初始浓度LM在营养肉汤中的生长预测模型,探究温度和LM初始浓度对生长的影响。
1 材料与方法
1.1 材料与仪器
菌株 LM标准菌株来自辽宁省疾病控制中心;牛津琼脂(OXA)基础 青岛海博生物技术有限公司,取 5.85g OXA,加热溶解于100mL蒸馏水中,121℃高压灭菌15min,冷至50℃时,加入1支牛津琼脂添加剂(多粘菌素E 2mg、放线菌酮40mg、吖啶黄素0.5mg、头孢双硫唑甲氧 0.2mg、磷霉素 1mg),混匀,倾入无菌平皿,备用;营养肉汤(NB)青岛海博生物技术有限公司,称取18.0g NB,加热溶解于1000mL蒸馏水中,分装三角瓶或试管,121℃高压灭菌15min,备用;含0.6%酵母浸膏的胰酪胨大豆琼脂(TSA-YE)青岛海博生物技术有限公司,称取51.0g TSA-YE,加热溶解于1000mL蒸馏水中,121℃高压灭菌15min,倾入无菌平皿,备用;实验用水 均为蒸馏水。
1300系列A2型二级生物安全柜 美国Thermo Fisher Scientific公司;HR40-IIA2二级生物安全柜青岛海尔特种电器有限公司;MLS-3020全自动高压蒸汽灭菌器 日本SANYO公司;PL2002分析天平瑞士METTLER TOLEDO公司;Acol-super全自动菌落计数仪 英国synbiosis公司;DNP-9052电热恒温培养箱 上海精宏实验设备有限公司;HYC-326A医用冷藏箱 青岛海尔特种电器有限公司;YLE-1000电热恒温水浴锅 北京东方精瑞科技发展有限公司。
1.2 实验方法
1.2.1 原菌液的制备 在无菌室的生物安全柜里以无菌操作取TSA-YE斜面上的标准菌株,在TSA-YE无菌平板上平行划线,36℃培养24~48h活化,挑取单菌落接种于含有150mL无菌NB的三角瓶中,充分混匀,将三角瓶放入36℃培养箱,培养24~48h至初始菌落数大致为105cfu/mL,即原菌液,4℃保存备用。
1.2.2 营养肉汤中LM计数 在无菌室中以无菌操作将原菌液充分混匀,取10mL加入到90mL无菌营养肉汤中,制得菌液浓度大致为104cfu/mL,再从104cfu/mL中取10mL菌液加到90mL无菌营养肉汤中,制得菌液浓度大致为103cfu/mL,同样方法,将菌液梯度稀释102cfu/mL。将三个稀释度的菌液均放入36℃培养,每隔2h将三个稀释度菌液取出,摇匀后用涂布平板培养法[7]计活菌数,平板用全自动菌落计数仪分析计数,重复三次。按下列公式计算每毫升样品中的含菌量:每毫升样品中菌落形成单位(cfu)=同一稀释度3次重复的平均菌落数×稀释倍数×10。同样方法将原菌液稀释成104、103、102cfu/mL三个稀释度,分别放入4℃和26℃培养,用平板涂布培养法计数。其中4℃每隔24或48h取一次计数,26℃每隔5h取一次计数。
1.2.3 初级模型构建 初级模型利用Matlab软件建立Gompertz模型和Logistic模型,选择最合适的模型得出不同浓度LM菌悬液在不同温度下的生长曲线,并得到相应的初级模型参数。生长曲线和模型参数均与PMP预测软件进行比较。
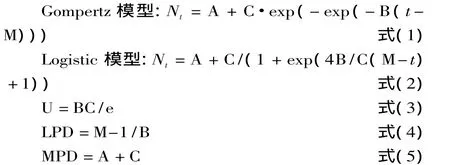
式中:t表示时间(h),Nt表示t时的菌数,A表示初始菌数N0(lg cfu/mL),C表示最大菌数Nmax与初始菌数N0的差值(lg cfu/mL),B为在时间点M时的相对最大生长速率(h-1),M表示达到最大生长速率所需的时间(h),U表示微生物生长的最大比生长速率(lg cfu/mL·h),LPD表示微生物生长的延滞期(h),MPD表示微生物生长的最大细胞密度(lg cfu/mL),e=2.7182[8]。
2 结果与讨论
2.1 LM在营养肉汤中生长的初级模型的选择
不同浓度LM菌悬液的Gompertz模型在不同温度下的拟合很好,相关系数均在0.98以上,Logistic模型拟合也较好,均在0.96以上,结果见表1。结果显示,不同浓度LM菌悬液在不同温度下的生长情况均能用Gompertz模型描述,因此选用Gompertz模型建立初级模型。
2.2 不同温度下不同浓度LM在营养肉汤中的生长曲线
4℃下,Gompertz模型拟合的不同浓度LM在营养肉汤中的生长曲线见图1。可以看出,初始菌浓度越低,菌的延滞期越短,较快进入对数期,随着初始菌浓度的增高,曲线趋于平缓,则延滞期时间增加。初始菌数为102、103cfu/mL的生长曲线分别在约26、28h后进入对数期。对数期LM的生长速率随着初始菌浓度的增加而减慢。最大菌体密度达到约104cfu/mL。
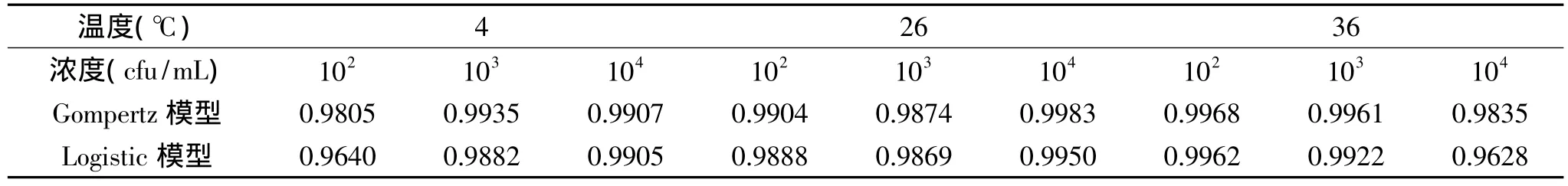
表1 不同浓度LM菌悬液的Gompertz模型和Logistic模型在不同温度下的相关系数(R2)Table 1 The correlation coefficients(R2)of Gompertz model and Logistic model of the growth of L.monocytogenes under different temperatures and initial concentrations
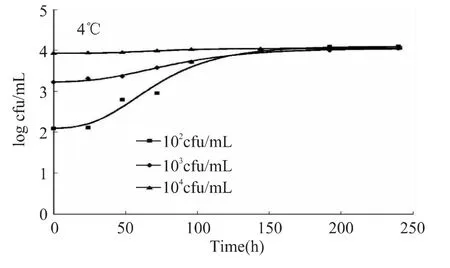
图1 4℃下Gompertz模型拟合的不同浓度LM在营养肉汤中的生长曲线Fig.1 Gompertz model curve of the growth of L.monocytogenes on nutrient broth under different concentrations at 4℃
26℃下,Gompertz模型拟合的不同浓度LM在营养肉汤中的生长曲线见图2。菌的延滞期随初始菌浓度的增加而缩短,初始菌浓度为102cfu/mL的曲线在约5h进入对数期,而103和104cfu/mL的生长曲线分别在约3和2h后就进入了对数期。和4℃时一样,进入对数期的LM,生长速率随着初始菌浓度的增加而减慢,初始菌浓度越低,对数期菌数增加速率越快。25h后,三个不同菌浓度的生长曲线达到最大菌体密度,约为105cfu/mL。
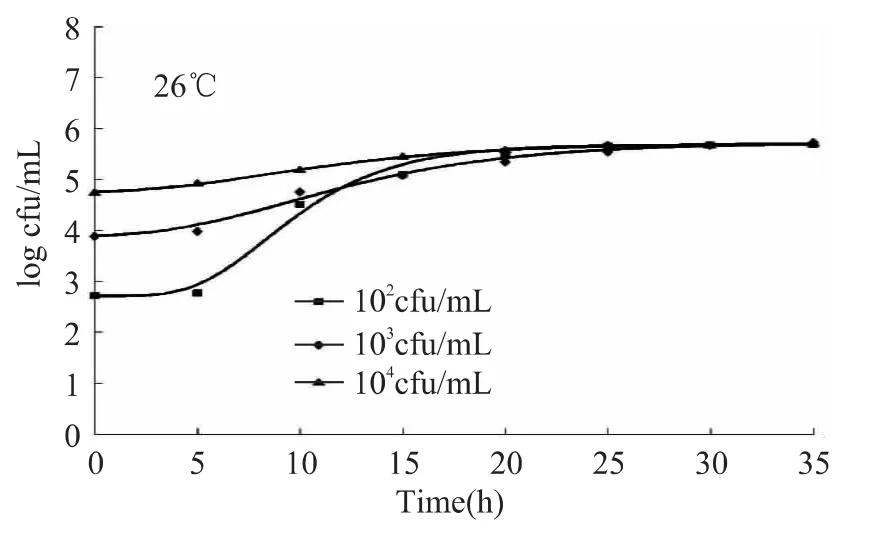
图2 26℃下Gompertz模型拟合的不同浓度LM在营养肉汤中的生长曲线Fig.2 Gompertz model curve of the growth of L.monocytogenes on nutrient broth under different concentrations at 26℃
36℃下,Gompertz模型拟合的不同浓度LM在营养肉汤中的生长曲线见图3。三个不同初始菌浓度的生长曲线均在约1~2h后进入对数期,LM的生长延滞期随初始菌浓度的增加而缩短。进入对数期后,初始菌浓度越低,LM的生长速率越快。约在8h后进入稳定期,细胞密度达到最大值,约107cfu/mL。

图3 36℃下Gompertz模型拟合的不同浓度LM在营养肉汤中的生长曲线Fig.3 Gompertz model curve of the growth of L.monocytogenes on nutrient broth under different concentrations at 36℃
2.3 LM在营养肉汤中生长的初级模型的模型参数
由Matlab软件拟合LM在营养肉汤中生长的Gompertz模型,得到相应的生长参数:最大比生长速率U(lg cfu/mL·h)、生长延滞期LPD(h)和最大细胞密度MPD(lg cfu/mL),结果见表2。
可以看出LM在4℃的最大比生长速率(0.0236,0.0078,0.0016)小于在 26℃的最大比生长速率(0.3169,0.1111,0.0595),26℃的最大比生长速率小于36℃的最大比生长速率(1.3046,0.9287,0.7024),证明随着温度升高,LM生长速度加快。4℃下,最大比生长速率随着初始菌浓度的增加(102,103,104)而降低(0.0236,0.0078,0.0016),26、36℃也显示同样的趋势,结果证明,在相同温度下,初始菌浓度越低,LM生长越迅速。
随着温度的升高,生长延滞期 LPD(h)缩短。LM在不同温度下生长延滞期顺序为:4℃(25.6811,27.3143,33.7437)> 26℃(4.8442,3.3708,2.3458)>36℃(1.7875,1.1932,0.6915)。在相同温度下,生长延滞期的趋势并不明显,26,36℃下,延滞期随着初始菌浓度的增加而降低,而4℃下,延滞期随着初始菌浓度的增加而延长,因为温度较高时(26,36℃),初始菌浓度越大,进入对数期就越快,延滞期越短;而温度较低时(4℃),初始菌浓度越大,越接近最大细胞密度,因此延滞期越长。
从最大细胞密度MPD(lg cfu/mL)可以看出,随着温度升高,MPD增大,LM在不同温度下的最大生长密度顺序为:36℃(7.7559,7.7709,7.7536)>26℃(5.6839,5.7218,5.7076)> 4℃ (4.0969,4.0453,4.0492)。
LM在营养肉汤中生长的生长曲线于PMP软件进行比较,MPD较低,但总体趋势相同。初始浓度为103cfu/mL的LM生长参数的实测值和PMP预测值的比较见表3。可以看出,U和LPD的实测值和预测值趋势相同,都是随着温度的升高,U增快,LPD缩短。MPD的实测值和预测值差别较大,可能原因是实验选择菌株的不同和单一造成的,该菌株可能受温度影响较大,所以MPD达不到预测值,且随着温度降低,MPD减小。
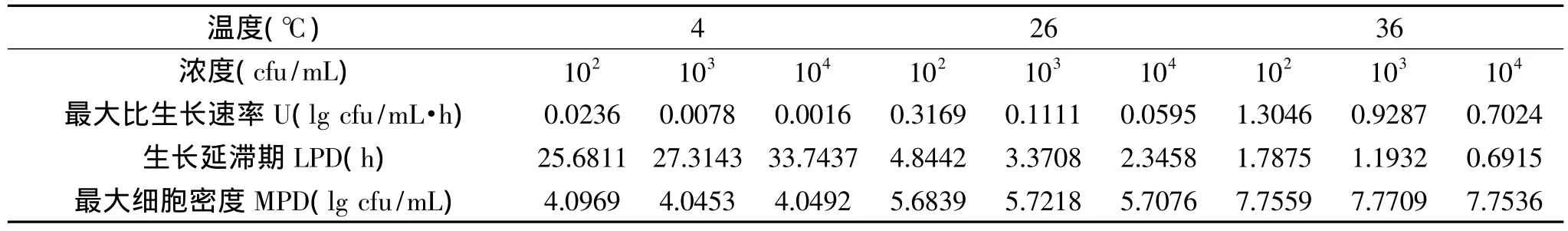
表2 不同浓度LM菌悬液的Gompertz模型在不同温度下的生长参数Table 2 Gompertz model parameters of the growth of L.monocytogenes under different temperatures and concentrations
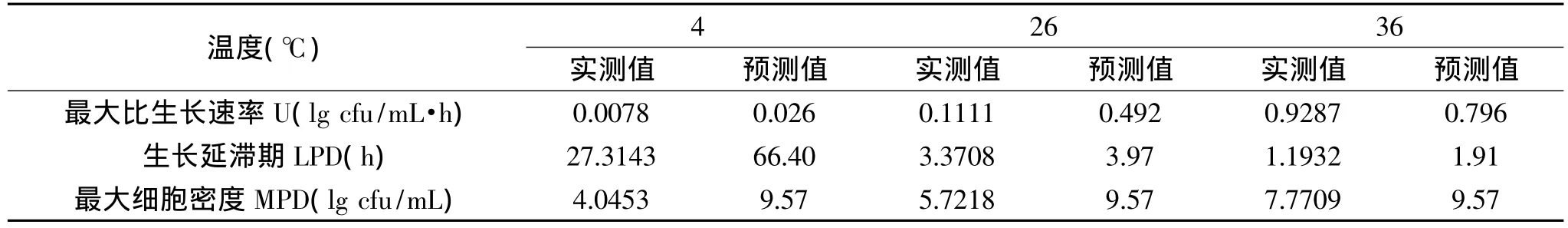
表3 LM生长参数的实测值和PMP预测值的比较(初始浓度为103cfu/mL)Table 3 Comparison of observation and PMP predictive values on L.monocytogenes growth parameters
3 结论
本实验利用Matlab丰富的函数资源,成功拟合出不同温度和不同LM浓度在营养肉汤中的生长初级模型。微生物生长的初级模型一般通过S形曲线描述,主要模型有:Gompertz模型、Logistic模型、Richards 模型和 Baranyi模型等[9-10]。多数微生物生长预测模型研究表明,Gompertz模型能很好描述微生物的生长,Zhou[11]拟合了热杀索丝菌(Brochothrix thermosphacta)的生长曲线,发现Gompertz模型最合适,其次是Baranyi模型,最后是Logistic模型。本文分别拟合了Gompertz模型和Logistic模型,比较相关系数发现,Gompertz模型的R2均在0.98以上,所以认为Gompertz模型能更好的拟合本实验的数据。
基于前人的研究,本实验选择了三个不同温度,36℃为LM最适生长温度,26℃为室温,4℃为食品冷藏温度,研究结果具有指导意义。三个温度下LM的生长曲线与PMP预测软件比较发现,实测值与预测值存在一定差别,但总体趋势相同。
近年来,较多研究都致力于建立不同温度下LM的生长预测模型,如郑丽敏[12]等建立了不同温度下即食凉拌菜中单增李斯特菌的生长模型,而很少有研究初始菌浓度对LM生长的影响。本实验基于目前生长预测模型研究的基础,建立了不同初始浓度在不同温度下LM在营养肉汤中生长的初级模型,明晰了LM增殖规律,为进一步研究鲜活农产品物流过程中LM的生长动态,研发综合防控技术奠定了基础。
[1]金伟平,黄志强,刘群群,等.顶空固相微萃取-气质联用法分析单增李斯特菌污染冷藏牛肉的挥发性物质[J].食品科学,2012,33(2):243-247.
[2]丁甜,董庆利,相启森,等.Listeria monocytogenes在经高氧化还原电位酸性水处理的鲜食莴苣上预测模型的建立[J].食品工业科技,2010,31(3):87-94.
[3]王军,董庆利,丁甜.预测微生物模型的评价方法[J].食品科学,2011,32(21):268-272.
[4]Ana L P,Mauro F F L.Growth of Listeria monocytogenes in melon,watermelon and papaya pulps[J].International Journal of Food Microbiology,2004,92(1):89-94.
[5]Shigenobu K,Seiichiro I.Growth of Listeria monocytogenes on iceberg lettuce and solid media[J].International Journal of Food Microbiology,2005,101(2):217-225.
[6]A M Castillejo R,E Barco A,R M Garcia G,et al.Growth modelling of Listeria monocytogenes in packaged fresh green asparagus[J].International Journal of Food Microbiology,2000,17(4):421-427.
[7]李平兰,贺稚非.食品微生物学实验原理与技术[M].北京:中国农业出版社,2005:42-44.
[8]唐晓阳,赵勇,孙晓红,等.冷却猪肉中假单胞菌生长预测模型的建立与验证[J].湖南农业科学,2010(1):128-131.
[9]Whiting R C,Buchanan R L.A classification of modles for predictive[J].Food Microbiol,1993,10:175-177.
[10]Guentzel J L,Lam K L,Callan M,et al.Reduction of bacteria on spinach,lettuce,and surfaces in food service areas using neutral electrolyzed oxidizing water[J].International Journal of Food Microbiology,2008,25:36-41.
[11]Zhou K,Fu P,Li P L,et al.Predictive modeling and validation of growth at different temperatures of Brochothrix thermosphacta[J].Journal Food Saf,2009,29:460-473.
[12]郑丽敏,董庆利,丁甜,等.即食凉拌菜中单增李斯特菌生长模型的建立[J].食品科学,2013 http://www.spkx.net.cn/CN/abstract/abstract30611.shtml.
