Fe2+对微生物浸出赞比亚酸浸渣的影响
2013-09-04刘学端邱冠周
王 欣,唐 敏,田 野,刘 毅,刘学端.2,邱冠周,2
(1. 中南大学 资源加工与生物工程学院,湖南 长沙 410083; 2. 生物冶金教育部重点实验室,湖南 长沙 410083)
酸浸处理广泛用于金属冶炼行业中并产生大量废弃酸的浸渣,它们被废弃在大自然的开放环境里,虽然短期内对自然界不会造成很大的危害,但长此以往也会造成许多问题,如占地面积大、污染当地环境尤其是地下水等;另一方面,世界范围内普遍面临资源短缺的问题,而很多酸浸渣中还含有一定量的金属硫化矿,可以利用微生物浸出技术对其中的金属进行回收,因此酸浸渣的高效处理和利用就显得极为重要[1,2],国内外有很多利用微生物浸出技术回收酸浸渣的实例[3,4]。微生物浸出过程中,浸矿微生物将Fe2+氧化为Fe3+,后者氧化硫化铜使得铜以离子形式溶解在浸出液中,可见Fe3+是影响浸出效果的关键因素,因此Fe2+作为Fe3+的来源也非常重要。在很多生物冶金回收铜的研究中,添加一定量的Fe2+都能促进微生物浸出金属铜[5-7],本工作研究了其Fe2+对微生物浸出尾矿中的铜是否有促进作用。
1 实验部分
1.1 实验材料
浸出材料为酸浸(Acid leaching)工艺所废弃的矿渣,由赞比亚谦比希公司提供,矿样粒级分布于75 μm(200目,约占30%)和830 μm(20目,100%过筛)范围内。浸矿微生物及其培养条件见表1,其中9K培养基包含3.0 g/L (NH)4SO4、0.01 g/L Ca(NO3)2、0.5 g/L MgSO4·7H2O 和 K2HPO4及 0.1 g/L KCL;TC培养基与9K培养基不同的是K2HPO4浓度为0.01 g/L,此外还添加了3.2 g/L的Na2SO4·10H2O;Starky培养基包含了 3.0 g/L (NH)4SO4、0.5 g/L MgSO4·7H2O、3.0 g/L KH2PO4和 0.25 g/L CaCl2·2H2O。
1.2 实验方法
槽浸实验在3 L的机械搅拌反应烧杯中进行,矿浆浓度为15%,搅拌转速为300 r/min,烧杯放置在水浴槽中,温度设定在 30 ℃。将矿物倒入烧杯加水至快3 L时调节pH为1.5并且在整个浸矿过程中用H2SO4或NaOH溶液使pH稳定在1.5±0.2。酸浸对照组只用 H2SO4浸出且反应器中加入了氨苄青霉素(100 mg/L),实验组一中加入混合菌群搅拌浸出,实验组二中加入混合菌群的同时添加 FeSO4至溶液中Fe2+浓度为1 g/L。浸出过程中,定期检测pH、电位、铁离子和细菌浓度,并取1 mL浸出液及约0.5 g的浸出渣用于检测铜浸出量、物相及其他离子浓度,另外加单蒸水来补偿蒸发的水分。矿样及矿渣样品经研磨后送往长沙矿冶研究院通过 XRD、XRF(X-ray fluorescence spectroscopy,X射线衍射荧光光谱)ICP-AES及化学消化法进行矿物物相及元素分析。
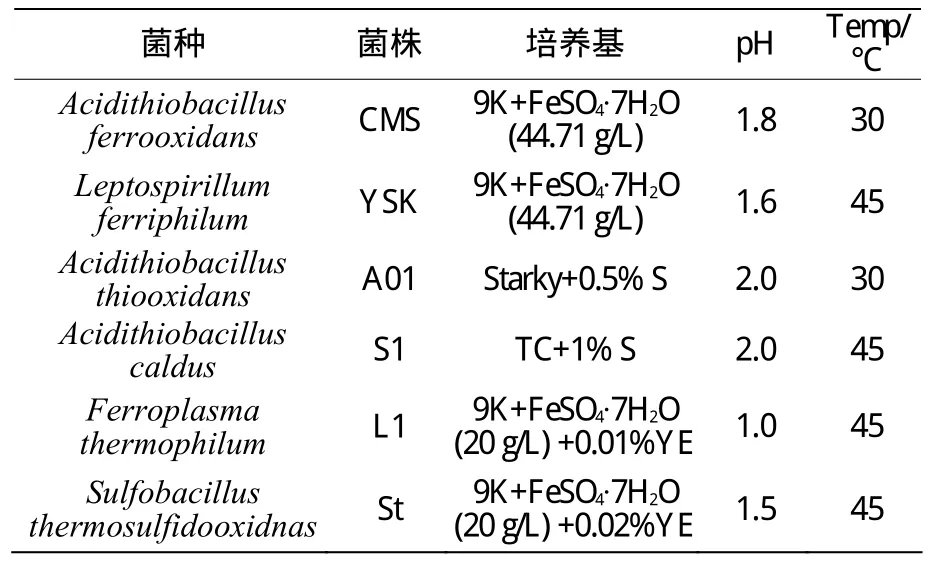
表1 浸矿微生物及其培养条件[8]Table 1 Bioleaching microbes and their medium
2 结果与讨论
2.1 添加Fe2+对微生物的影响
从图1中可以看出未添加FeSO4的酸浸渣浸出体系中微生物浓度没有明显变化,而在添加 Fe2+的浸出体系中,浸矿细菌前期有明显增长,后期进入衰亡期。说明 Fe2+的加入为浸矿细菌提供了初期的能源物质,使得微生物的数量在初期能够快速增加。但由于酸浸渣中的铜含量较低,Fe3+不能通过氧化酸浸渣中的铜及时转变成 Fe2+,因此后期 Fe2+得不到及时的循环。溶液中的铁氧化细菌依赖溶液中Fe2+生长,随着后期Fe2+浓度的降低铁氧化细菌会因周边环境中能源物质短缺致而其进入衰亡期或另一个停滞期,这说明Fe2+的添加只能在前期短暂维持细菌特别是游离菌的生长,但是长期来看却不利于浸矿细菌更早更快地适应相对贫瘠的酸浸渣浸出体系。
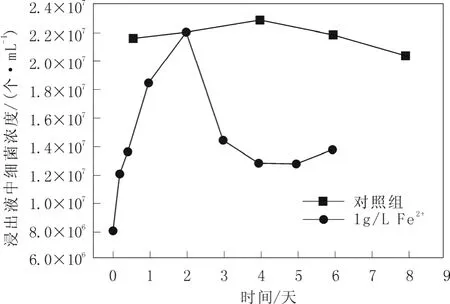
图1 添加Fe2+的槽浸过程中溶液中细菌浓度变化Fig.1 Change of microbes concentration during bioleaching with ferrous ions
2.2 添加Fe2+对电位的影响
如图2所示,相对于不添加Fe2+的微生物浸出体系,加入Fe2+的体系在pH被调节至1.5之后,因为 Fe2+的加入使浸出液电位较低,但后期由于浸矿细菌的作用,Fe2+的消耗及铁总量开始增加,电位升高的速度和最终稳定值都比不加 Fe2+的浸出体系高。这个结论再次证明 Fe2+在前期会被浸矿细菌快速利用,且图3显示随着铜浸出速度的减慢,Fe3+浓度趋于稳定,Fe2+浓度几乎为零。微生物浸出过程中会产生不溶于水的黄钾铁矾沉淀,覆盖于浸出材料上阻碍浸出过程,而有研究表明,电位越高越利于铁沉降的发生[9]。从图3中可以得出,浸出过程后期总铁离子浓度降低,最明显表现为 Fe3+浓度降低,表明有黄钾铁矾沉降的发生,而黄钾铁矾等的生产将阻碍矿物进一步被浸出[10]。在该酸浸渣浸出体系中,由于能源贫乏,细菌快速利用 Fe2+使其浓度水平非常低,而且酸浸渣品位低且成分复杂,被浸出速率低,因此外加的 Fe2+使得 Fe3+浓度和电位增加,导致铁沉降反而更不利于酸浸渣的浸出。

图2 Fe2+对浸出体系电位的影响Fig.2 The impact caused by ferrous ions on potential of bioleaching system
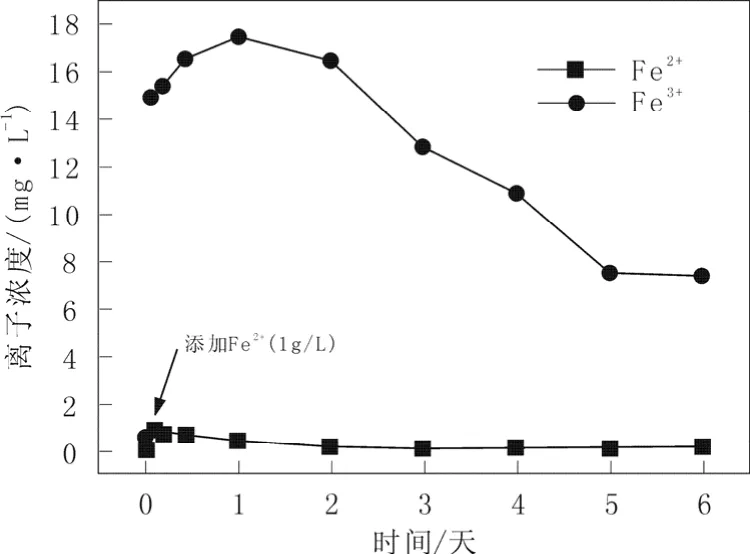
图3 加入Fe2+的浸出体系在浸出过程中铁离子浓度的变化Fig.3 Change of iron concentration in leaching solution with ferrous ions added
2.3 添加Fe2+对酸浸渣中铜浸出的影响
如上所述,浸矿细菌前期生长过程中生成的Fe3+对浸出有促进作用,但随着浸出过程中电位和Fe3+浓度的升高导致 Fe3+沉降加快而阻碍了铜的浸出。从图6中可以看出,通过对加入Fe2+的浸出体系浸出渣的物相分析发现,在第六天铜的浸出量为60.6%,与直接生物浸出相比较没有增大浸出量,而是减少了1.1%,差距很小。通过仔细对照图4表明的有无添加 Fe2+浸出体系中浸出渣铜残留曲线可知,在第一天的浸出高峰期,铜残余量直线下降,酸浸对照组中铜浸出速率最大,其次是加 Fe2+的生物浸出体系,最后是无添加 Fe2+的生物浸出体系。从物相分析图可以看出,酸浸渣中的部分自由或结合氧化铜和大部分原生铜及部分次生铜可由酸直接作用浸出,而Fe2+的氧化需要H+的参与,又有报道表明浸矿细菌如A. ferrooxidans即使在溶液中没有Fe2+的情况下也可以向浸出体系中泵入 H+,以利于进一步氧化 Fe2+[11],从而更进一步的降低了浸出体系中的H+浓度。综合以上两点可知,浸矿细菌的加入在一定程度上降低了浸出体系中H+浓度,从而降低了第一天浸出高峰期的酸作用效率。另一方面,浸矿细菌吸附于酸浸渣上的速度也非常迅速,一天内就能达到高峰值[12],而浸矿细菌的吸附也可能暂时阻碍了酸与酸浸渣的直接作用。在添加了 Fe2+的浸出体系浸出液中,浸矿细菌更倾向于直接利用Fe2+从而减少了在酸浸渣上的吸附率,这就能解释为何没有添加 Fe2+的生物浸出体系在第一天浸出高峰期内的酸浸出作用效率最低。然而度过了最初的浸出快速期后,没有添加 Fe2+的浸出体系成为了最有效率的浸出体系,这说明该浸出体系中的浸矿细菌已开始适应贫瘠的营养环境,从而可以更有效吸附并作用于酸浸渣,尤其是其中残余的硫化矿;而添加 Fe2+后的生物浸出体系则出现一段明显的浸出停滞期,对照图5中浸出液细菌的生长情况,发现浸矿细菌此时正进入对数期,是 Fe2+消耗最大的时候,从铁离子浓度变化曲线图3中也可以清晰的看出该浸出体系的浸矿细菌正最大效率的对 Fe2+进行氧化。这暗示浸出细菌更倾向于在浸出液中氧化Fe2+,而吸附酸浸渣直接利用矿物的细菌量相对减少。这一结论可以由图6的浸出渣物相分析证实,浸出渣中次生铜的浸出差异最明显,浸出率从最高的80%,到最低的47.2%,而次生矿是生物氧化矿物过程中最主要的作用部分。虽然次生铜的浸出也是与 Fe3+作用,但溶液中的 Fe3+浸出铜的效果远不如 Fe3+被浸矿细菌富集并因吸附在矿物表面之后作用于矿物的效果好,因为有研究表明不添加微生物的 Fe3+浸出和微生物浸出有明显差别,硫化矿的浸出不单是由 Fe3+催化氧化完成的[13]。次生矿残留量差别大的另外一个可能的原因是浸出液中的 Fe2+将酸浸渣中的黄铜矿还原为辉铜矿,这样更利于铜被金矿细菌或Fe3+氧化[6]。同时因前期由酸作用浸出的铜量较大,溶液中Cu2+浓度较高而发生如下反应:
CuFeS2+ 3 Cu2++ 3 Fe2+= 2 Cu2S + 4 Fe3+(1)
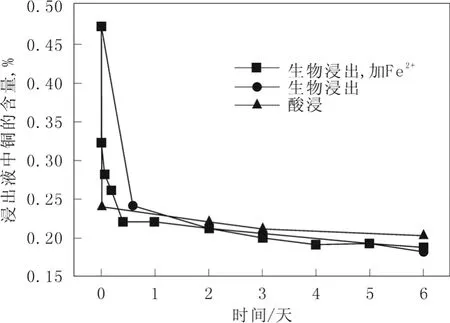
图4 Fe2+对酸浸渣微生物浸出中铜浸出的影响Fig.4 The impact caused by ferrous ions on copper recovery
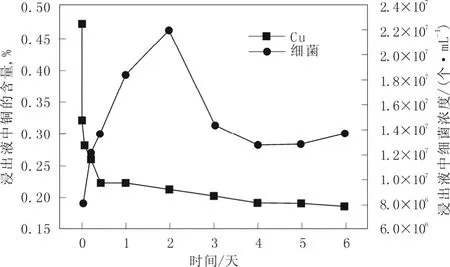
图5 添加Fe2+的生物浸出体系中铜浸出和溶液中细菌浓度的对应变化Fig.5 Microbes concentration and copper remained in leached residues during bioleaching with ferrous ions
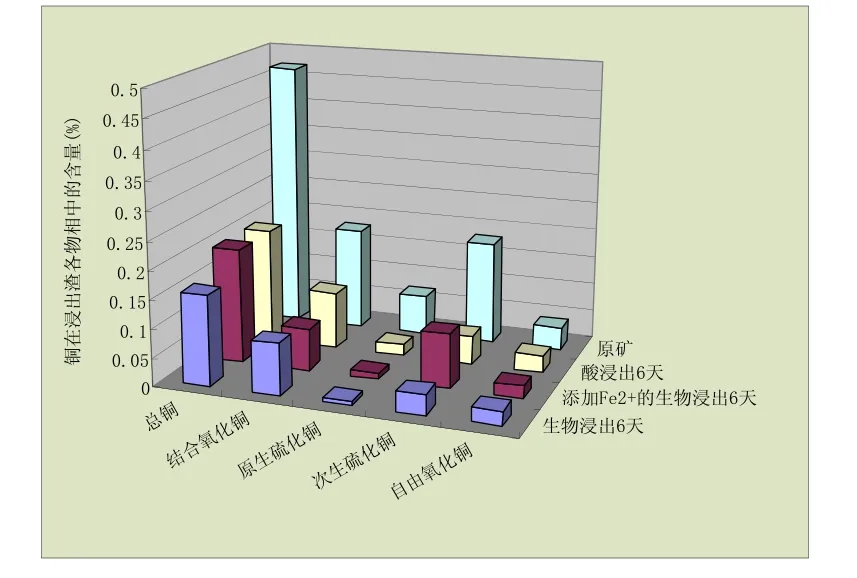
图6 添加Fe2+对生物浸出的浸出渣物相的影响Fig.6 Mineralogical analysis of leached residues during bioleaching with ferrous ions
但浸出过程中原生矿并没有明显减少,因此该反应的可能性较小,Fe2+应该被大量的细菌氧化而消耗;而 Fe2+的氧化会消耗 H+,在浸出过程中 pH有略微升高也证实了这一点,这都暗示大约从 0.5天到 1天这段时间里酸浸渣的浸出过程出现了停滞。图6的物相分析也证实了这一点,因为在相同的时间内,原生矿和氧化矿在浸出过程中对酸浸出作用的要求相对于不添加 Fe2+的浸出体系要少,接下来产生的Fe3+开始作用于酸浸渣,但是到了后期,铜浸出进入缓慢期,添加 Fe2+的体系由于 Fe3+浓度较高利于铁的沉降,反而阻碍铜进一步浸出,因此又出现停滞期。综上所述,添加Fe2+在浸出前期有利于铁氧化菌的生长,但不利于酸浸渣中铜的浸出,可能还会因为Fe3+浓度过高促使铁沉降而阻碍铜浸出。
3 结 论
通过研究 Fe2+对酸浸渣微生物浸出的影响发现以下结论:
(1)添加了Fe2+的浸出体系中的浸矿细菌由于Fe2+的作用,在前期使得细菌数量快速增加,但由于 Fe3+不能及时转化为 Fe2+,浸矿细菌很快进入衰亡期,且由于没有及时适应酸浸渣的贫瘠环境,不利于后期浸出。
(2)加入Fe2+的浸出体系前期电位较低,后期在浸矿细菌作用下电位快速升至不加 Fe2+的浸出体系水平,高于对照酸浸体系电位;然而高电位有利于不溶的黄钾铁矾产生,覆盖到酸浸渣表面影响后期浸出。
(3)添加Fe2+在浸出前期有利于铁氧化菌的生长,但不利于酸浸渣中铜的浸出,可能还会因为Fe3+浓度过高促使铁沉降而阻碍铜浸出。
综上所述,Fe2+的加入对酸浸渣的微生物浸出有一定的阻碍作用;同时实验还证明 Fe3+不能取代浸出细菌在次生矿浸出时的作用。
[1]Lu Y, S Y Sun.Status and comprehensive treatment & utilization of tailings from beneficiation [J]. Mining Engineering, 2007( 2): 53-55.
[2]Zhangda L, Z Qiulan. PRESENT SITUATION OF MINE TAILINGS UTILIZATION AND PROSPECTS FOR THE 21ST CENTURY IN CHINA [J]. Geology and Prospecting, 1997( 3): 21-28.
[3]Cheng Y, et al. The bioleaching feasibility for Pb/Zn smelting slag and community characteristics of indigenous moderate-thermophilic bacteria[J]. Bioresour Technol, 2009, 100(10): 2737-40.
[4]Kondrat'eva T F, et al. Percolation bioleaching of copper and zinc and gold recovery from flotation tailings of the sulfide complex ores of the Ural region, Russia[J]. Hydrometallurgy, 2011(1): 82-86.
[5]Hiroyoshi N, et al. A case of ferrous sulfate addition enhancing chalcopyrite leaching[J]. Hydrometallurgy, 1997, 47(1): 37-45.
[6]Hiroyoshi N, et al. A model for ferrous-promoted chalcopyrite leaching[J].Hydrometallurgy, 2000,57(1): 31-38.
[7]Hiroyoshi N. et al. Enhancement of chalcopyrite leaching by ferrous ions in acidic ferric sulfate solutions[J]. Hydrometallurgy, 2001, 60(3):185-197.
[8]Li Q, et al. The community dynamics of major bioleaching microorganisms during chalcopyrite leaching under the effect of organics[J]. Curr Microbiol, 2011, 63(2): 164-72.
[9]Córdoba E, et al. Leaching of chalcopyrite with ferric ion. Part II: Effect of redox potential[J]. Hydrometallurgy, 2008, 93(3): 88-96.
[10]Watling H. The bioleaching of sulphide minerals with emphasis on copper sulphides—a review[J]. Hydrometallurgy, 2006,84(1): 81-108.
[11]Lawrence Eugene Murr, Árpád E. Torma, James A. Brierley .Met allurgical Applications of Bacterial Leaching and Related Microbi ological Phenomena [M]. New Mexico Institute of Mining and Tec hnology, 1978.
[12]Rodriguez Y, et al. New information on the chalcopyrite bioleaching mechanism at low and high temperature[J]. Hydrometallurgy, 2003,71(1-2): 47-56.
[13]Hansford, G. and T. Vargas, Chemical and electrochemical basis of bioleaching processes[J]. Hydrometallurgy, 2001, 59(2-3): 135-145.
