三个地方鸡种MHC B-L BII基因遗传变异与免疫性状的关联分析
2013-09-04李福伟李淑青逯岩雷秋霞韩海霞周艳武彬曹顶国
李福伟,李淑青,逯岩,雷秋霞,韩海霞,周艳,武彬 ,曹顶国
1 山东省农业科学院家禽研究所,山东 济南 250023
2 山东省家禽育种工程技术研究中心,山东 济南 250023
3 山东省农业管理干部学院,山东 济南 250100
鸡主要组织相容性复合体 (Major histocompatibility complex,MHC) 是指16号染色体上的一组紧密连锁高度多态的基因座,与免疫应答和抗病性密切相关。MHC B-L抗原主要存在抗原递呈细胞的表面,为免疫相关抗原,参与免疫过程中T细胞、B细胞和巨噬细胞之间的相互反应。地方品种具有优良的遗传特性,其适应性、抗病性强等优良特点是进行资源保存以及培育新品种 (系) 良好素材。MHC各基因成员的遗传多态性直接反映了其DNA遗传变异的程度,也为研究其遗传进化规律和遗传多样性提供分子依据。研究地方品种MHC B-L BII多态性与免疫性状的关系,筛选与免疫性状显著相关的遗传变异位点,为下一步抗病育种分子机制提供理论和技术支持,也为开展标记辅助抗病育种工作奠定基础。
鸡MHC又被命名为B复合体,主要包括3个高度多态的基因座:B-F、B-L和B-G基因,分别编码细胞表面的MHCⅠ类、Ⅱ类和Ⅳ类糖蛋白分子,即高度多态的细胞表面抗原[1]。鸡MHCⅡ类分子编码基因包括A和B两种基因,分别编码MHCⅡ类抗原的 α和 β肽链,其中B基因位于MHC区域。α和β链均可分为3个部分:C端的胞质区和跨膜区以及N端的胞外区。胞外区包括两个结构域,即α链上为 α1、α2结构域,β链上为 β1、β2结构域 (α l、α2和 β l、β2均约为90个氨基酸残基),与免疫球蛋白的结构域相似。β1变异性较高,呈现出较丰富的多态性,有利于机体结合不同的抗原肽[2]。
有报道鸡MHC基因的多态性与免疫性状特别是鸡马立克氏病 (MD)、布氏杆菌、新城疫(ND) 以及绵羊红细胞 (SRBC) 抗体[3]、传染性法氏囊病毒抗体[4]之间存在相关性。Dalgeerd等[5]研究发现,鸡只感染 MDV后,在抗性与易感基因型鸡淋巴细胞表面MHCⅠ类和Ⅱ类分子表达有明显差异,说明MHC基因型决定了免疫反应性质及其强弱。越来越多研究结果揭示动物MHC基因型在抗病免疫中的作用[6]。Liu等[7]研究表明MHC介导的细胞免疫应答与鸡传染性支气管病毒有关。鸡MHC基因结构研究方面,Chen等[8]克隆了中国3个地方品种MHC B-II(B-L) 基因cDNA序列,发现35个等位基因,多态性位点主要集中在B-Lβ链的肽链结合区域,B-Lα链多态性较少。对病原抗原递呈影响也有诸多研究。Mona等[9]、Goto等[10]、Ling等[11]研究指出免疫功能较高的主要抗原肽的等位基因频率也较高。Alcaide等[12]研究指出病原体多样性在MHC基因形成过程中起到主要作用。
目前,关于鸡MHC基因研究大都证明鸡MHC基因结构组成以及MHC基因组内具有丰富的多态性。但是不同地方品种间、品种内的SNP位点变异与不同疾病、不同免疫性状的关系还鲜有报道。本研究以山东地方家禽品种 (汶上芦花鸡、济宁百日鸡、莱芜黑鸡) 为研究对象,以SRBC抗体滴度、禽流感AI和ND抗体滴度等免疫功能性状为主要目标性状,测定比较这些品种主要免疫性状在品种间和品种内的差异;对不同品种的MHC基因B-L BII区域进行遗传学变异的分析,寻找这些基因与免疫功能显著相关的突变位点,探讨B-LBII基因突变位点与免疫性状的关系,为不同品种的免疫差异性提供分析依据。
1 材料与方法
1.1 试验动物及免疫程序
山东地方鸡种汶上芦花鸡 (LH)、莱芜黑鸡(LWH) 和济宁百日鸡 (BR),均由山东省农业科学院家禽所原种鸡场提供,在相同条件下饲养,营养水平和免疫程序相同。整个试验期鸡群健康状况良好。按照当地疾病流行情况制定免疫程序,免疫剂量按说明书进行。整个试验期免疫程序如下表1。
1.2 检测指标和方法
1.2.1 样品数量
每品种随机选择 100只 (公母各半) 采血,所有样品均使用同一批试剂,在相同条件下抗体测定和提取基因组DNA。
1.2.2 绵羊红细胞抗体滴度
取新鲜绵羊血 (小尾寒羊,由济南市畜牧局畜牧技术推广站提供),玻璃珠抗凝,阿氏液1∶1保存,磷酸盐缓冲液 (PBS,pH 7.4) 洗涤后,用0.9%生理盐水配成 25%的血细胞溶液 (注射使用) 和2%的红细胞悬浊液 (测抗体使用)。试验鸡128 d腿部肌肉注射1 mL,左右腿各0.5 mL,免疫后第6天采血取血清。

表1 试验鸡群免疫程序Table 1 Experimental immunization program in chickens
用红细胞凝集法测定SRBC抗体滴度。待测血清56 ℃水浴灭活30 min后,在微量血凝板的第一孔中加入50 µL PBS和50 µL血清,血凝板(加盖) 在培养箱中37 ℃温育30 min,结束后在血凝板剩余的每孔中加入50 µL PBS,用微量移液器逐孔倍比稀释样品 (最后一孔弃掉)。在所有的孔中加入50 µL 2% SRBC悬浊液,37 ℃温育30 min后,取出血凝板,视红细胞凝集情况判断效价[13]。
1.2.3 AI和ND抗体滴度的测定
试验鸡于134 d进行翅静脉采血,每只鸡采血 2 mL,取血清分别按《高致病性禽流感诊断技术》 (GB/T 18936-2003)[14]和《新城疫诊断技术》 (GB/T 16550-2008)[15]的规定,测定 AI和ND的血凝抑制抗体效价。
1.2.4 DNA提取
采用盐析法抽提DNA[16]。
1.3 引物设计和PCR-SSCP反应
1.3.1 引物设计
利用Primer 5.0软件,根据鸡MHC B-L BII基因序列 (GenBank Accession No. M29763,为鸡MHC B-L BIIß基因全部CDS区域,该基因片段长度为2 405 bp) 设计引物,引物序列如表2所示。目的片段长度为175 bp,为MHCB-L BII基因exon2的一部分。

表2 文中所用的引物Table 2 Primers used in this study
1.3.2 PCR-SSCP
应用 PCR-SSCP技术对 3个地方鸡品种的300个个体进行基因分型。PCR反应总体积为10 µL:模板 (3 个地方品种鸡 DNA) 0.8 µL,上游引物 0.2 µL,下游引物 0.2 µL,ddH2O 3.8 µL,2×TaqPCR Master Mix 5 µL。反应程序:94 ℃预变性 5 min;94 ℃变性 30 s,60 ℃退火 30 s,72 ℃延伸30 s,30个循环;最后72 ℃延伸6 min。
PCR结束后进行聚丙烯酰胺凝胶电泳。配制10%的聚丙烯酰胺凝胶:10×TBE 9 mL,30%聚丙烯酰胺31 mL,50%甘油9 mL,ddH2O 44 mL,过硫酸铵 630 µL,TEMED 70 µL。电泳程序为:300 V 30 min;PCR产物98 ℃变性8 min,加样2.5 µL/孔;250 V 高压 30 min;4 ℃条件下 120 V恒压下电泳16 h后银染显色。每个品种每个基因型送3个纯化样品在济南力戈科技有限公司进行测序。
1.4 数据处理和统计分析
数据处理和统计分析采用 SAS 6.0ANOVA程序进行免疫性状与基因型的最小二乘分析。
2 结果与分析
2.1 免疫指标测定结果
三个地方鸡品种的SRBC、ND、H5、H9抗体滴度详见表3。SRBC免疫抗体滴度、ND免疫抗体滴度、H5免疫抗体滴度和H9抗体滴度均以莱芜黑鸡最高,并且与其他2个品种间差异极显著 (P<0.01);汶上芦花鸡、济宁百日鸡ND抗体滴度差异极显著 (P<0.01),其他3种抗体滴度间差异不显著 (P>0.05)。
2.2 核酸、氨基酸变异分析结果
根据对175 bp的PCR-SSCP结果分型,3个地方鸡品种共存在 16种基因型,其中汶上芦花鸡、济宁百日鸡和莱芜黑鸡分别存在10、10和7种基因型。将测序结果用 DNAStar软件中的SeqMan程序与 GenBank中MHCB-L BII基因(Accession No. M29763) exon 2的DNA序列进行比对,结果表明被检鸡的MHC B-L BII基因exon2存在28个SNP位点,可引起23个氨基酸的变化。其中3个品种共享12个位点 (表4)。

表3 抗体滴度测定结果Table 3 Antibody titers
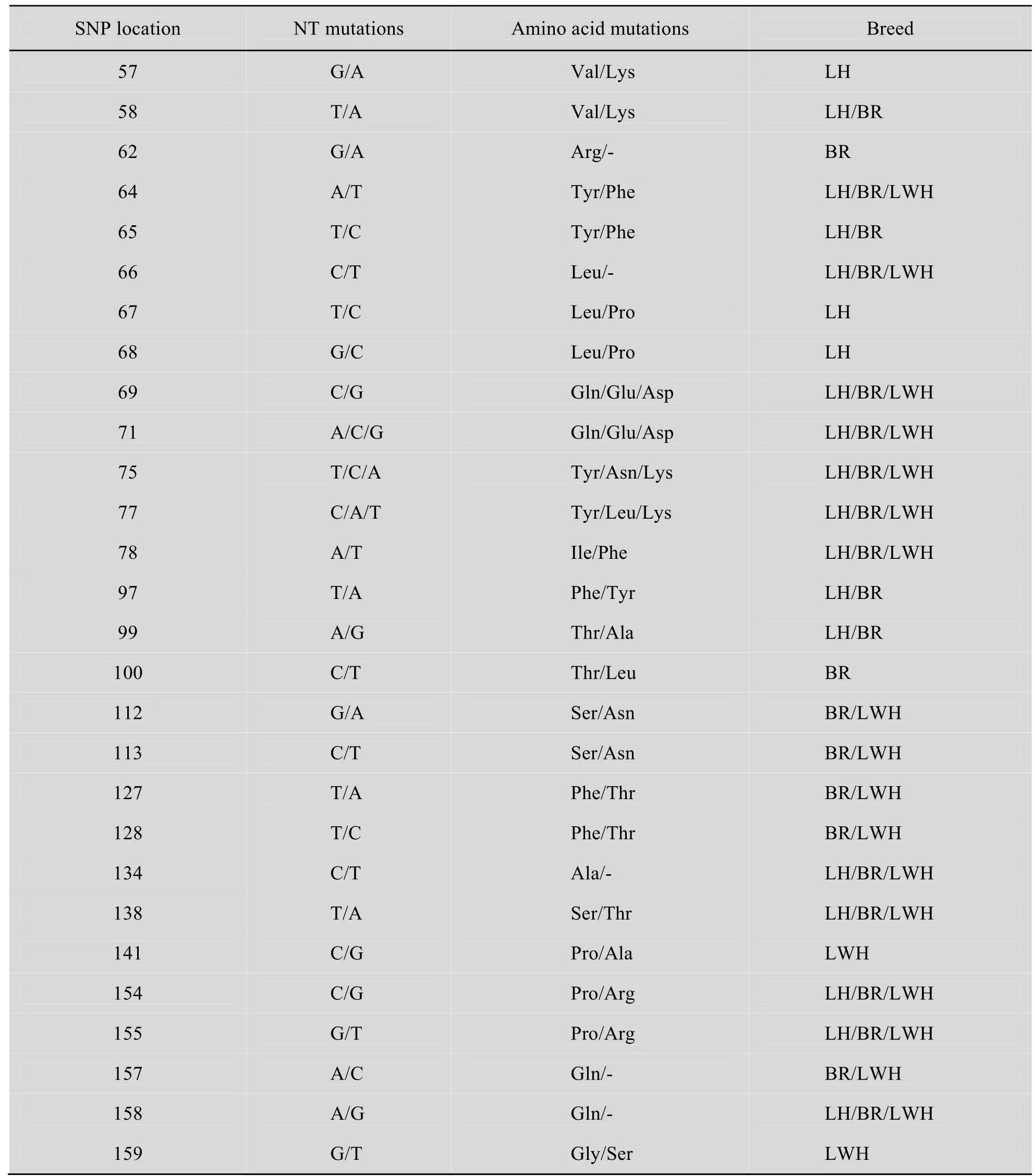
表4 三个地方鸡种MHC B-L BII区基因SNPs以及所引起的氨基酸变异Table 4 SNPs in MHC B-L BII and amino acid mutations in three indigenous chicken populations
2.3 三个地方鸡种 MHC B-L BII基因不同SNP位点与免疫指标的相关性
对 3个地方鸡品种MHC B-L BII区基因exon2的SNP位点与免疫性状进行关联分析,结果如表5所示。在28个SNP位点中,与SRBC特异性抗体滴度显著相关的位点有 5个位点(P<0.05),与H5抗体滴度有显著相关的位点有5个位点 (P<0.05),与H9抗体滴度有显著相关的位点有 4个 (P<0.05),与 ND抗体滴度显著相关的位点有9个 (P<0.05)。除A99G、T128C外,其余7个位点在3个品种中同时存在变异。位点G97A、T138A位点在3个品种中均有变异,并且位点T97A在济宁百日鸡中的变异与ND抗体滴度显著相关 (P<0.05),在莱芜黑鸡中与SRBC抗体滴度显著相关 (P<0.05),在汶上芦花鸡中与 H9抗体滴度显著相关 (P<0.05);位点T138A在汶上芦花鸡和济宁百日鸡中与H9抗体滴度显著相关 (P<0.05),由丝氨酸突变为色氨酸;这两个位点与绵羊红细胞抗体、新城疫、禽流感抗体滴度均显著相关 (P<0.05)。

表5 三个地方鸡种MHC B-L BII不同位点与免疫指标的相关性Table 5 Relationships between different sites of MHC B-L BII and the immune traits in three breeds
3 讨论
3.1 三个地方鸡品种间抗体滴度的比较分析
本研究结果表明:3个地方鸡品种免疫 6 d后 SRBC 抗体滴度均值在 (6.94±0.15)~(8.00±0.16),与吴春梅[17]报道的北京油鸡和来航蛋鸡 SRBC免疫后 6 d的抗体滴度的均值在6.9~9.1结果相近。3个品种中莱芜黑鸡的SRBC抗体滴度最高,其相应的ND、H5和H9抗体滴度也高,并与另外两个品种差异极显著 (P<0.01)。
SRBC是一种多价的非致病性抗原,可以刺激机体产生体液免疫应答。Siegel等[18]研究报道,SRBC的抗体滴度的水平代表了机体产生抗体总量的能力。由研究结果推断,莱芜黑鸡在这3个品种中机体产生总体抗体能力最强。Parmentier等[19]证实,SRBC抗体滴度高的家系对感染性疾病的抗性优于抗体滴度低的家系,本实验也证实了这一点。
本实验的3个地方品种在SRBC、H5和H9 3个指标中抗体滴度高低为LWH>BR>LH,在一定程度上说明LWH比BR和LH产生总体抗体滴度的能力强。但是在ND抗体滴度指标中,抗体滴度高低依次为 LWH>LH>BR,仍然是LWH最高,BR最低。导致ND抗体滴度与另外3个抗体滴度不一致的原因还需要进一步研究。但本研究从总体上能够说明 SRBC抗体滴度的高低代表了机体产生抗体能力的高低,SRBC抗体滴度高,其他相应的指标也相对较高。同时该研究结果也为3个地方品种的临床疫苗的使用提供理论参考。
3.2 三个地方鸡品种MHC B-L BII基因多态位点及其与免疫指标相关性的比较分析
三个地方品种鸡MHC B-L BII基因具有丰富的多态性,并且多态性更多的体现在氨基酸变异上。本研究通过对 3个山东地方鸡种MHC B-L BII基因的研究,在MHC B-L BIIexon 2上发现了28个变异位点,其中有12个变异位点为3个品种所共有。在汶上芦花鸡、莱芜黑鸡和济宁百日鸡中分别检测到 19、19和 22个变异位点,3个地方品种核苷酸同源性 (89.14%、89.14%和87.42%) 高于氨基酸同源性 (62.7%、62.7%和58.1%)。本研究选取山东地方家禽品种资源为研究对象,一定程度上证明了MHC B-L BII基因在不同地方品种资源间存在高度多态性。
本研究结果与刘立波等[20]、张泽樘等[21]、顾玉兰等[22]研究地方品种MHC B-L基因的结果基本一致,都从不同品种中证实了MHC B-L高度的遗传变异,并且核苷酸同源性高于氨基酸的同源性。刘立波等[20]结果表明:在 9个地方品种(246个样本)MHC B-L基因exon 2的整个exon 2 267 bp核苷酸序列内,共发现了84个突变,突变率为0.3146,充分显示出了MHC B-L基因丰富的遗传多样性和较高的选择潜力。而张泽樘等[21]对400个麻羽鸡DNA样品MHC B-L基因外显子2进行测序,共筛查到42个SNP位点,该序列所编码的90个氨基酸残基中,共发现有27个氨基酸残基发生改变,核苷酸序列的同源性(84.4%) 高于氨基酸序列的同源性 (70%)。顾玉兰[22]在 6个地方品种发现MHC B-LBⅡ基因外显子2核苷酸序列的同源性 (93.75%) 高于氨基酸序列的同源性 (91.37%)。徐日福[23]、李尚民等[24]的研究也有类似的结论。这些研究共同点大都针对地方品种MHC B-L BII基因多态性,并没有进行多态性与免疫性状之间的关联分析。
本研究进行了3个地方品种MHC B-L BII基因多态性位点与 SRBC、ND、H5和 H9抗体滴度的关联分析。结果表明地方品种MHC B-L BII基因多态性与测定的免疫性状存在不同程度的相关性,发现 14个 SNPs位点与 SRBC、ND、H5和H9抗体滴度显著相关 (P<0.05)。通过研究4个抗体指标抗体水平的高低,结果发现一些SNP位点是相重合的,并且和ND抗体应答相关联的位点有9个。这就暗示了在以后的选择中,4个指标中只选择ND作为免疫指标就基本代表了这4个指标相对较高。刘立波对500只白来航蛋鸡为研究对象,发现37个突变位点中,与IgG含量、LPS含量、AI、ND和SRBC抗体滴度显著相关的SNP位点分别有5、1、11、18和6个,也获得同样的结论。翟飞等[25]用微卫星方法对雪山鸡MHC B区多态性以及血型与IgM、IgG等免疫指标进行关联分析,得出B2血型综合抗性指数好于其他血型 (P<0.05)。
本研究通过3个地方品种的不同类型免疫滴度等免疫性状的测定及与基因变异的关联分析,表明不同免疫能力存在个体甚至品种水平上的遗传差异,不同免疫性状存在显著的优势基因型,这在一定程度上也更能说明选择免疫性状进行遗传标记选择的可能性,通过标记辅助选择提高个体或者群体的抗病力是可行的。
[1]Kroemer G, Zoorob R, Auffray C. Structure and expression of a chicken MHC class I gene.Immunogneties, 1990, 31 (5/6): 405−409.
[2]Brown JH, Jardetzky T, Saper MA, et al. A hypotheticial model of the foreign antigen-binding site of class Ⅱ histocompatibility molecules.Nature, 1988, 332(6167): 845−850.
[3]Dunnington EA, Larsen CT, Gross WB, et al.Antibody responses to combinations of antigens in white Leghorn chickens of different background genomes and major histocompatibility complex genotypes. Poult Sci, 1992, 71(11): 1801−1806.
[4]Ewald SJ, Ye X, Avendano S, et al. Associations of BF2 alleles with antibody titers and production traits in commercial pure line broiler chickens.Anim Genet, 2007, 38(2): 174−176.
[5]Chen FF, Pan L, Geng ZX, et al. Origin evolvement and resistance mechanism of polymorphism of MHC molecules. Acta Vet Zootech Sin, 2010,41(9): 1061−1067 (in Chinese).
陈芳芳, 潘玲, 耿照玉, 等. MHC分子多态性的起源、演变与抗病机理. 畜牧兽医学报, 2010,41(9): 1061−1067.
[6]Dalgaard T, Boving MK, Handberg K, et al. MHC expression on spleen lymphocyte subsets in genetically resistant and susceptible chickens infected with Marek’s disease virus. Viral Immunol, 2009, 22(5): 321−327.
[7]Liu G, Wang Q, Tong T, et al. Construction and functional test of a chicken MHC-I(BF2*15)/peptide tetramer. Vet Immunol Immunopathol, 2008, 122(1/2): 1−7.
[8]Chen F, Pan L, Chao W, et al. Character of chicken polymorphic major histocompatibility complex class II alleles of 3 Chinese local breeds.Poult Sci, 2012, 91: 1097−1104.
[9]Goto RM, Wang Y, Taylor RL Jr, et al. BG1 has a major role in MHC-linked resistance to malignant lymphomain the chicken. Proc Natl Acad Sci USA,2009, 106(39): 16740−16745.
[10]Mona S, Crestanello B, Bankhead-Dronnet S, et al.Disentangling the effects of recombination,selection, and demography on the genetic variation at a major histocompatibility complex class II gene in the alpine chamois. Mol Ecol, 2008, 17(18):4053−4067.
[11]Ling F, Wei LQ, Wang T, et al. Characterization of the major histocompatibility complex class II DOB,DPB1, and DQB1 alleles in cynomolgus macaques of Vietnamese origin. Immunogenetics, 2011,63(3):155−166.
[12]Alcaide M, Lemus JA, Blanco G, et al. MHC diversity and differential exposure to pathogens in kestrels (Aves: Falconidae). Mol Ecol, 2010, 19(4):691−705.
[13]Hudson L, Hay FC. Haemagglutination in Practical Immunology. London: Blackwell Scientific, 1976:125−130.
[14]Tang XY, Li HY, Tian GB. GB/T 18936-2003.Diagnostic techniques for highly pathogenic avian influenza, 2003 (in Chinese).
唐秀英, 李海燕, 田国斌. GB/T 18936-2003. 高致病性禽流感诊断技术, 2003.
[15]Lu HL,Wu YT, Wang ZL, et al. GB/T 16550-2008 Diagnostic techniques for newcastle disease, 2008(in Chinese).
刘华雷, 吴艳涛, 王志亮, 等. GB/T 16550-2008新城疫诊断技术, 2008.
[16]Sambrook J, Fritsch EF, Maniatis T. Molecular Cloning: A Laboratory Manual. 2nd ed. New York:Cold Spring Harbor Laboratory, 1989.
[17]Wu CM. Study of molecular markers with immune traits of chickens of MHC B-F gene SNPs [D].Yangzhou: Yangzhou University, 2007 (in Chinese).
吴春梅. 鸡 MHC B-F 区基因 SNPs 分子标记与免疫性状关系的研究[D]. 扬州:扬州大学,2007.
[18]Siegel PB, Gross WB, Cherry JA. Correlated responses of chickens to selection for production of antibodies to sheep erythrocytes. Anim Blood Groups Biochem Genet, 1982, 13(4): 291−297.
[19]Parmentier HK, Abuzeid SY, Reilingh GD, et al.Immune responses and resistance toEimeria acervulinaof chickens divergently selected for antibody responses to sheep red blood cells. Poult Sci, 2001, 80(7): 894−900.
[20]Liu LB. Genetic variance analysis of the MHC B-L gene in different chicken breed and its association with immune traits [D]. Beijing: Chinese Academy of Agricultural Sciences, 2009 (in Chinese).
刘立波. 中外鸡种 MHC B-L基因遗传变异及与免疫性状关系的研究[D]. 北京: 中国农业科学院, 2009.
[21]Zhang ZT, Gong C, Chen ZY, et al.Association of MHC B-L gene polymorphism with susceptibility of salmonella pullorum. Chin Vet Sci, 2012, 42(1):13−18 (in Chinese).
张泽樘, 龚超, 陈卓宇, 等. MHC B-L基因多态性与鸡白痢沙门氏菌易感性的关联分析. 中国兽医科学, 2012, 42(1): 13−18.
[22]Gu YL. Study of the genetic structure and major histocompatibility complex gene genetic diversity in six native chicken breeds [D]. Yangling:Northwest A & F University, 2008 (in Chinese).
顾玉兰. 六个地方鸡品种遗传结构及其 MHC基因的遗传变异研究[D]. 杨凌: 西北农林科技大学, 2008.
[23]Xu RF. The study of Chinese local chicken breeds theMHC B-LB IIthe B-G gene variation and its population genetic structure [D]. Wuhan: Central China Agricultral University, 2005 (in Chinese).
徐日福. 中国部分地方鸡种 MHC B-LBⅡ、B-G基因变异及其群体遗传结构研究 [D]. 武汉: 华中农业大学, 2005.
[24]Li SM, Yuan XT, Dai GJ, et al. Polymorphism studies of MHC B-LB II gene sequences in Jinghai Yellow Chicken. Agri Sci Jiangsu, 2008(3): 67−69(in Chinese).
李尚民, 原新廷, 戴国俊, 等. 京海黄鸡MHC B-LB II基因序列多态性研究. 江苏农业科学,2008(3): 67−69.
[25]Zhai F, Ma T, Chen DS, et al. Association between genetic diversity of MHC bloodtype and some resistant traits of chicken. China Poulty, 2012,34(24): 21−24 (in Chinese).
翟飞, 马腾, 陈东升, 等. 鸡 MHC 多态性及血型与部分免疫指标的关联分析. 中国家禽, 2012,34(24): 21−24.
