阪崎肠杆菌α-葡萄糖苷酶的原核表达及其多克隆抗体制备
2013-09-03徐晓可吴清平张淑红张菊梅李程思郭伟鹏
徐晓可,吴清平,张淑红,张菊梅,李程思,郭伟鹏
(广东省菌种保藏与应用重点实验室,广东省微生物应用新技术公共实验室,广东省华南应用微生物重点实验室-省部共建国家重点实验室培育基地,广东省微生物研究所,广东广州510070)
阪崎肠杆菌(Enterobacter sakazakii)是奶制品中备受关注的一种致病菌[1-3],FAO/WHO将阪崎肠杆菌列为婴儿配方奶粉中的A类致病菌。由于阪崎肠杆菌在奶粉中的污染水平很低,而且奶粉不是无菌产品,可能会存在各种杂菌的污染,因此在检测阪崎肠杆菌时会有其他菌的干扰或者竞争,免疫磁珠分离技术会在一定程度上解决这个问题。免疫磁珠能特异性吸附目的细菌,可有效地富集大量样品中的少量病原菌,为解决环境及食品中细菌富集问题提供了一种有效手段,在食品微生物检测领域得到了广泛的应用[4-6]。免疫磁珠分离方法的特异性与所用的抗体密切相关,抗体制备是免疫磁珠的基础。本研究的目的是克隆和原核表达阪崎肠杆菌α-葡萄糖苷酶基因malA,获得阪崎肠杆菌α-葡萄糖苷酶融合蛋白,制备特异性好的兔抗α-葡萄糖苷酶的多克隆抗体以用于研制免疫磁珠。
1 材料与方法
1.1 材料与仪器
阪崎肠杆菌ATCC 29544、大肠杆菌DH5α、表达质粒pET22b(+)由本实验室保存;pMD 19-T Simple Vector 购自TaKaRa公司;大肠杆菌BL21(DE3)购自TIANGEN公司;限制性内切酶BamHⅠ、HindⅢ、T4 DNA连接酶 购自TaKaRa公司;DNA聚合酶(Dream TaqTM Green PCR Master Mix(2×))、DNA marker、蛋白marker 购自Fermentas公司;PCR产物回收试剂盒、PCR产物纯化试剂盒、质粒小量抽提试剂盒 购自上海生工生物工程有限公司;弗氏佐剂和弗氏不完全佐剂 购自Sigma公司;其他试剂 国产分析纯;实验用的各种培养基 均购自广东环凯微生物科技有限公司;新西兰大白兔 购自中山医科大学试验动物中心。
PCR仪 美国BIO-RAD公司;凝胶分析成像系统 美国GE公司;微量离心机 德国Ependorf公司;荧光显微镜 德国LEICA公司。
1.2 实验方法
1.2.1 引物设计与合成 参考Genebank公布的序列,设计正反向引物,由上海生工生物工程有限公司合成。引物序列为
ESF:5’-TTTGGATCCGATGAGTGAAGCACCGA CGCAG-3’;
ESR:5’-GGCGAAGCTTCGACGTCAGTTTATAA ACCCG-3’。引物ESF和ESR下划线序列分别表示BamHⅠ和HindⅢ酶切位点。
1.2.2 malA基因的PCR扩增及克隆 以阪崎肠杆菌ATCC29544基因组DNA为模板进行PCR扩增,体系为50μL,Dream TaqTMGreen PCR Master Mix(2×)25μL,引物ESF和ESR各2μL,DNA模板2μL,ddH2O 19μL。PCR反应条件为:94℃ 5min;94℃ 30s,58℃ 45s,72℃1min,35个循环;72℃ 7min。回收PCR产物,与pMD19-T Simple Vector连接,连接产物转化大肠杆菌DH5α,利用上海生工生物工程有限公司的UNIQ-10柱式质粒小量抽提试剂盒抽提质粒,进行BamHⅠ/HindⅢ双酶切鉴定及测序鉴定。
1.2.3 表达载体的构建 将上述鉴定正确的重组质粒和pET22b(+)质粒载体用BamHⅠ、HindⅢ双酶切,将纯化的DNA片段与线性化的pET22b(+)载体连接,热激转化大肠杆菌BL21(DE3)感受态细胞。提取质粒、PCR及酶切鉴定。
1.2.4 蛋白的诱导表达及纯化 挑选阳性菌株和对照菌株的单菌落,接种于5mL含有100μg/mL氨苄青霉素的LB液体培养基,37℃ 200r/min培养至OD600为0.6时,分别加入终浓度为0.2、0.4、0.6、0.8、1.0mmol/L的IPTG诱导3、4、5h,将诱导产物进行SDS-PAGE检测,确定最佳IPTG诱导浓度和诱导时间。
按上述所确定的最佳参数诱导表达重组蛋白,将收集到的诱导菌液超声至澄清透亮,收集包涵体;用6mol/L的尿素洗涤包涵体进行SDS-PAGE蛋白分离;胶上割取目的带,加入适量的PBS溶液进行捣碎,置4℃缓慢搅拌过夜;离心12000r/min 5min,收集上清液,并装入透析袋,用PEG-20000浓缩,置-80℃冰箱保存。
1.2.5 多克隆抗体制备及鉴定 新西兰大白兔(雌雄各一只,13周兔龄,体重为2.4kg)适应性饲养1周后,初免取1mg/只纯化蛋白用Sigma完全佐剂充分乳化,背部皮下多点注射;初免2周后加强免疫4次,每次间隔1周,前3次免疫剂量为0.5mg/只,蛋白用Sigma不完全佐剂乳化,背部皮下多点注射;末次加强免疫剂量为2mg/只,耳缘静脉注射,3d后取血。在免疫前采5mL阴性血液,用于阴性血清检测用。间接ELISA方法测定抗血清效价。
免疫荧光法鉴定与阪崎肠杆菌表面结合能力:首先,将一定浓度阪崎肠杆菌菌液100μL滴加至载玻片上,在超净台中自然风干,然后滴加抗血清100μL,37℃孵育lh;用PBST洗涤载玻片3次,用FITC标记的羊抗兔IgG(1∶100)37℃孵育lh;PBST洗涤4次,然后在荧光显微镜下观察阪崎肠杆菌菌体的发光情况。
2 结果与分析
2.1 malA基因的克隆及鉴定

图1 malA基因的PCR扩增产物电泳图Fig.1 Agarose gel electrophoresis of PCR amplification product

图2 pMD19-malA的PCR鉴定Fig.2 PCR identification of recombinant plasmid pMD19-malA

图3 pMD19-malA的酶切鉴定Fig.3 Identification of recombinant plasmid pMD19-malA
利用设计的引物扩增出约1600bp左右的目的基因片段,与malA基因预期大小相符(图1)。重组质粒经PCR鉴定可以扩增出1600bp左右片段(图2),证实malA基因已成功克隆到T载体。用BamHⅠ、HindⅢ进行双酶切亦获得1600bp左右的片段(图3)。经测序鉴定,malA基因全长1677bp,其序列与Genebank的序列具有100%的同源性。
2.2 malA基因表达质粒的构建及鉴定
重组表达质粒pET22b-malA双酶切的电泳结果如图4所示,在约1600bp处出现目的条带(与预期相符),说明目的基因成功插入表达载体pET22b中。

图4 pET22b-malA的酶切鉴定Fig.4 Identification of recombinant plasmid pET22b-malA
2.3 蛋白诱导表达及纯化
SDS-PAGE结果(图5)表明,其最优化的表达条件是37℃下用0.8mmol/L IPTG诱导5h。重组蛋白以包涵体形式存在(图6)。切胶纯化的目的蛋白分子量约为67ku(图7)。

图5 SDS-PAGE分析不同IPTG浓度和不同诱导时间对蛋白表达的影响Fig.5 SDS-PAGE analysis of protein expression with different IPTG concentration and different induction time
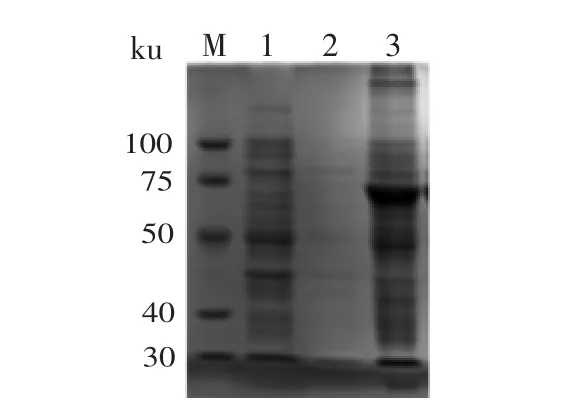
图6 融合蛋白的可溶性分析Fig.6 Soluble analysis of fusion protein

图7 融合蛋白切胶纯化电泳图Fig.7 SDS-PAGE analysis of fusion
2.4 多克隆抗体效价
用间接ELISA检测其效价约为5×105(图8)。
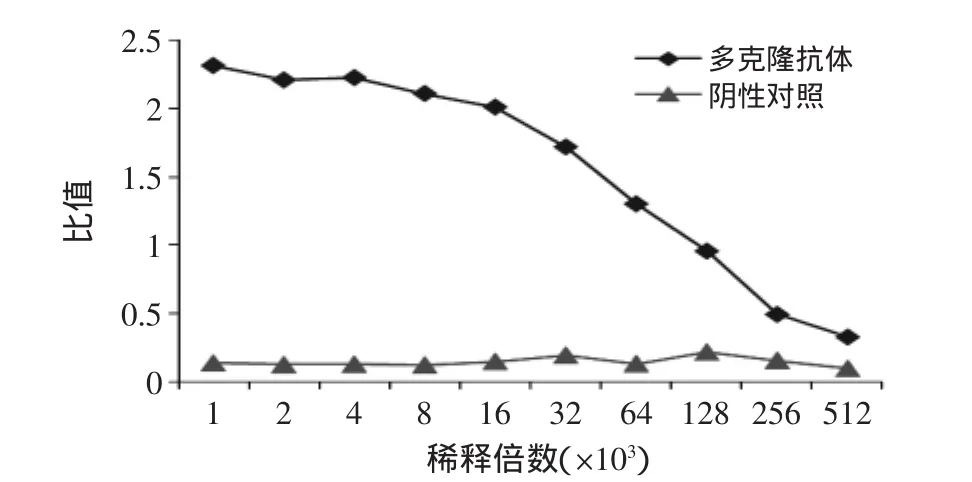
图8 多克隆抗体效价曲线Fig.8 Titer cure of polyclonal antibody
2.5 多克隆抗体与阪崎肠杆菌菌体的结合
荧光显微镜观察的结果显示多抗能与阪崎肠杆菌菌体有较好的特异性结合(图9)。

图9 多抗与阪崎肠杆菌菌体结合Fig.9 Combination of the polyclonal antibody and E.sakazakii
3 讨论
由于阪崎肠杆菌是条件致病菌,只是对免疫力低下的人群造成危害,虽有报道对成年人也有影响,但危害较小,所以一直以来并未对食品中阪崎肠杆菌进行检测控制。但是自从阪崎肠杆菌造成的危害频频报道后,食品中特别是婴幼儿配方奶粉中阪崎肠杆菌的检测就显得非常重要[7]。目前国内外已建立了多个检测标准,包括国际标准化组织ISO标准、美国FDA标准、中国国家标准GB和行业SN标准,这些标准主要还是沿用传统的检测方法,检测周期比较长。近年来国内外还发展了针对阪崎肠杆菌的分子生物学检测方法[8-12]。上述方法都涉及样品前处理,其中免疫磁珠分离技术是样品前处理的有效手段,但目前市场上没有针对阪崎肠杆菌的多克隆抗体和单克隆抗体,所以制备抗体对免疫磁珠方法的建立十分必要。
阪崎肠杆菌的α-葡萄糖苷酶活性是区别于肠杆菌科其他细菌的一个重要特征,在文献报道的所有样品分离株中均呈现为阳性,α-葡萄糖苷酶活性能够分解p-nitrophenyl-alpha-D-glucoside底物,呈现蓝绿色[13],这也是采用传统生化培养法检测阪崎肠杆菌的关键性步骤。根据Genebank该基因的序列分析可知,其表达产物为跨膜蛋白,这与杨捷琳等[14]的实验结果一致。因此,它可以做为检测阪崎肠杆菌的一个很好的靶点。在抗原设计上采用α-葡萄糖苷酶基因malA的全长,插入到pET-22b(+)原核表达载体中。由于该载体为高表达载体,融合蛋白的表达量很高,表达的蛋白质以不溶性包涵体形式存在。因此,本研究采用包涵体作为抗原,利用割胶回收的融合蛋白制备多克隆抗体,结果证明这种方法在制备多克隆抗体时是可行的,且方法操作简便。为探讨该多抗能与阪崎肠杆菌表面结合,在多抗与阪崎肠杆菌孵育1h后,使用FITC标记的羊抗兔二抗处理,然后在荧光显微镜下观察阪崎肠杆菌菌体的发光情况。结果显示,多克隆抗体能与阪崎肠杆菌表面结合。多克隆抗体的制备成功为进一步研制免疫磁珠提供了重要工具,为快速灵敏检测阪崎肠杆菌奠定基础。
[1]刘秀梅.婴儿配方奶粉中的阪崎肠杆菌-食品安全控制的新目标[J].中国食品卫生杂志,2004,16(5):385-388.
[2]李志勇,王菊芳.乳粉中阪崎肠杆菌的检测[J].中国乳品工业,2004(5):158.
[3]裴晓燕,刘秀梅.中国市售配方粉中阪崎肠杆菌和其他肠杆菌的污染状况[J].中国食品学报,2006,6(5):7-9.
[4]张璇,鲜瑶.免疫磁珠技术及其在食品微生物检测中的应用[J].农产品质量与安全,2011(1):40-43.
[5]徐晓可,吴清平,张菊梅,等.免疫磁珠分离技术在常见食源性致病菌检测中的应用[J].中国卫生检验杂志,2009,19(5):1196-1198.
[6]Gottschalk M,Lacouture S,Odierno L.Immunomagnetic isolation of Streptococcus suis serotypes 2 and 1/2 from swine tonsils[J].J Clin Microbio,1999,37(9):2877-2881.
[7]张爱霞,生庆海,张涛.食品中阪崎肠杆菌分析及其检测[J].测定方法,2005,33(10):42-44.
[8]李兆辉,柳增善,张大伟.浅论阪崎肠杆菌的危害及其检测方法[J].现代畜牧兽医,2006(5):29-31.
[9]Hassan AA,Akineden O,Kress C,et al.Characterization of the gene encoding the 16S rRNA of Enterobacter sakazakii and development of a species-specific PCR method[J].Int J Food Microbiol,2007,116:214-220.
[10]Zhou YH,Wu QP,Xu XK,et al.Development of an immobilization and detection method of Enterobacter sakazakii from powdered infant formula[J].Food Microbiol,25(5):648-652.
[11]Ye,YW,Wu QP,Yao L,et al.Comparison of PCR and ISO methods for detection of Enterobacter sakazakii in infant formula[J].Foodborne Pathog Dis,2009,6(10):1229-1234.
[12]张淑红,吴清平,徐晓可,等.LAMP法在阪崎肠杆菌快速检测中的应用[J].食品与机械,2011,27(5):111-114.
[13]Simmons BP,Gelfand MS,Haas M,et al.Enterobacter sakazakiiinfections in neonates associated with intrinsic contamination of a powdered infant formula[J].Infect Control Hosp Epidemiol,1989,10(9):398-401.
[14]杨捷琳,孟逊,黄应峰,等.阪崎肠杆菌α-葡萄糖苷酶基因克隆、表达及活性研究[J].食品科学,2008,29(2):213-217.
