羧甲基壳聚糖包覆薏苡仁油脂质体包覆率测定方法的研究
2013-09-03白春清罗国伟钟红兰赵士强
白春清,熊 华,罗国伟,史 卿,钟红兰,阮 霞,赵士强,赵 强
(南昌大学食品科学与技术国家重点实验室,江西南昌330047)
薏苡仁为禾本科(Gramineae)薏苡属(Coix L.)草本植物薏苡(Coix lachryma-jobi Linn)的成熟种仁[1]。作为药食同源性食物,薏苡仁在亚洲地区有上千年的食用及药用历史,其营养丰富且具有健脾、补肺、清热、利湿等功效,《本草纲目》中称其乃上品养心药[2]。薏苡仁油为薏苡仁中提取的脂溶性物质,其含量约为薏苡仁的2%~7%,国内外研究证实薏苡仁油具有增强免疫力、抗肿瘤、降血脂等功能[3-6]。但薏苡仁油口服吸收生物利用率低,且易氧化分解,限制了其在食品及医药工业中的应用和发展[2]。脂质体是一种新型的纳米胶囊制备技术,多用于药物和功能性成分的载体,其脂质双分子结构可将脂溶性成分载入,改善油溶性物质的亲水性及其在胃肠道中的生物利用率[7-8]。但常规脂质体易出现稳定性差,聚集、分层现象,长期存放易引起药物渗漏等问题[7]。若以水溶性聚合物对常规脂质体进行包覆,可在其表面形成保护膜,减少脂质体与周围环境的交互作用,提高常规脂质体及薏苡仁油的稳定性[9]。羧甲基壳聚糖是壳聚糖经羧甲基化而制得的水溶性多糖,其良好的生物相容性、可降解性、无免疫原性及无毒等优点,使其成为包覆薏苡仁油脂质体的首选水溶性聚合物[10-11]。羧甲基壳聚糖对常规脂质体的包覆效果将直接影响脂质体的稳定性。但是目前国内关于羧甲基壳聚糖包覆脂质体的文献报道较少[12-13],而现有文献中对包覆率这一重要指标又无从考查,这对制备高质量的聚合物包覆脂质体来说无疑是一个缺陷。本实验在查阅众多文献的基础上得知硫氰铁铵分光光度法是测定磷脂含量比较准确简单的方法,采用该方法测定未包覆脂质体中磷脂含量及总磷脂含量,即可在侧面定量测定包覆率。为了得到未包覆脂质体及准确定量出脂质体中的磷脂,本文拟采用离心法将未包覆脂质体与包覆脂质体分离,用乙醇-超声法对未包覆脂质体破壁令脂质体中的磷脂充分释放并经氯仿提取后,通过硫氰铁铵法测定的磷脂含量,再根据总磷脂的含量计算包覆率,为更好地评价聚合物包覆脂质体包覆效果提供简捷准确的测定方法。
1 材料与方法
1.1 材料与设备
蛋黄卵磷脂 沈阳仙峰科技发展有限公司;胆固醇 上海蓝季科技发展有限公司;薏苡仁油 广州合诚三仙生物科技有限公司;羧甲基壳聚糖 上海晶纯试剂有限公司;磷酸二氢钠、磷酸氢二钠、三氯化铁、氯仿 国药集团化学试剂有限公司;硫氰酸铵 浙江温州化学用料厂。
THZ-82恒温振荡器 常州国华电器有限公司;超声波发生器 上海科导超声仪器有限公司;RE-52AA旋转蒸发仪 上海亚荣生化科技仪器厂;SHB-3循环水多用真空泵 郑州杜甫仪器厂;紫外可见分光光度计 北京普析通用仪器有限责任公司;TDL-5-A台式离心机 上海安亭科学仪器厂;BS224S分析天平 赛多利斯科学仪器有限公司。
1.2 实验方法
1.2.1 包覆脂质体的制备[14]按照磷脂∶胆固醇=3∶1称取膜材及适量薏苡仁油,向其中加入适量的乙醇溶解,用蠕动泵将其注入到pH6.8的磷酸缓冲液中,于45℃振荡水化20min后,旋转蒸发除去乙醇,超声处理30min得常规脂质体悬液,将其注入到羧甲基壳聚糖溶液中,磁力搅拌60min后,间歇超声处理8min得羧甲基壳聚糖包覆脂质体。
1.2.2 测定波长的确立 根据硫氰铁铵不溶于氯仿,但其与磷脂反应生成的红色络合物能溶于氯仿,且在某个波长处有最大吸收,而磷脂与薏苡仁油等在此处无吸收或吸收很小,通过测定该络合物的吸光度即可测定脂质体中磷脂的含量[14-15]。对于脂质体而言磷脂是构成其囊壁的主要成分,本实验采用乙醇破壁法将脂质体的囊壁破坏,充分释放出所有磷脂,然后采用硫氰酸铵法测定磷脂的含量。
溶液的配制:参照林筱琦等[15]的方法分别配制浓度皆为1mg/mL的磷脂、薏苡仁油溶液。按照1.2.1分别制备未包覆的空白脂质体及薏苡仁油脂质体。
测定波长的确立:精密吸取1mg/mL蛋黄磷脂溶液0.6mL置于试管中,加硫氰铁铵溶液8.0mL,再补加氯仿,使试管中氯仿的最终体积为8.0mL。将上述溶液转移至25mL的分液漏斗中,充分振摇,静置,取下层,以氯仿为空白,在紫外可见分光光度计上于300~600nm范围内扫描,分别取相同体积的薏苡仁油,用乙醇-超声破壁的未包覆空白脂质体及薏苡仁油脂质体,采用同样的方法处理并进行扫描。
1.2.3 处理条件的确定 影响测定吸光度的关键因素包括包覆脂质体与未包覆脂质体是否完全分离、脂质体的壁是否完全打开等。本实验以吸光度为指标,确定离心条件及破壁条件。
破壁条件确定:结合文献资料[16]及预实验选择乙醇-超声法对常规脂质体进行破壁,并对乙醇用量及超声时间对吸光度的影响进行考察,确定破壁条件。
离心条件的确定:包覆脂质体与常规未包覆脂质体,能否完全分离,是影响准确测定的先决条件,以离心速度和离心时间对吸光度的影响进行了考察。
1.2.4 标准曲线绘制 精密吸取1mg/mL的磷脂溶液0.08、0.16、0.32、0.48、0.64、0.80mL置于试管中,其余按照1.2.2的方法操作,以氯仿为空白,在1.2.2所确定的测定波长处测定吸光度A,以A对浓度C(mg/mL)进行线性回归,绘制标准曲线。
1.2.5 回收率实验[16]精确称取磷脂1mg/mL,按配方[14]加入胆固醇、薏苡仁油、羧甲基壳聚糖适量,制备包覆脂质体。精密吸取包覆脂质体混悬液0.6mL,按1.2.3项下确定的条件进行离心分离及破壁处理后按照1.2.2的操作测定未包覆脂质体中磷脂的含量。另精确称取磷脂1mg/mL,用氯仿溶解之后按1.2.2操作。根据标准曲线方程计算磷脂含量及方法回收率。
1.2.6 精密度及重现性实验 按照1.2.5的方法制备包覆脂质体混悬液及磷脂溶液,分别于同日不同时间及不同日精密吸取包覆脂质体混悬液及磷脂溶液适量,按1.2.3项下条件打开未包覆包覆脂质体,以下操作同1.2.2。并按标准曲线计算磷脂含量,测定方法的精密度和重现性。
1.2.7 数据的统计处理 实验数据采用SPSS 12.0软件进行统计分析,数值以3次实验的均值表示,选取a=0.05进行显著性分析。
2 结果与讨论
2.1 最大吸收波长的确定
从图1中得知,磷脂与硫氰铁铵产生的络合物在470nm处有最大吸收(图1-a),而薏苡仁油脂质体、空白脂质体和磷脂溶液峰形一致(图1-b、c),薏苡仁油在470nm处吸收为负值,说明样品中的薏苡仁油对磷脂含量测定基本无干扰,故选择470nm为测定波长。
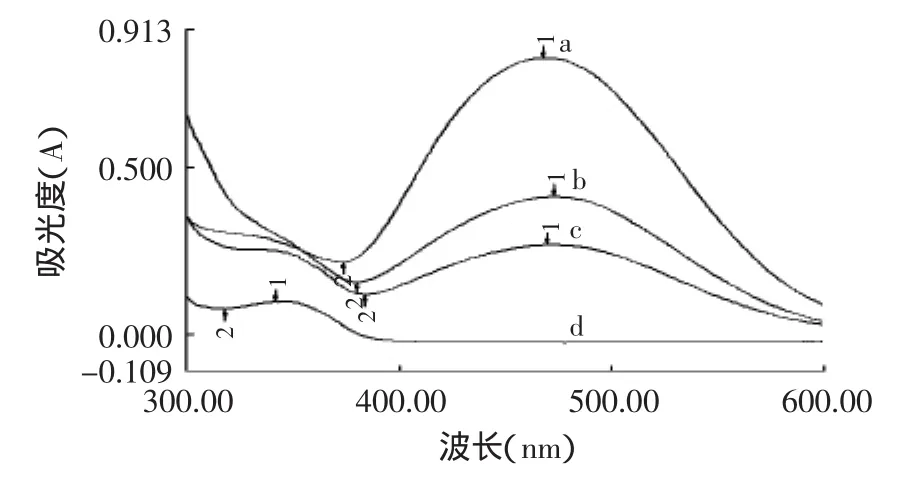
图1 磷脂紫外可见吸收光谱图Fig.1 Absorption spectrum of phospholipid
2.2 破壁条件的确定
根据表1可知,随着乙醇用量的增加,吸光度逐渐增大,脂质体破壁越来越严重;当乙醇用量为0.8mL时,吸光度基本稳定,继续增大乙醇用量,对吸光度几乎没影响,说明乙醇用量为0.8mL时能充分打开脂质体,从而释放出所有磷脂。固定乙醇用量为0.8mL,考察破壁时间对吸光度的影响,发现当超声时间为15min时,吸光度基本稳定,且继续延长破壁时间,吸光度变化不显著(p>0.05),证明此时样品破壁完全(表2)。上述结果确定薏苡仁油脂质体的最佳破壁条件为乙醇用量0.80mL,超声时间15min。

表1 乙醇用量对吸光度的影响Table 1 The effect of ethanol volume on absorbance
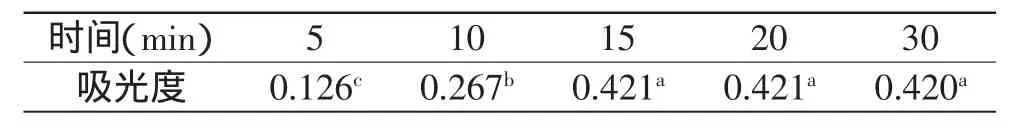
表2 超声时间对吸光度的影响Table 2 The effect of ultrasonic time on absorbance
2.3 离心条件的确定
2.3.1 离心速度[16]的确定 分别采用不同的离心速度3000、5000、10000、15000、20000r/min离心10min,然后精确取上层液适量,按照2.2破壁条件破壁,按照1.2.2的方法处理后于470nm波长处测定吸光度,考察离心速度对吸光度的影响。如图2所示,随着离心速度的升高,未包覆脂质体测定的吸光度值逐渐降低,脂质体分层逐渐明显,
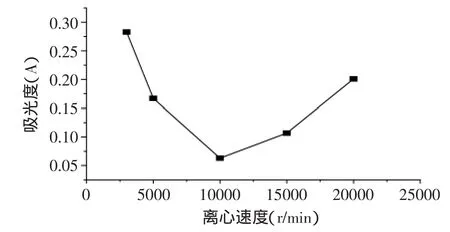
图2 离心速度对吸光度的影响Fig.2 Effect of centrifuging speed on absorbance
由于包覆脂质体的重量高于常规未包覆脂质体,随着离心速度的提高,越来越多的包覆脂质体沉于下层,而未包覆脂质体置上层,即未包覆脂质体测定的吸光度值逐渐降低;当离心速度为10000r/min离心时,样品的吸光度达到最小值,包覆脂质体能出现明显的分层;之后随着离心速度的升高吸光度逐渐升高,可能是由于离心速度过大,所被包覆的脂质体从羧甲基壳聚糖层中溢出变成未包覆脂质体所致。
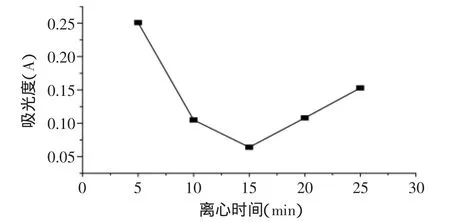
图3 离心时间对吸光度的影响Fig.3 The effect of centrifuging time on absorbance
2.3.2 离心时间的确定 按照确定10000r/min离心速度分别离心5、10、15、20、25min,然后精确取上层液适量,经破壁,测定吸光度,考察离心时间对吸光度的影响,结果如图3所示。
同样离心时间不足时,吸光度偏大,由上层液中残留包覆脂质体所致;当离心时间过长时,结果偏大,源于包覆脂质体从包覆层中渗漏,综上选取离心时间为15min。
2.4 包覆率的测定
将一系列浓度的薏苡仁油溶液在470nm处测定吸光度A后,以A对浓度C(mg/mL)进行线性回归(如图4所示),得标准曲线方程:A=10.963C+0.0156,相关系数R2=0.9991,在0.01~0.1mg/mL的浓度范围内,线性关系良好。包覆率计算公式为:

式中:C1—包覆脂质体离心后测得上清液中磷脂的浓度;C0—包覆脂质体未经离心直接测得磷脂的总浓度。
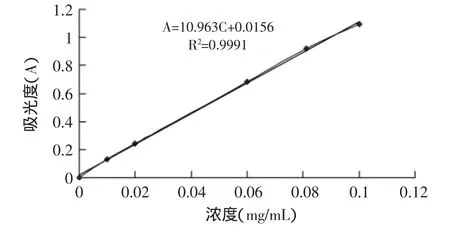
图4 磷脂标准曲线Fig.4 The standard curve of phospholipid
2.5 回收率实验
本实验测定的回收率实验结果如表3所示,磷脂及脂质体中平均回收率均高于99%,RSD<2%,能满足脂质体中磷脂测定的要求[15]。
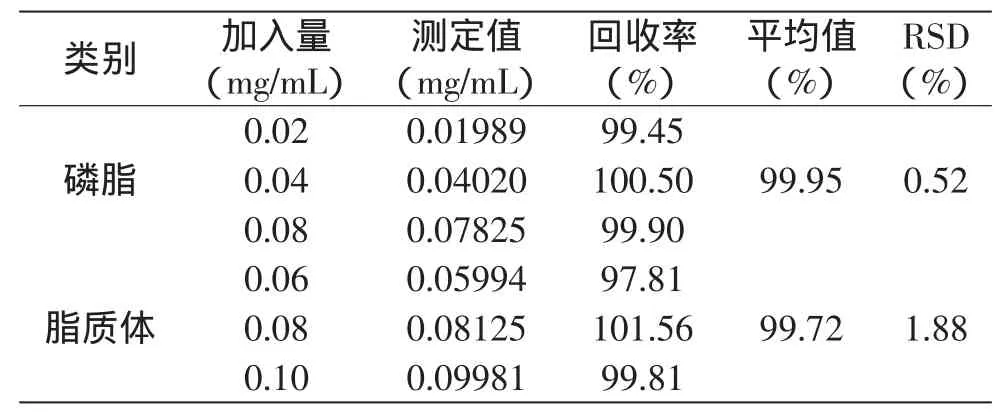
表3 回收率实验结果Table 3 Result of recovery
2.6 精密度及重现性实验

表4 精密度及重现性实验结果Table 4 Result of precision and reproducibility
精密度及重现性实验结果如表4所示,磷脂溶液及脂质体的测定结果的日内、日间平均值均高于97%,RSD<5%,说明该方法的精密度及重现性较好[16]。
3 结论
3.1 磷脂与硫氰酸铵产生的络合物在470nm处有最大吸收,而薏苡仁油脂质体、空白脂质体和磷脂溶液峰形一致,薏苡仁油在470nm处吸收为负值,样品中的薏苡仁油对磷脂含量测定基本无干扰,故选择470nm为测定波长。磷脂标准曲线为A=10.963C+0.0156,相关系数R2=0.9991,在0.01~0.1mg/mL的浓度范围内,线性关系良好。
3.2 采用离心的方法将包覆脂质体与未包覆脂质体分离,并结合乙醇-超声法破壁未包覆脂质体,进而计算磷脂含量及包覆率,经回收率、精密度及重现性实验,验证该方法的可行性。实验采用的离心分离速度为10000r/min,时间15min;破壁条件为超声处理15min、乙醇用量0.8mL;该方法回收率高于99%,精密度及重现性高于97%。
[1]吴红静,章英.薏苡仁营养成分及功能食品研究概况[J].雅安职业技术学院学报,2009,23(4):8-9.
[2]范世忠.药食兼用薏苡仁[J].药膳食疗,2002,21(5):334.
[3]杨玲,苏维埃,钱建.薏苡仁油脂的化学成分分析[J].食品科学,2001,22(5):60-62.
[4]温晓蓉.薏苡仁化学成分及抗肿瘤活性研究进展[J].辽宁中医药大学学报,2008,10(3):135-138.
[5]吴岩,原永芳.薏苡仁的化学成分和药理活性研究进展[J].华西中西医杂志,2010,25(1):111-113.
[6]Kim S O,Yun S J,Lee E H.The water extract of adlay seed(Coix lachrymajobi var.mayuen)exhibits antiobesity effects through neuroendocrine modulation[J].The American Journal of Chinese Medicine,2007,35(2):297-308.
[7]Bai C Q,Peng H L,Xiong H,et al.Carboxymethylchitosancoated proliposomes containing coix seed oil:characterization,stability and in vitro release evaluation[J].Food Chemistry,2011,129:1695-1702.
[8]Zhao L P,Xiong H,Peng H L,et al.PEG-coated lyophilized proliposomes:preparation,characterizations and in vitro release evaluation of vitamin E[J].European journal of Food Research and Technology,2011,232:693-702.
[9]穆筱梅.聚乙烯醇修饰脂质体的制备研究[D].广州:华南理工大学,2004.
[10]黄攀,韩宝芹,刘万顺,等.N-羧甲基壳聚糖的制备及其生物相容性评价[J].功能材料,2009,40(7):1198-1203.
[11]吴刚.羧甲基壳聚糖的应用[J].滁州学院学报,2007,9(6):65-67.
[12]徐云龙,姜厚友,钱秀珍,等.羧甲基壳聚糖修饰阿霉素纳米脂质体的pH敏感性研究[J].中国药科大学学报,2008,39(3):209-213.
[13]颜景泉.壳聚糖、羧甲基壳聚糖包覆VE脂质体的制备及性能评价[D].青岛:中国海洋大学,2009.
[14]白春清.羧甲基壳聚糖包覆薏苡仁油前体脂质体的制备稳定性及体外释放研究[D].南昌:南昌大学,2011.
[15]林筱琦,王建华,温浩,等.阿苯达唑脂质体中磷脂含量测定[J].新疆医科大学学报,2002,25(2):119-120.
[16]吴道澄,席晓莉,胡佳蕙.分光光度法测定阿霉素脂质体中的磷脂含量[J].解放军药学学报,1999,15(3):48-50.
