鹅血红蛋白抗氧化活性肽的制备及工艺研究
2013-09-03布冠好姬莉莉王琳珍张艺帆李开南赵晓丹
布冠好,姬莉莉,王琳珍,张艺帆,李开南,李 梵,赵晓丹
(河南工业大学粮油食品学院,河南郑州450001)
畜禽血液作为食品加工的副产物之一,其资源丰富,且含有大量的蛋白质,营养价值较高。其应用较多的是部分做成血粉或血豆腐等初级产品或作为饲料原料,而大部分畜禽血液被直接排放丢弃,不仅造成了蛋白资源的流失,而且也严重污染了环境。目前,以动物和植物为来源的生物活性肽产物被广泛研究,加工血红蛋白制备生物活性肽不但可以充分利用血液中大量宝贵的蛋白质,而且有助于环境的保护。我国对畜禽血液的研究主要集中在猪血、牛血和鸭血上,对鹅血产品的研究很少。因此,开展鹅血产品深加工的研究具有重要意义。据报道,关于鹅血的研究目前主要集中在医学方面,其中鹅血的抗癌效果显著,鹅血具有增强机体免疫力的功能,对食道癌、上呼吸道癌、肝癌等具有良好的功效[1-2]。虽然近年来有关酶解血红蛋白制备生物活性肽方面的研究取得了许多突破,国内外已有报道利用鸡血红蛋白、猪血红蛋白来制备抗氧化肽[3-6],国内有少量相关鹅血红蛋白水解肽制备工艺的研究[7-8],但关于鹅血红蛋白抗氧化活性肽还未见报道。本文以新鲜鹅血为原料分离血红蛋白,采用蛋白酶水解鹅血红蛋白制备抗氧化活性肽,并利用正交实验确定最佳酶解条件,从而为鹅血在食品及保健品等领域的应用提供依据。
1 材料与方法
1.1 材料与仪器
新鲜鹅血 郑州市广田鹅业,郎德鹅;碱性蛋白酶(酶活9252U/g)、中性蛋白酶(酶活18803U/g)、风味蛋白酶(酶活3839U/g)丹麦诺维信公司;DPPH自由基 Sigma公司;维生素C 郑州锦德化工食品添加剂有限责任公司;TBHQ 进口分装,分析纯;福林试剂、甲醛、柠檬酸三钠、氢氧化钠、无水乙醇等 均为国产分析纯。
GL-20C高速冷冻离心机 上海安亭科学仪器厂;KQ-300VDE型双频数控超声波清洗仪 昆山市超声仪器有限公司;TGJ-18型冷冻干燥机 北京四环科学仪器厂;TU-1901双光束紫外可见分光光度计 北京普析通用仪器有限公司;恒温水浴锅 江苏省金坛市医疗仪器厂;pH211台式酸度测定仪北京哈纳科仪科技有限公司;分析天平 北京赛多利斯天平有限公司。
1.2 实验方法
1.2.1 鹅血红蛋白的制备 新鲜鹅血加入适量食用级抗凝剂,充分搅拌并离心(8000r/min)分离,将下层血细胞用生理盐水洗涤,收集沉淀的血细胞加入适量蒸馏水,用超声波清洗仪处理,破坏细胞壁,离心(4000r/min)后上层为血红蛋白,下层为细胞膜及杂质,取上层血红蛋白溶液进行冷冻干燥,即得血红蛋白粉。经微量凯氏定氮法测定血红蛋白粉中蛋白含量为84.8%。
1.2.2 鹅血红蛋白的酶解 称取一定量的血红蛋白粉,按5%(w/v,蛋白浓度)将其配成水溶液,在水浴锅中加热至所需要的温度,并调节至所需pH。然后加入蛋白酶进行水解。水解在恒温水浴锅中进行,水解过程中不断加入1mol/L NaOH或1mol/L HCl以维持pH在规定的范围内(上下相差不超过0.1)。到设定时间后,将反应体系在100℃保持10min使酶失活,将水解物4000r/min冷冻离心10min,取上清液进行指标检测。工艺路线如下:
血红蛋白→溶解水中配成溶液(底物蛋白浓度为5%)→水浴加热至所需温度→用1mol/L NaOH或1mol/L HCl调pH→加酶水解→加热钝化酶(沸水浴10min)→4000r/min离心10min→取上清液检测
1.2.3 指标测定
1.2.3.1 蛋白含量测定 采用微量凯氏定氮法,参照GB/T 5009.5-2003。
1.2.3.2 酶活测定 采用福林-酚法[9]。
1.2.3.3 水解度测定 甲醛滴定法[10-11]。

1.2.3.4 抗氧化活性测定 检测DPPH自由基清除能力。DPPH自由基是一种相当稳定的自由基,其乙醇溶液在517nm下有强吸收。DPPH自由基清除率测定参照Yen和Hsieh[12]的方法,并略做修改。取鹅血红蛋白水解液(40mg蛋白/mL蒸馏水中)1mL及4mL(1×10-4mol/L)DPPH自由基溶液,在室温下避光静置30min。在517nm波长下测这种反应的吸光值,吸光值越低,体系清除DPPH自由基能力越强。根据下列公式计算水解液对DPPH自由基的清除率:
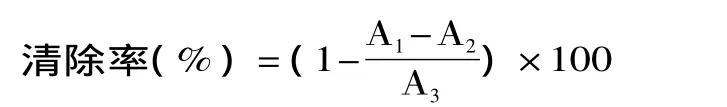
式中:A1为加水解液后DPPH溶液的吸光度;A2为水解液的吸光度;A3为未加水解液时DPPH溶液的吸光度。
1.2.4 不同蛋白酶对产物抗氧化活性的影响 利用碱性蛋白酶、中性蛋白酶、风味蛋白酶分别在各自的最适温度和pH下,酶与底物比为6000U/g,酶解鹅血红蛋白6h后,100℃下水浴10min,灭酶,4000r/min离心10min,取上层清液测定其抗氧化活性。
1.2.5 酶解条件对鹅血红蛋白水解液的影响
1.2.5.1 酶解温度的影响 取鹅血红蛋白底物浓度为5%,酶与底物比为6000U/g,pH为7.5,分别在40、45、50、55、60℃下,水解6h 后灭酶,取酶解液测其水解度和抗氧化活性。
1.2.5.2 酶解时间的影响 取鹅血红蛋白底物浓度为5%,酶与底物比为6000U/g,pH为7.5,温度为50℃,分别水解4、6、8、10、12h 后灭酶,取酶解液测其水解度和抗氧化活性。
1.2.5.3 pH的影响 取鹅血红蛋白底物浓度为5%,温度为50℃,酶与底物比为6000U/g,取pH分别在6.5、7.0、7.5、8.0、8.5,水解 6h 后,取酶解液测其水解度和抗氧化活性。
1.2.5.4 酶与底物比的影响 取鹅血红蛋白底物浓度为5%,pH为7.5,温度为50℃,分别在酶与底物比为 2000、4000、6000、8000、10000U/g 条件下,水解 6h后,取酶解液测其水解度和抗氧化活性。
1.2.6 酶解条件的优化 在单因素实验的基础上,利用L9(34)正交表进行正交实验设计,对合适的酶解条件进行优化,以期获得抗氧化活性较高的鹅血红蛋白酶解产物。正交实验因素水平见表1。

表1 正交实验因素水平表Table 1 Factors and levels of orthogonal test
1.2.7 酶解产物抗氧化性与TBHQ及维生素C(VC)的比较 将鹅血红蛋白水解产物与合成抗氧化剂TBHQ及VC的抗氧化性进行比较,测定它们之间抗氧化活性的差异。
1.2.8 数据统计分析 本研究所有实验数据重复测定三次,结果用平均值±标准差(mean±SD)表示。采用SAS8.2分析软件进行显著性分析。
2 结果与分析
2.1 不同蛋白酶对鹅血红蛋白水解液抗氧化活性的影响
不同类型的蛋白酶水解蛋白的能力和作用位点不同,因此水解度及酶解产物的特性也有较大的差异。对于原料鹅血红蛋白,其没有水解时对DPPH自由基的清除率为25.7%。由图1可知,三种蛋白酶中,中性蛋白酶水解鹅血红蛋白获得的水解液对DPPH自由基的清除作用最强,故选中性蛋白酶作为最佳用酶进行后续研究。
2.2 酶解温度对鹅血红蛋白水解液的影响
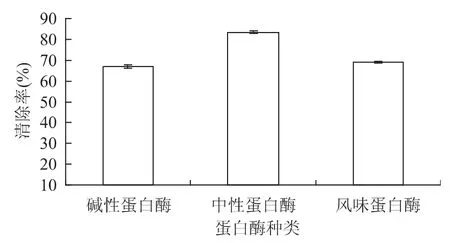
图1 不同蛋白酶对DPPH自由基清除率的作用Fig.1 Effect of different protein enzymes on the DPPH free radical scavenging rate
温度对水解液的影响如图2所示。由图2可知,随着温度升高,鹅血红蛋白的水解度在初始阶段逐渐增大,在50~55℃时水解度趋于平缓,55℃后,水解度明显下降,可能由于较高的温度导致了部分蛋白酶的失活,从而使酶解反应速度下降,水解度降低[13]。因此,中性蛋白酶在 45~55℃ 时水解效果较好。

图2 温度对水解度和DPPH自由基清除率的影响Fig.2 Effect of temperature on degree of hydrolysis and the DPPH free radical scavenging rate
随着温度的升高,鹅血红蛋白水解产物清除DPPH自由基的能力也逐渐增强,50℃时达到最高水平(p<0.05),之后清除DPPH自由基的能力降低。结合温度对水解度的影响,较适宜的酶解温度为45~55℃。
2.3 酶解时间对鹅血红蛋白水解液的影响
酶解时间对水解液的影响见图3。由图3可知,鹅血红蛋白的水解度随着水解时间的延长而增加;从8h开始,水解度呈缓慢增长趋势。这可能是由于蛋白酶的活力随着酶解时间的延长而逐渐降低。

图3 酶解时间对水解度和DPPH自由基清除率的影响Fig.3 Effect of time on degree of hydrolysis and the DPPH free radical scavenging rate
此外,随着酶解时间的延长,水解产物对DPPH自由基的清除作用也显著增强,这可能是随着水解度的增加,产生了更多分子量较小的肽段,而这些肽段所含的氨基酸残基具有较高清除自由基的能力;从10h开始清除率增长缓慢。因此,清除DPPH自由基能力较强的酶解时间是8~12h。
2.4 pH对鹅血红蛋白水解液的影响
pH对水解液的影响见图4。溶液pH的改变会影响蛋白酶的解离状态及酶与底物的亲和力,从而影响酶解反应及酶解产物的性质。由图4可知,当中性蛋白酶在pH7.0和pH7.5的较中性环境下水解鹅血红蛋白时,水解度明显较高(p<0.05),说明水解的酶在最适pH范围内。在偏碱性环境下,水解度明显下降,水解环境的碱性越大水解度越低。
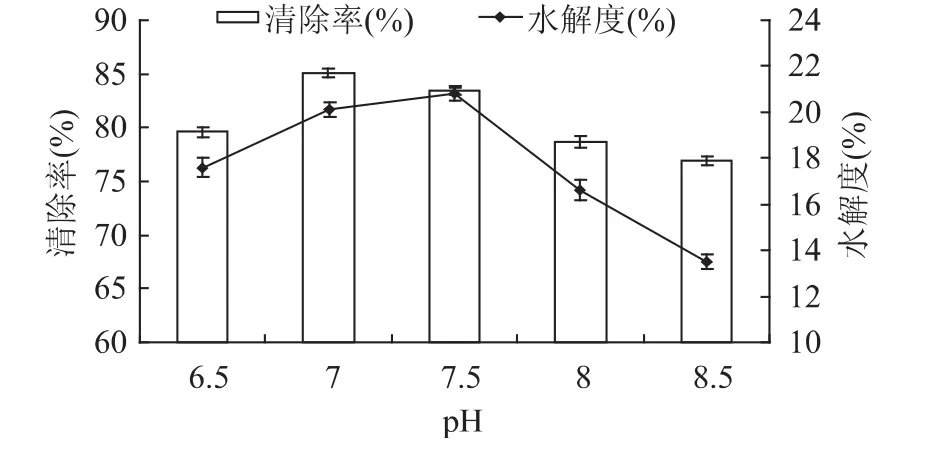
图4 pH对水解度和DPPH自由基清除率的影响Fig.4 Effect of pH on degree of hydrolysis and the DPPH free radical scavenging rate
当中性蛋白酶在 pH7.0、7.5时,酶解液清除DPPH自由基的能力显著提高(p<0.05),这可能与此环境下鹅血红蛋白多肽链中具有抗氧化活性的疏水性基团的释放有关。在偏碱性环境下,清除率明显降低。pH在6.5~7.5之间时酶解物抗氧化效果较好。
2.5 酶与底物比对鹅血红蛋白水解液的影响
酶与底物比对水解液的影响见图5。由图5可知,酶与底物比在2000~8000U/g时,血红蛋白的水解效果随着酶与底物比的增加,水解度也随之升高。在大于8000U/g时,水解度基本不变。这可能是由于酶浓度过高时,溶液中的酶将底物全部饱和后,水解程度增加趋缓[13]。

图5 酶与底物比对水解度和DPPH自由基清除率的影响Fig.5 Effect of enzyme/substrate ratio on degree of hydrolysis and the DPPH free radical scavenging rate
同时,在2000~8000U/g范围内,随着酶与底物比的升高,水解液清除DPPH自由基的作用也随之显著增强(p<0.05)。当大于8000U/g时,水解液清除自由基能力略有降低。牟雪姣等[4]报道,适当增加酶的添加量可以提高鸡血红蛋白的胃蛋白酶水解物的抗氧化活性。因此,酶与底物比在6000~10000U/g时,水解液清除DPPH自由基能力较好。
2.6 中性蛋白酶酶解条件的优化
在单因素实验的基础上,选择温度、时间、pH、酶与底物比四个因素,并选择水解液清除DPPH自由基效果较好的因素水平,进行四因素三水平的正交实验,以确定中性蛋白酶酶解鹅血红蛋白的最佳工艺条件。正交实验结果见表2。
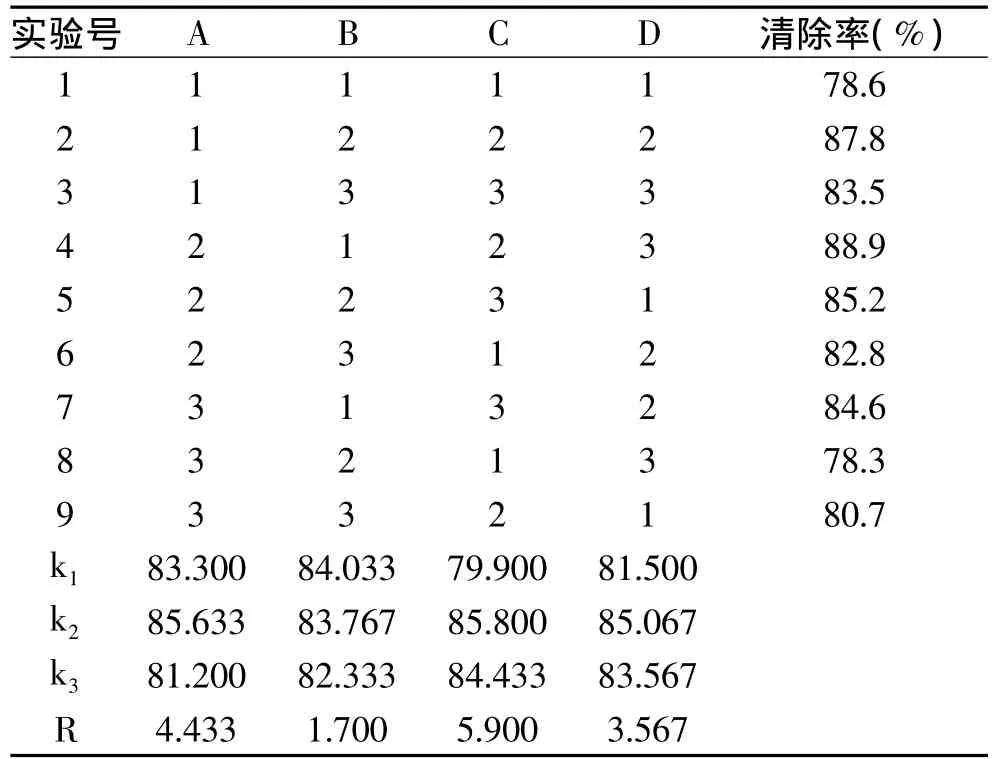
表2 正交实验设计及结果Table 2 Arrangement and results of orthogonal test

表3 不同浓度的水解产物、TBHQ、VC抗氧化能力比较Table 3 Antioxidant capacities of goose hemoglobin hydrolysates,TBHQ and ascorbic acid at different concentrations
由表2可知,极差大小 RC>RA>RD>RB,四个因素对DPPH自由基的清除作用大小依次为pH>温度>酶与底物比>时间。从均值结果来看,最佳工艺参数组合为 A2B1C2D2,即取温度50℃,时间8h,pH7.0,酶与底物比为8000U/g。由于最佳工艺参数组合并未出现在正交表中,因此用最佳组合进行平行实验三次,测得在最佳条件下的DPPH自由基清除率为89.6%。
2.7 水解产物、TBHQ及维生素C的抗氧化性比较
鹅血红蛋白水解液的抗氧化活性与TBHQ及维生素C(VC)进行比较,其结果见表3。
由表3可知,鹅血红蛋白酶解产物清除DPPH自由基能力随着蛋白浓度的增大而增加。TBHQ和VC清除DPPH自由基能力也随着浓度的增大而增强。其中20mg/mL蛋白浓度酶解物的自由基清除率与0.1mg/mL的 TBHQ相当,且高于0.5mg/mL的 VC。提示鹅血红蛋白酶解物可作为氢供体终止自由基链式反应,表明其具有作为天然抗氧化剂的应用潜力。
3 结论
鹅血红蛋白抗氧化肽制备的最佳用酶为中性蛋白酶。由正交实验可知鹅血红蛋白抗氧化肽的酶解因素影响大小顺序为:pH>温度>酶与底物比>时间。中性蛋白酶的最佳酶解工艺参数组合为:温度50℃,时间8h,pH7.0,酶与底物比8000U/g。在最佳条件下,水解物对DPPH自由基清除率为89.6%。
鹅血红蛋白的中性蛋白酶水解液具有较强的抗氧化活性,在一定浓度下清除DPPH自由基的能力大于TBHQ和VC,其有望成为有效的天然抗氧化剂应用于食品工业或作为自由基消除剂用以抑制脂质氧化。此外,对鹅血红蛋白抗氧化肽的氨基酸组成分析将有助于探讨其抗氧化机理。
[1]范守城,张云茹,张昌莲,等.鹅血的抗癌机理及其药物开发[J].中国家禽,2006,28(2):53-54.
[2]余萍,李航森.鹅血对移植肝癌小鼠红细胞免疫功能的影响[J].中国中医药科技,2001,8(6):361.
[3]孙骞,胡鑫,罗永康,等.猪血红蛋白抗氧化肽的酶法制备及其体外抗氧化活力观察[J].中国农业大学学报,2008,13(4):77-81.
[4]牟雪姣,张强,邢静.鸡血红蛋白抗氧化肽的制备工艺研究[J].农产品加工,2009(3):54-56.
[5]Chang C Y,Wu K C,Chiang S H.Antioxidant properties and protein compositions of porcine haemoglobin hydrolysates[J].Food Chemistry,2007,100:1537-1543
[6]Liu Q,Kong B H,Xiong Y L,et al.Antioxidant activity and functional properties of porcine plasma protein hydrolysate as influenced by the degree of hydrolysis[J].Food Chemistry,2010,118:403-410.
[7]赵立冬,邱芳萍,张凤清,等.复酶水解鹅血工艺条件的优化[J].长春工业大学学报:自然科学版,2008,9(1):25-28.
[8]赵朔,于长青,谢宁.酶法水解鹅血蛋白工艺参数研究[J].食品工业科技,2007,28(5):146-148.
[9]中华人民共和国商业部:SB/T 10317-1999.中华人民共和国专业标准-蛋白酶活力测定法[S].北京:中国标准出版社,1987.
[10]赵新淮,冯志彪.蛋白质水解物水解度的测定[J].食品科学,1994(11):65-67.
[11]宁正祥.食品成分分析手册[M].北京:中国轻工业出版社,1998:119-124.
[12]Yen G,Hsieh P.Antioxidant activity and scavenging effects on active oxygen of xylose-lysine Maillard reaction products[J].Journal of the Science of Food and Agriculture,1995,67:415-420.
[13]王璋.食品酶学[M].北京:中国轻工业出版社,1996:72-122.
