酿酒葡萄中内生霉菌的分离与初步鉴定
2013-09-03时永杰祁付云
时永杰,祁付云,安 婷,刘 娅
(石河子大学食品学院特色果蔬研究中心,新疆石河子 832003)
内生菌广泛存在于植物的根、茎、叶、花、果实和种子等组织细胞或细胞间隙,它们在植物体中相互作用,维持微生态平衡。已有研究表明内生菌具有多种生物学功能,能产生生物活性物质,植物内生真菌不仅能产生抗癌的活性物质[1-5],还可以产生黄酮、生物碱、萜类、甾类、醌类、环肽、脂肪酸等化合物,这些化合物具有抗肿瘤、抗菌、抗病毒、杀虫、降糖的功能[6]。新疆处于中国西北边陲,酿酒葡萄品质优良,生物活性成分丰富。目前尚未见对其中内生真菌的研究报道,因此有必要对新疆酿酒葡萄中的内生菌进行分离纯化,从而为了解新疆酿酒葡萄中内生菌的多样性,探明内生菌与宿主植物相同或相似产生物活性物质的能力,为进一步探讨内生菌与宿主植物的关系奠定基础。
1 材料与方法
1.1 材料与仪器
酿酒葡萄 分别于2011年5、8、10月在新疆石河子天珠葡萄酒厂葡萄园,选取3区和4区之间的酿酒葡萄品种“赤霞珠”,取春夏秋三个季节葡萄植株的根、茎、叶及果实的健康组织;葡萄糖、蔗糖、七水合硫酸镁、硝酸钾、硫酸亚铁、磷酸二氢钾、硫酸铵、磷酸氢二钾、氯化钙、氯化铁、碳酸钙、硫酸锌、乙醇、次氯酸钠 均购于天津永晟精细化工有限公司,分析纯;琼脂 北京奥博星生物技术责任有限公司,化学纯;马铃薯葡萄糖琼脂培养基(PDA)[7]马铃薯200g、葡萄糖 20g、琼脂 20g、蒸馏水 1000mL、pH 自然;延胡索酸发酵培养基 葡萄糖100g、七水合硫酸镁10g、磷酸二氢钾15g、硫酸铵3.0g、磷酸氢二钾0.15、氯化钙0.10g、氯化铁痕迹、碳酸钙 30~50g、蒸馏水1000mL、121℃灭菌20min;乳酸发酵培养基 葡萄糖150g、七水合硫酸镁0.25g、硫酸锌0.44g、磷酸二氢钾0.3~0.6g、尿素 0.522g、蒸馏水 1000mL、121℃灭菌20min。
BS224-S万分之一天平 美国 Mettler Toledo公司;BCD-265F冰箱 荣事达集团;LAC-5040S全自动高压灭菌锅 韩国LabTech公司;CX21光学显微镜 Olympus公司;SW-CJ超净工作 苏州安泰空气技术有限公司;SPX生化培养 宁波市江南仪器厂;SP-752型紫外-可见分光光度计 上海光谱仪器有限公司;DK-98-1恒温水浴锅 天津泰斯仪器有限公司。
1.2 实验方法
样品采集→表面消毒→组织块接种培养→内生霉菌分离纯化→形态观察→生理生化测定→初步鉴定

表2 内生霉菌在PDA平板上的菌落特征Table 2 Characterisitics of endogenous mould colony in the PDA plate
1.2.1 样品采集 采集3区和4区之间健康赤霞珠的根、茎、叶及果实组织,剪下后立即用保鲜膜包好,置于无菌袋中,放入冰箱中4℃下保藏。
1.2.2 样品的表面消毒[8-10]样品用自来水冲洗干净、沥干,先用5%乙醇浸泡3min、再用10%次氯酸钠浸泡15~30s进行样品的表面消毒,最后用无菌水冲洗4遍。各样品消毒后分别取最后一次冲洗的无菌水做空白实验,以验证表面消毒效果。
1.2.3 内生霉菌的分离纯化[11]组织块培养 取消毒后的根和茎用无菌刀片将其切成约1.5cm长的块,接种时将暴露出来的内侧组织切面紧贴PDA培养基上;消毒后的葡萄用无菌刀片切开后按上述方法培养;消毒后的叶片置于无菌研钵中研磨,用无菌镊子取叶片碎渣接种于PDA培养基上进行培养。培养基置于28℃霉菌培养箱培养3~5d。观察效果,挑取紧贴组织块边缘生长的菌落进行纯培养。
1.2.4 葡萄内生霉菌的初步鉴定[12]将纯化得到的内生霉菌进行三点培养和载玻片培养,并使用扦片法,通过菌落形态的观察和显微特性的观察,进行初步鉴定。
1.2.5 生理生化指标的测量方法[13]测量碳源氮源对生长速率方法:以完全培养基为基础,将缺少碳源、氮源的培养基分别盛入100mL三角瓶中,每瓶30mL,每组两瓶,标记,121℃灭菌20min。冷却后接入内生霉菌孢子。30℃培养一周,用烘干至恒重的滤纸将培养物过滤,然后将滤得的培养物与滤纸在60℃烘干,再升至100℃,烘干至恒重。以完全培养基的培养物做对照,将完全培养基中滤得培养物连同滤纸的恒重重量,减去滤纸重量作为100%,以求其他培养基的培养物重量百分比,比数越小,说明缺乏的该成分对内生霉菌的生长发育越重要。
2 结果与分析
2.1 内生霉菌的分离纯化
对新疆酿酒葡萄“赤霞珠”春夏秋三个季节的根、茎、叶及果实进行组织块培养,将得到的内生霉菌进行分离纯化,得到的菌株数见表1。
由表1可以看出,从酿酒葡萄中共分离到24株内生霉菌,同一季节赤霞珠不同生长部位存在的内生霉菌数量和同一生长部位在不同季节存在的内生霉菌的数量有很大差异。总体上看,赤霞珠不同季节的内生霉菌的数量占总数量的比:夏季(20.8%)<春季(33.3%)<秋季(45.8%);赤霞珠不同生长部位的内生霉菌数量占总数量的比:果实(12.5%)<茎(20.8%)<根(29.2%)<叶(37.5%)。

表3 内生霉菌菌落显微形态Table 3 Microscopy of endogenous mould colony
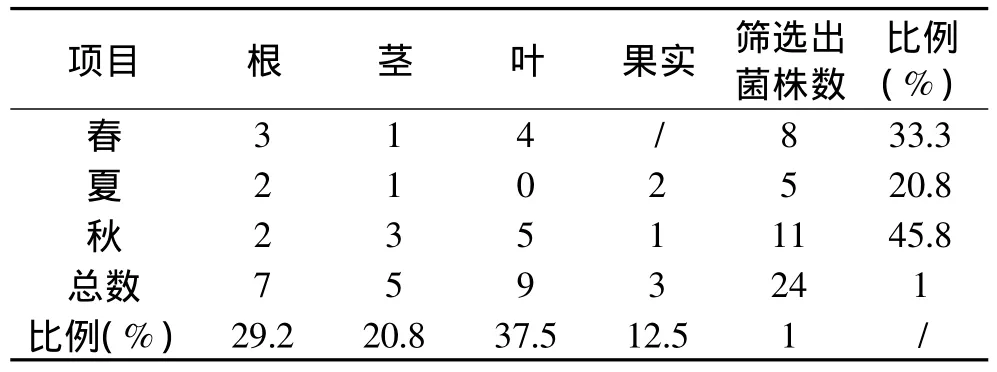
表1 菌种的分布Table 1 The distribution of bacteria
由于在内生菌分离过程中,内生菌的数量和种类常受到材料的品种、来源、分离部位、分离方法、培养基成分、表面消毒程度以及培养条件等诸多因素的影响,选择适宜的方法可以分离到尽可能多的菌株。由分离结果可知,利用组织块法仅从葡萄夏季的叶片中分离得到0株内生霉菌,可能是由于表面消毒处理过度,导致叶片组织内的绝大部分微生物都被杀死之故。
2.2 内生霉菌的初步鉴定
2.2.1 内生霉菌的菌落形态 通过对24株内生霉菌进行三点培养,所得实验结果见表2。
由表2可以看出,分离出的24株赤霞珠内生霉菌的菌落形态存在一定差异。在春、夏、秋三个季节分离出的菌株的菌落形态有一定的相似性,如墨绿色毛毯状菌株和绿色粉粒状菌株;根、茎、叶和果实中均分离出墨绿色地毯状,说明它在赤霞珠中是普遍存在的;根、茎、叶中均分离出黑色沙粒状菌株,根和茎中均分离出深绿色粉粒状菌株。而有些菌株菌落形态与其它的完全不同,如X-P-4的菌丝直立生长,Q-Y-3-5菌落呈喇叭状,这些都是不常见的霉菌性状,这些结果表明一些内生霉菌可能具有一定的组织专化性。
2.2.2 内生霉菌的显微形态及生化实验数据 由于真菌的属种众多,无法对24株内生霉菌逐个鉴定到属,因此挑选两株具有代表性且产多酚能力较强的菌株 C-2-J-6和 C-1-G-3进行显微形态观察,内生霉菌菌落显微形态见表3,内生霉菌生化实验数据见表4。
由表3可以看出C-2-J-6的显微形态为无色的无隔菌丝,孢囊梗直立,没有假根,多次分枝,分枝顶端膨大,上生小梗,圆形孢子同时成熟排列成链状,形似一串“分生孢子”;C-1-G-3的显微形态为无色的有隔菌丝,菌丝垂直生出分生孢子梗,顶端不膨大,无顶囊,经多次分枝,产生几轮对称或不对称小梗,小梗顶端产生分生孢子,总体像“扫帚状”。

表4 生化实验数据表Table 4 The data of biochemical tests
通过对 C-2-J-6和 C-1-G-3 进行产多酚能力测定得出:C-2-J-6 在 28℃、pH 为 5.5、接种量达到6%、培养54h,于765nm下测其吸光度值,可达到0.5578;C-1-G-3在 30℃、pH 为 4.8、接种量达到8%、培养 48h,于 765nm下测其吸光度值达到 0.6197[14]。
通过菌落形态和显微形态,结合《真菌鉴定手册》,确定两株能产多酚的内生霉菌[15-16]分别是:C-2-J-6 属于真菌门(Fungi)藻菌纲(Phycomyeetes)毛霉目(Mucorales)头珠霉科(Piptoeephalidaceae)星珠霉属(Syncephalastrum Schroter);C-1-G-3属于真菌门(Fungi)子囊菌纲(Ascomycetes)真子囊菌亚纲(Euascomycetes)曲霉目(Eurotisles)曲霉科(Eurotiaceae)青霉属(Penicillum)。
3 结论
3.1 通过对健康无病害的赤霞珠的根、茎、叶、果实组织表面消毒后,进行组织块培养,分离纯化得到24株内生霉菌;不同季节、不同生长部位分离出的内生霉菌的数量关系为:夏季(20.8%)<春季(33.3%)<秋季(45.8%),果实(12.5%)<茎(20.8%)<根(29.2%)<叶(37.5%)。
3.2 通过对C-2-J-6和 C-1-G-32株菌进行产多酚能力的测定可以得出C-1-G-32产多酚的能力高于 C-2-J-6。
3.3 通过菌落形态及显微形态对两株具有多酚生产能力的内生霉菌进行初步鉴定:C-2-J-6属于真菌门(Fungi)藻菌纲(Phycomyeetes)毛霉目(Mucorales)头珠霉科 (Piptoeephalidaceae)星珠霉属(Syncephalastrum Schroter);C-1-G-3属于真菌门(Fungi)子囊菌纲(Ascomycetes)真子囊菌亚纲(Euascomycetes)曲霉目(Eurotisles)曲霉科(Eurotiaceae)青霉属(Penicillum)。
[1]姜怡,杨颖,陈华红,等.植物内生菌资源[J].微生物学通报,2005,32(6):146-147.
[2]何劲,刘蕴哲,康冀川.植物内生菌及其在农业和医学上的用途[J].贵州农业科学,2006,4(3):113-115.
[3]何美仙,梅忠.植物内生真菌研究概况及其在农业上的应用前景[J].生物学通报,2005,40(12):10-12.
[4]石晶盈,陈维信,刘爱媛.植物内生菌及其防治植物病害的研究进展[J].生态学报,2006,26(7):2395-2401.
[5]刘蕴哲,何劲,张杰,等.植物内生真菌及其活性代谢产物研究进展[J].菌物研究,2005,3(4):30-36.
[6]任安芝,高玉葆.植物内生真菌一类应用前景广阔的资源微生物[J].微生物学通报,2001,28(6):90-93.
[7]杜连祥.工业微生物学实验技术[M].天津:天津科学技术出版社,1992:93-138.
[8]严铸云,罗静,郭晓恒,等.产银杏内酯内生真菌的筛选及培养条件研究[J].天然产物研究与开发,2007,19(4):554-558.
[9]张志东,谢玉清,楚敏,等.山药内生菌的分离及菌种鉴定研究[J].新疆农业科学,2010,47(1):126-129.
[10]李琦,孙广宇.沙棘内生菌的分离与初步鉴定[J].中国农学通报,2006,22(10):300-302.
[11]沈萍,范秀荣,李光武.微生物学实验[M].北京:高等教育出版社,1999:69-73.
[12]李平兰,贺稚非.食品微生物实验原理与技术[M].北京:中国农业出版社,2005:62-63.
[13]杜连祥.工业微生物学实验技术[M].天津:天津科学技术出版社,1992:93-100,138.
[14]向丽,周铁军,王光西.分光光度法测定青果多酚的含量[J].湖北农业科学,2012,51(6):1242-1244.
[15]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979:79-80,132-134.
[16]孔华忠.中国真菌志,第三十五卷,青霉属及其相关有性型属[M].北京:北京科技出版社,2007:30-40.
