辽宁省甜瓜新病害——果腐病病原菌生物学特性研究
2013-09-03刘志恒曹友文赵廷昌
侯 悦 刘志恒* 曹友文 赵廷昌
(1沈阳农业大学植物保护学院,辽宁沈阳 110161;2中国农业科学院植物保护研究所,北京 100193)
我国甜瓜种植面积占世界甜瓜总种植面积的45%以上,产量占55%以上(马跃,2011),在我国农业发展中具有重要作用,甜瓜在辽宁省种植比较普遍,且具有较高的经济价值。甜瓜上主要病害有霜霉病、枯萎病、白粉病、疫病、炭疽病、细菌性叶斑病、细菌性软腐病、病毒病等(李瑞琴 等,2004;宋伊波,2005;殷丽娟和高运杰,2005;郑顺林 等,2006;李金堂,2010;李省印 等,2011)。甜瓜丝核菌果腐病是近年辽宁省甜瓜生产上的新病害,春茬大棚中甜瓜近收获期发生较普遍。目前国内外对于甜瓜丝核菌果腐病鲜见报道,尤其是系统性研究报道更为少见。意大利曾有过丝核菌引起甜瓜果腐的报道(Corazza et al.,1992)。我国内蒙古(吕佩珂,1996)和山东(李金堂,2010)曾报道有该病的发生。但在辽宁至今尚未见由Rhizoctonia solani引起甜瓜果腐病及其病原菌生物学特性的研究报道。为明确甜瓜果腐病病原菌的生物学特性,探讨病菌越冬侵染特点,本试验调查、采集、分离了甜瓜果腐病的病原菌,对病原菌生物学特性进行了较为系统的研究,以期为该病害发生规律的深入研究及病害防控提供理论依据。
1 材料与方法
1.1 供试材料
甜瓜病果标样于2011年7月采于辽宁省沈阳市法库县。
1.2 病害症状描述
根据甜瓜病果的症状特点进行描述记载。
1.3 病原菌鉴定
按常规方法对甜瓜果腐病标样进行分离、培养、鉴定(陆家云,2002),描述记载病原菌形态。同时进行菌丝融合群测定(陈延熙 等,1985;Sneh et al.,1991)及病菌rDNA-ITS序列测定(Saghai et al.,1984;Guo et al.,2000)。
1.4 病原菌生物学特性测定
1.4.1 不同培养基对菌丝生长及菌核萌发的影响 选用2%水琼脂、PDA、PSA、查氏、理查、孟加拉红、燕麦片、黄瓜煎汁、甜瓜煎汁和胡萝卜煎汁等10种培养基。移接直径5 mm的菌饼,25 ℃恒温培养。3次重复。采用十字交叉法每间隔24 h测量1次菌落直径,计算各培养基上菌丝生长速度,2 d后绘制菌丝生长速度柱形图,进行方差分析和多重比较(方中达,1998)。22 d后比较不同培养基上菌核干质量。菌核萌发率测定:采用上述10种培养基,每皿分别植入菌核40粒,25 ℃恒温培养。3次重复。22 h后观察菌核萌发情况,计算比较菌核萌发率。
1.4.2 不同温度对菌丝生长及菌核萌发的影响 选用PDA培养基,分别设置0、5、10、15、20、25、28、30、35、40 ℃共10个温度梯度,菌饼应用、其他培养条件、重复次数、菌丝、菌核干质量及萌发率测定分析比较方法均同1.4.1。
1.4.3 不同pH值对菌丝生长及菌核萌发的影响 选用PDA培养基,用0.1 mol·mL-1HCL和0.1 mol·mL-1NaOH调整PDA培养基pH值,pH值分别为2、3、4、5、6、7、8、9、10、11共10个梯度。菌饼应用、其他培养条件、重复次数、菌丝、菌核干质量及萌发率测定分析比较方法同1.4.1。
1.4.4 不同光照对菌丝生长及菌核萌发的影响 选用PDA培养基,设光照24 h、黑暗24 h、光照/黑暗交替12 h/12 h共3个处理。菌饼应用、其他培养条件、重复次数、菌丝、菌核干质量及萌发率测定分析比较方法同1.4.1。
1.4.5 不同碳源对菌丝生长及菌核萌发的影响 以PA为基础培养基,选用葡萄糖、果糖、半乳糖、蔗糖、麦芽糖、乳糖、木糖、淀粉和山梨醇等9种碳源,用量2%(刘志恒 等,2010)。菌饼应用、其他培养条件、菌丝、菌核干质量及萌发率测定分析比较方法同1.4.1。
1.4.6 不同氮源对菌丝生长及菌核萌发的影响 以不加NaNO3的查氏培养基为基础培养基,选取NaNO3、KNO3、(NH4)2SO4、蛋白胨、酵母浸粉、脲、甘氨酸、L-谷氨酸、L-精氨酸和L-半胱氨酸等10种氮源,用量0.2%(毕淑娟 等,2012)。菌饼应用、其他培养条件、重复次数、菌丝、菌核干质量及萌发率测定分析比较方法同1.4.1。
1.4.7 菌丝致死温度 用无菌水配制菌丝悬浮液,移2 mL于灭菌试管中,分别置于46、47、48、49、50、51、52、53、54、55 ℃恒温水浴锅中处理10 min(预热1 min),水浴后立即放入冷水中降至室温,将试管内菌丝转入PDA 平板中置于25 ℃恒温培养。3 次重复。3 d后根据菌丝是否萌发确定其致死温度(吴海燕 等,2001)。
1.4.8 菌核致死温度 将纯培养的菌核置于含有2 mL无菌水的试管中,分别置于50、51、53、54、55、56、57、58、59、60℃恒温水浴锅中处理10 min(预热1min),水浴后立即放入冷水中降至室温,将菌核转入PDA 平板中,每皿3粒,25 ℃恒温培养。3 次重复。3 d后根据菌核是否萌发生成菌丝确定菌核致死温度(吴海燕 等,2001)。
2 结果与分析
2.1 病害症状描述
甜瓜果腐病主要为害近成熟果实(图1)。初期发病部位产生褐色坏死斑点,病斑扩展迅速,很快呈深褐色大型腐烂病斑,继而侵染部位密生白色絮状霉层,霉层扩展迅速,有时边缘呈厚密的白膜状。受害部位自中心向外围呈水渍状湿腐。湿度大时,白色霉层覆满整个病部。发病后期果实大部分或全部腐烂。

图1 田间发病症状
2.2 病原菌形态观察及鉴定结果
甜瓜果腐病病原菌在PDA培养基上培养,菌丝初为无色,成熟后呈淡褐色。菌丝多为近直角分支,分支基部多较缢缩,分支附近具隔膜。远基菌丝直径0.9~6.5μm,近基菌丝直径4.4~12.3 μm。菌丝成熟后相互纠集,形成灰色、褐色至深褐色菌核。菌核球形、椭球形或成片生长;内外层颜色较一致,结构疏松;表面粗糙具微孔,湿度大时有液体从微孔中渗出(图2、3)。
菌丝融合群测定结果表明,甜瓜果腐病菌属于AG-4 HGI融合群。电泳检测结果得到大小约667 bp的片段,将该rDNA-ITS序列与GenBank中相关菌株的ITS序列进行同源性比较,结果表明,待测菌株与RhizoctoniasolaniAG-4 HGI(GenBank收录号:JN254788.1)的同源性达到99%(表1),证实所测病菌为无性态真菌茄丝核菌Rhizoctonia solani。
2.3 病原菌生物学特性测定结果
2.3.1 不同培养基对菌丝生长及菌核萌发的影响 图4表明,病菌在甜瓜煎汁培养基上生长最快,其次为PSA培养基,在理查培养基上生长最慢。在不同培养基上菌核萌发率差异明显,在胡萝卜煎汁培养基上菌核萌发率最高,达95%,而在2%水琼脂培养基上菌核萌发率最低。测定菌核干质量,理查培养基上产生的菌核干质量最大(424.50 mg),但成熟度差,其次为查氏培养基(257.07 mg),水琼脂产生的菌核量最少(4.40 mg)。

图2 菌丝
图3 菌核

表1 待测菌株核糖体脱氧核糖核酸转录间隔区序列与基因库中相关菌株转录间隔区序列同源性比较
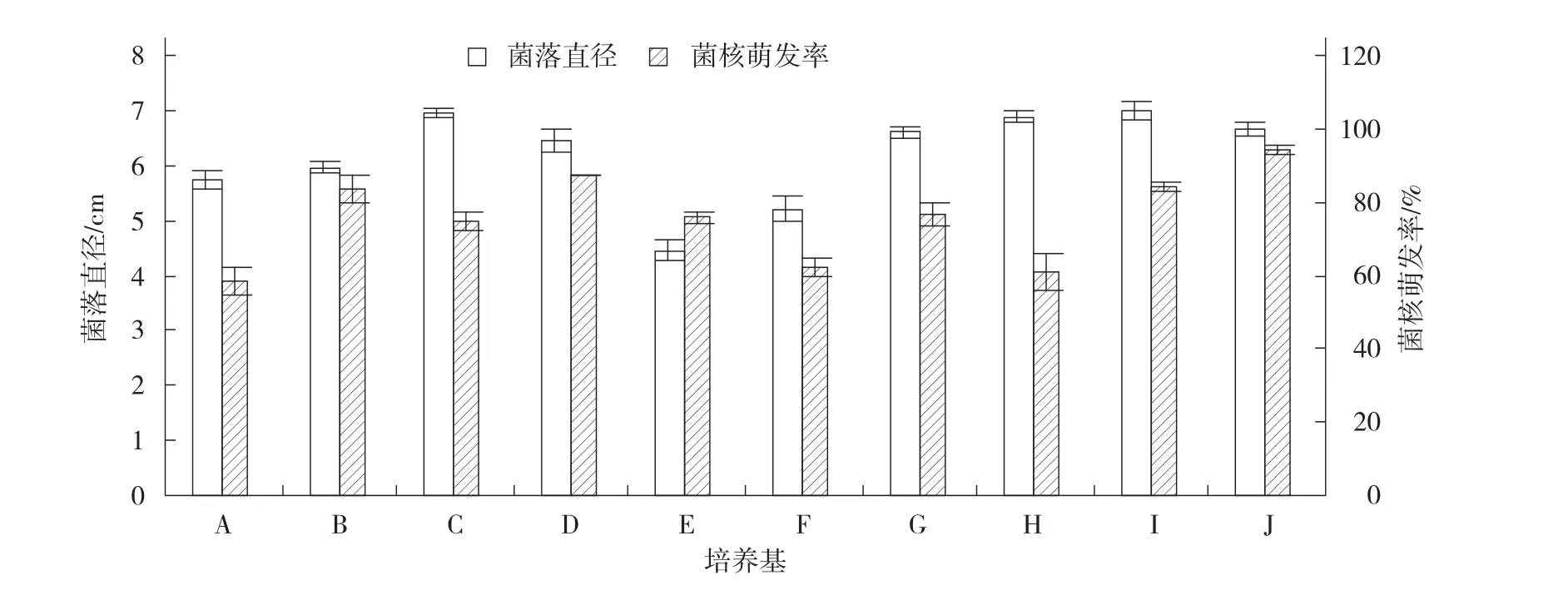
图4 不同培养基对菌丝生长及菌核萌发的影响
2.3.2 不同温度对菌丝生长及菌核萌发的影响 图5表明,菌丝在5~40 ℃均可生长,25~30℃为适宜温度,菌丝生长致密,28 ℃为最适。菌核萌发率测定结果表明,不同温度下菌核萌发率差异显著,22 h后在15~40 ℃范围内菌核均可萌发,但温度≤15 ℃或≥40 ℃菌核未见萌发。28 ℃为最适温度,萌发率100%。此外,测定菌核干质量,25 ℃下菌核产生量最大(94.25 mg),5、10、40 ℃下无菌核产生。
2.3.3 不同pH值对菌丝生长及菌核萌发的影响 病菌对PDA培养基酸碱要求不严格,pH 2~11范围内均可生长。pH 6~8时菌落扩展最快,生长致密,pH 7为最适pH。在pH 3~11间菌核均可萌发,pH 7时萌发率最高,达85%以上(图6)。测定菌核干质量,pH 7条件下最易产生菌核(110.51 mg)。
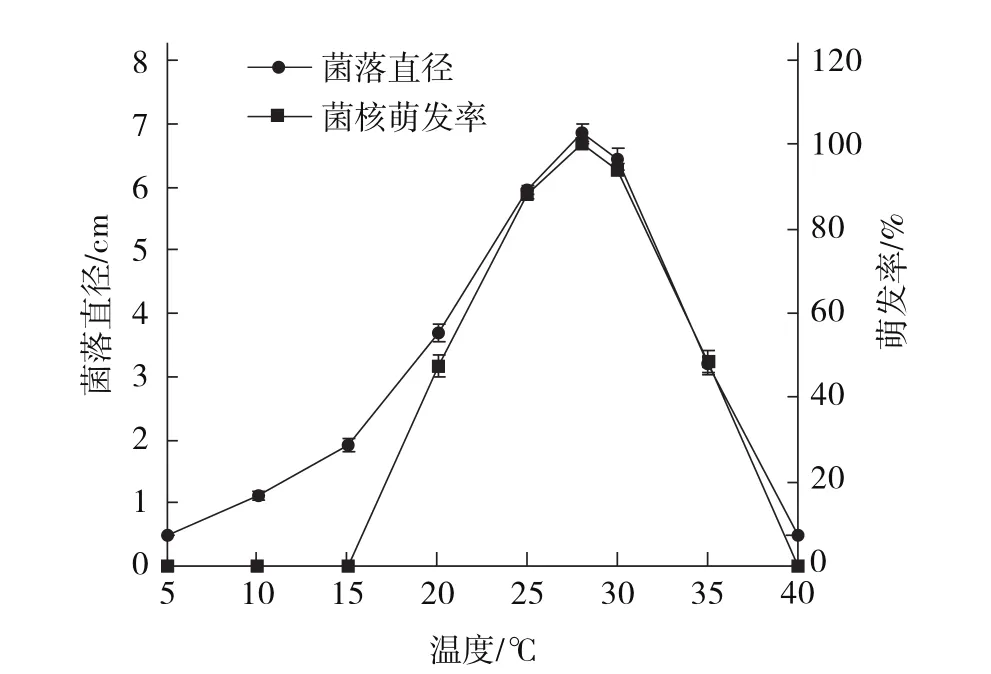
图5 不同温度对菌丝生长及菌核萌发的影响
2.3.4 不同光照条件对菌丝生长及菌核萌发的影响 试验结果表明,不同光照条件对菌丝生长的影响不明显,黑暗条件略优于光暗交替和光照条件。从菌核萌发看,黑暗条件略优,而光暗交替条件较差,萌发率仅为75%(图7)。此外,从菌核产生看,黑暗条件利于菌核产生(92.38 mg)。

图6 不同pH值对菌丝生长和菌核萌发的影响

图7 不同光照条件对菌丝生长及菌核萌发的影响
2.3.5 不同碳源对菌丝生长及菌核萌发的影响 以PA为基础培养基,病菌在供试9种碳源的培养基上生长差异显著(图8),在以可溶性淀粉为碳源的培养基上生长最快,在以木糖为碳源的培养基上生长最慢。菌核萌发对9种碳源的利用差异显著,麦芽糖促进作用明显,菌核萌发率达85%以上。测定菌核干质量,以山梨醇为碳源的培养基利于菌核产生,干质量最大(79.67 mg),而以木糖为碳源的培养基不利于菌核产生,菌核量最少(26.00 mg)。
2.3.6 不同氮源对菌丝生长及菌核萌发的影响 以不加NaNO3的查氏培养基为基础培养基,菌丝生长对不同氮源的利用差异显著,以蛋白胨为最适,生长速度明显优于其他培养基。不同氮源对菌核萌发的影响差异明显,以蛋白胨为氮源时有利于菌核萌发,萌发率达90%(图9)。此外,以KNO3为氮源有利于菌核产生,菌核干质量最大(180.10 mg),以L-半胱氨酸为氮源时产生的菌核量最少(7.43 mg)。

图8 不同碳源对菌丝生长及菌核萌发的影响

图9 不同氮源对菌丝生长及菌核萌发的影响
2.3.7 菌丝致死温度 经温度≥50 ℃处理10 min,菌丝均未生长,确定菌丝致死温度为50 ℃、10 min。
2.3.8 菌核致死温度 经温度≥53 ℃处理10 min,菌核均不萌发,确定菌核致死温度为53 ℃、10 min。
3 结论与讨论
本试验结果表明,茄丝核菌在供试10种培养基上均可生长,但在理查培养基上生长较缓慢;28 ℃为病菌菌丝最适生长温度,温度≤5 ℃或温度≥40 ℃菌丝停止生长,结果与肖功年等(1999)和陈京元等(2006)的相关报道相似,但与旷玲等(2008)和张勇等(2010)的研究结论略有差异。由此认为虽然同为茄丝核菌(Rhizoctonia solani),但是由于其寄主及生长环境不同或是菌群分化等原因,使得病原菌某些生物学特性也具有一定的差异性,尚待深入研究。
本试验结果表明,pH 6~8范围既适合菌丝生长也适合菌核的萌发。不同光照条件下菌丝生长无明显差异,说明光照对病菌菌丝生长的影响不大。在供试9种碳源和10种氮源中,分别以可溶性淀粉和蛋白胨作为碳、氮源对菌丝生长最有利。对于菌核的形成,最适碳源为山梨醇,最适氮源为KNO3。以麦芽糖为碳源的PA培养基和以蛋白胨为氮源的查氏培养基有利于菌核萌发。说明菌丝生长、菌核形成及菌核萌发对营养成分的需求存在一定差异。菌核萌发的最适pH值和最适温度均与菌丝生长的相同,但菌核萌发与菌丝生长的温度范围存在一定差异,菌核在15~40 ℃范围22 h后可以萌发,而15 ℃下需要培养3 d后才能萌发,温度≤10 ℃或温度≥40℃继续培养仍不能萌发;菌丝在5~40 ℃均可生长,说明菌核萌发对温度的要求比菌丝生长对温度的要求严格,这些特性和病害田间的发生时期相吻合,因此甜瓜茄丝核菌果腐病在初春病害初侵染时即应进行防治。
病菌菌丝致死温度为50 ℃、10 min,与杨子祥等(2009)报道的香石竹立枯病菌的菌丝致死温度相同,而人工培养的菌核致死温度为53 ℃、10 min,高于菌丝,说明菌核的抗逆性相对较强,与刘志恒等(2010)报道的老熟菌核可在土壤中越冬存活几年而仍具有萌发和致病能力的结论较为一致。本试验结果对于生产上有针对性地拟定病害防治措施,具有一定参考意义。
毕淑娟,刘玉霞,王飞,刘红彦,董诚明.2012.2种忍冬致病镰刀菌的生物学特性研究.河南农业科学, 41(6):115-118.
陈京元,霍宪起,蔡三山,徐红梅,涂俊杰,侯明生,嵇保中.2006.湿地松猝倒病病原鉴定及其生物学特性的观察.华中农业大学学报,25(2):128-131.
陈延熙,张敦华,段霞渝,鲁素芸.1985.关于Rhizoctonia solani菌丝融合分类和有性世代的研究.植物病理学报,15(3):139-143.
方中达.1998.植病研究方法.北京:中国农业出版社.
旷玲,周如军,傅俊范.2008.短梗五加根腐病菌生物学特性研究.沈阳农业大学学报,39(1):20-32.
李金堂.2010.西瓜甜瓜病虫害防治图谱.济南:山东科学技术出版社.
李瑞琴,王婧,任惠玲.2004.甜瓜枯萎病的发病规律与防治技术研究.甘肃农业科技,(12):41.
李省印,麦晓丽,张会梅,张勇,杜军志,张显.2011.甜瓜几种主要病害的杀菌剂防治效果比较研究.北方园艺,(12):127-129.
刘志恒,马家瑞,杨红,韩翔宇,吕彬,王悦.2010.番茄茎基腐病病原菌的生物学特性.植物保护,36(2):94-97.
陆家云.2002.植物病原真菌学.北京:中国农业出版社:60-363.
吕佩珂.1996.中国蔬菜病虫原色图谱续集.呼和浩特:远方出版社.
马跃.2011.透过国际分析,看中国西瓜甜瓜的现状与未来.中国瓜菜,24 (2):64-67.
宋伊波.2005.甜瓜细菌性叶斑病发病环境条件的观察与防治研究.中国瓜菜,(6):14-16.
吴海燕,辛惠普,靳学慧.2001.水稻小球菌核病病原菌生物学特性的研究.黑龙江八一农垦大学学报,13(4):122-125.
肖功年,庞宗文,李湘萍,杨胜远,梁智群.1999.芒果果腐病原菌(Rhizoctonia solaniKühn)的鉴定及生物学特性研究.广西大学学报:自然科学版,24(4):268-270.
杨子祥,范静华,孔宝华,陈海如,杨泮川.2009.香石竹立枯病菌生物学特性与药剂筛选.云南农业大学学报,24(6):818-824.
殷丽娟,高运杰.2005.甜瓜白粉病的发生与综合防治技术.北方园艺,(4):64-66.
张勇,李晓军,曲健禄,范昆,杨建民.2010.我国桃树新病害——叶枯病的病原菌鉴定及生物学特性研究.园艺学报,37(1):1745-1750.
郑顺林,李首成,刘西瑜.2006.新疆晚熟甜瓜病毒病防治思路与对策.中国瓜菜,(2) :32-33.
Corazza L,Luongo L,Chilosi G.1992.Characterization of a strain ofRhizoctonia solaniKuehn from melon in Italy.Phytopathologia Mediterranea,31(2):121-122.
Guo L D,Hyde K D,Liew E C Y.2000.Identification of endophytic fungi fromLivistona chinensisbased on morphology and rDNA sequences.New Phytologist,147:617-630.
Saghai M A,Solman K M,Jorgensen R A,Allard R W.1984.Ribosomal DNA spacer-length polymorphisms in barley:mendelian inheritance,chromosomal location and population dynamics.Pnas,81(24): 8014-8018.
Sneh B,Burpee L,Ogoshi A.1991.Identification ofRhizoctoniaspecies.Minnesota:American Phytopathological Society Press:1-133.
