重组禽流感病毒灭活疫苗(H9N2亚型,Re-9株)对2010年~2011年流行病毒株免疫效力的研究
2013-08-30曾显营张盼涛冯华朋李倩倩邓国华李雁冰田国彬陈化兰
杨 婧,曾显营,张盼涛,冯华朋,李倩倩,邓国华,李雁冰,田国彬,陈化兰
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/农业部动物流感重点开放实验室/国家禽流感参考实验室,黑龙江哈尔滨 150001)
H9亚型禽流感病毒(Avian influeuza virus,AIV)为低致病性病毒,呈世界性分布,一般可分为北美和欧亚两个种系[1]。我国H9亚型AIV属于欧亚种系,于1970年首次在香港发现,1990年左右开始在中国大肆流行[2]。H9亚型AIV除可以造成禽呼吸道疾病外,同时可能造成蛋鸡产蛋量下降及肉鸡生长缓慢;并常与其它病毒病或细菌病混合感染,可造成较高的死亡率[3]。近年来,有研究表明一些H9亚型AIV对人源唾液酸受体的亲和力逐渐增强,并有报道人类感染的临床病例,对公共卫生安全构成威胁[4-6]。因此,对H9亚型禽流感(AI)的研究和防控具有重要的经济和公共卫生意义。
疫苗免疫是我国控制H9亚型AI的重要措施之一,我国有不同单位研制或生产的多株H9N2亚型AIV灭活疫苗,并在我国广泛应用。而在活禽市场中依然能够监测到大量的H9N2亚型AIV。为获得更好的免疫保护效果,本实验室在分析大量H9N2亚型AIV后,利用成熟的反向遗传操作技术,研制出Re-9株病毒,已有试验结果表明该疫苗能对2008年的流行病毒株的攻击提供良好的免疫保护作用[7]。由于AIV易发生基因重组,因此选择我国近两年流行的5株分离株重新评估Re-9株的免疫保护作用。
1 材料和方法
1.1 病毒株 H9N2亚型重组AIV Re-9株由本实验室构建,其亲本株为A/Chicken/Hunan/S933/2008(简称HuN33);5株攻毒株分别为:A/Chicken/Chongqing/S1258/2011(简 称 CQ58)、 A/Chicken/Liaoning/S3037/2010(简称 LN37)、A/Chicken/Guangxi/S1435/2010(简称 GX35)、A/Chicken/Fujian/S1239/2010(简称 FJ39)、A/Duck/Hubei/S1146/2011(简称HuB46),均由本实验室分离、鉴定和保存。
1.2 SPF鸡胚和SPF鸡 9日龄~11日龄SPF鸡胚和4周龄的SPF鸡均由本所实验动物中心提供;动物饲养和感染实验均在负压隔离器中进行。
1.3 疫苗的制备 按照现有H9N2亚型AIV灭活疫苗规程,以Re-9株为毒种制备灭活疫苗。
1.4 HA基因和NA基因的同源性分析 对疫苗株Re-9与亲本株HuN33和2010年~2011年分离的5个代表株CQ58、LN37、GX35、FJ39、HuB46进行HA基因和NA基因的测序,用Megalign进行同源率分析。
1.5 病毒株的鸡胚半数感染量(EID50)测定 将CQ58、LN37、GX35、FJ39、HuB46 5 个分离株分别用无菌PBS作10倍倍比稀释,取10-5~10-106个稀释度,每个稀释度以尿囊腔途径接种10日龄SPF鸡胚5枚,37℃孵育72 h后,测定鸡胚尿囊液的HA价,利用Reed-Muench法计算病毒的EID50。
1.6 病毒株的抗原性分析 分别将Re-9株和CQ58、LN37、GX35、FJ39、HuB46制备成灭活苗,分别免疫3只4周龄的SPF鸡,制备抗血清,进行抗原性分析。按照文献[8]方法计算各病毒株之间的抗原相关值(R),R=r1·r2×100%。R为抗原相关值,r1为血清1对病毒2的HI滴度与血清1对病毒1的HI滴度之比;r2为血清2对病毒1的HI滴度与血清2对病毒2的HI滴度之比。
1.7 灭活疫苗免疫效力试验 将Re-9株灭活疫苗以0.3 ML/只的剂量免疫60只4周龄的SPF鸡,取30只同日龄SPF鸡作为对照。每周采血检测HI抗体水平,免疫3周后,对免疫组鸡与同条件饲养的对照鸡,分别将亲本HuN33病毒株和2010年~2011年所筛选的5个分离株H9N2亚型AIV以静脉途经接种,0.1m L/只(含2×107EID50)。攻毒后第3 d、5 d、7 d采集喉头和泄殖腔拭子进行病毒分离,检测排毒情况,病毒分离阴性样品则盲传1代。对免疫攻毒鸡进行排毒检测,喉头或泄殖腔拭子病毒分离阳性均计为该只鸡排毒。
2 结果
2.1 HA和NA基因的同源率比较 Re-9和HuN/33的HA和NA的核苷酸及氨基酸的同源性均为100%。5个分离株HA核苷酸之间的同源率为90.2%~96.4%,HA氨基酸之间的同源率为93.4%~97.4%;NA核苷酸之间的同源率为87.1%~96.5%,NA氨基酸之间的同源率为88.5%~96.0%。5个分离株与Re-9的HA核苷酸之间的同源率为90.6%~97.5%,HA氨基酸之间的同源率为92.9%~98.0%;NA核苷酸同源率为88.1%~98.7%,NA氨基酸之间的同源率为89.1%~98.3%。
其中FJ39的NA基因推导氨基酸序列的同源性与其余6株病毒株相差较大,HuB46的HA和NA基因及其氨基酸与其余6株病毒株同源性最相近。
2.2 病毒株EID50测定 病毒株通过SPF鸡胚滴定结果显示,每 0.1 ML的 HuN33、CQ58、LN37、GX35、FJ39和HuB46的病毒含量依次分别为108.6EID50、108.5EID50、109.3EID50、108.6EID50、108.8EID50和109.2EID50。
2.3 病毒株抗原性分析 对经分别免疫2010年~2011年分离的5个代表株和Re-9株灭活疫苗而制备的抗血清进行交互血凝抑制试验(表1)。
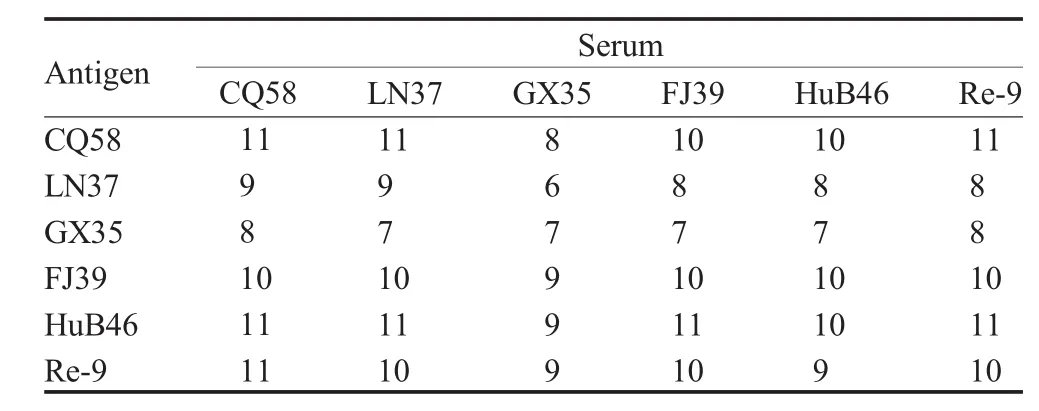
表1 AIV抗原性分析Table 1 Antigenicity analysis of AIV isolates
Re-9的抗原对5个分离株血清的交互HI值较高,并且各分离株对疫苗株血清的交互HI值的差异在2 log2以内。用我国分离的H9N2亚型AIV早期 分 离 株 CK/GD/6/97(GD6), DK/NJ/2/97(NJ2),CK/BJ/8/98(BJ8)和 CK/HB/31/00(HB31)血清对该 5个分离株抗原的HI抗体效价相差8 log2左右,存在较大差异;5个分离株之间的差异在4 log2左右。按照文献[8]介绍的方法计算各病毒株之间的抗原相关值 R,R=r1·r2×100%(表 2)。
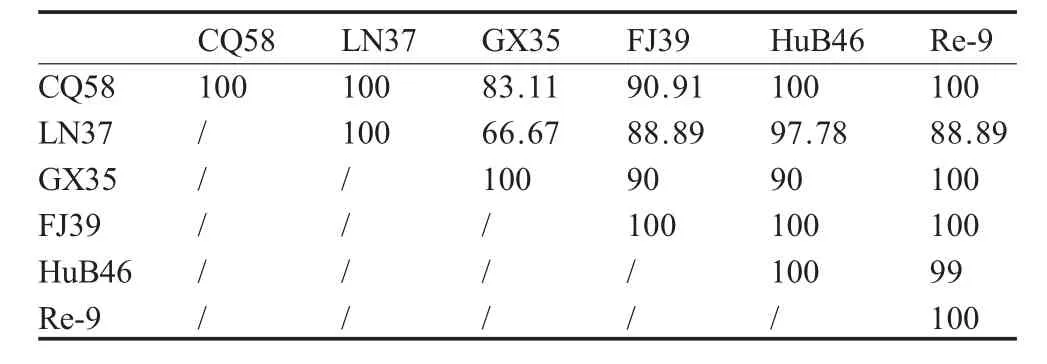
表2 5个分离株与疫苗株之间抗原相关值(R)测定结果Table 2 Antigen correlation value(R)of the H9N2 subtype AIVs
结果显示5个分离株之间的抗原相关值为66.67%~100%,而Re-9株与该5个分离株之间的抗原相关值为88.89%~100%(表2)。
2.4 灭活疫苗免疫效力试验 对相同条件下的免疫组和对照组鸡只以2×107EID50静脉途经攻毒后,采集攻毒后3 d、5 d、7 d的喉头和泄殖腔拭子,接种鸡胚以检测排毒情况,具体数据见表3。即对照组3 d时排毒的比例分别为:100%(5/5)、100%(5/5)、100%(5/5)、100%(5/5)、100%(5/5)、100%(5/5),5 d时排毒的比例分别为:100%(5/5)、100%(5/5)、100%(5/5)、80%(4/5)、80%(4/5)、80%(4/5),而且攻毒后7 d依然有不同程度排毒。而免疫组在攻毒后3 d、5 d和7 d,拭子样品病毒分离均为阴性,而且所有鸡只在攻毒后14 d观察期内均无任何不良反应,表明Re-9株灭活疫苗能够对2010年~2011年监测到的病毒株攻击提供良好的免疫作用。

表3 攻毒后拭子的病毒检测结果Table 3 The virus shedding detection from trachea and cloaca swab samples post challenge
3 讨论
由于H9N2亚型AIV为低致病力病毒,因此较少引起关注,而近几年该病毒的分离率与以前相比明显上升[9]。从HA遗传进化树上分析可知近几年流行的H9N2亚型AIV仍为类A/CK/Beijing/1/94病毒株,但分析其序列表明当前流行的病毒株与2009年以前病毒株相比已经发生了变异,而且病毒不是限制在某些区域内,而是在大范围内或全国流行。这与王寿山等[10]报道的相一致。由于H9N2亚型AIV具有上述特点,有研究者认为有必要进行新的AI疫苗株的筛选[11]。许传田等所筛选的疫苗株CK/SD/SG2/2009在攻毒后第3d有效保护率70%以上,第5 d保护率达到90%[12]。万晓鹏等对2008年~2010年在我国不同地区监测到的55个分离株AIV系统筛选,实验结果表明CK/HuN/33/08是理想的疫苗候选株[7]。
疫苗株的基因同源性和抗原性差异是影响疫苗免疫效果的关键因素[13]。Re-9株与流行代表病毒株之间HA氨基酸的同源率为90.6%~97.5%,NA氨基酸同源率为88.1%~98.7%,并且其抗原相关值在88.89%~100%,Re-9的基因同源性和抗原性相关值均较高,在理论上具有典型疫苗株的特点。
HuN33具有良好的免疫原性,能够对不同地区和来源的流行病毒株的攻击提供理想免疫保护,本实验利用反向遗传操作技术以HuN33的表面基因HA和NA基因及H1N1/PR8病毒的6个内部基因为供体重组构建疫苗毒Re-9株,并进行了系统评估。重组病毒对家禽和哺乳动物均呈低致病性,显著降低了在疫苗研制和大生产过程中感染和传播的风险[14]。以Re-9株制备的灭活疫苗在攻击亲本株和2010年~2011年5个分离株后的保护率均为100%,表明Re-9株灭活疫苗不仅可以抵御同源病毒的攻击,而且对5个异源病毒株的攻击也具有较好的保护作用。因此,Re-9株是可用于当前H9亚型AI预防的理想疫苗株。
[1]Alice F,Isabella M,Annalisa S,et al.Phylogeography and evolutionary history of reassortant H9N2 viruses with potential human health implications[J].Virology,2011,85:8413-8421.
[2]Li Cheng-jun,Yu Kang-zhen,Tian Guo-bin,et al.Evolution of H9N2 influenza viruses from domestic poultry in Mainland China[J].Virology,2005,340:70-83.
[3]Kishidal N,Sakoda Y,Eto M,et al.Co-infection ofStaphylococcus aureusorHaemophilus paragallinarumexacerbates H9N2 influenza virus infection in chickens[J].Arch Virol,2004,149:2095-2104.
[4]Matrosovich MN,Krauss S,Webster R G.H9N2 influenza viruses from poultry in Asia have human virus-like receptor specificity[J].Virology,2001,281:156-162.
[5]Butt K M,Smith G J,Chen Hua-lan,et al.Human infection with an avian H9N2 influenza A virus in Hong Kong in 2003[J].JClin Microbiol,2005,43:5760-5767.
[6]Ji Kang,Jiang Wen-m ing,Liu Shuo,et al.Characterization of the hemagglutinin gene of subtype H9 avian influenza viruses isolated in 2007-2009 in China[J].J Virol Meth,2010,163:186-189.
[7]万晓朋,曾显营,田国彬,等.H9N2亚型禽流感流行株灭活疫苗种毒的筛选[J].中国预防兽医学报,2010,32(4):276-280.
[8]杨汉春.动物免疫学[M].北京:中国农业大学出版社,1995:146-147.
[9]赵坤坤,仲书官,赵国,等.2009-2010年华东地区家禽低致病性AIV的流行病学调查与分析[J].中国兽医学报,2012,32(3):345-349.
[10]王寿山,张超林,刘春国,等.H9N2亚型AIVHA和NA基因的序列分析[J].黑龙江畜牧兽医,2012,7:113-115.
[11]Suarez D L,Schultz S.Immunology of avian influenza viruses:a review[J].Dev Comp Immunol,2000,24:269-283.
[12]许传田,鲁梅,胡北侠,等.H9N2亚型禽流感疫苗株的筛选及其免疫效果评价[J].中国兽医学报,2012,32(7):997-1000.
[13]卞学兵,曾嘉梅,周继勇,等.免疫鸡群中分离的H9N2亚型禽流感病毒的分子特征研究[J].中国预防兽医学报,2012,34(1):15-18.
[14]封柯宇,李洪涛,金龙女,等.重组禽流感病毒H5亚型二价灭活疫苗田间免疫效果观察[J].中国家禽,2011,33(14):49-50.
