异福片制粒工艺改进
2013-08-29兰昌云重庆华邦制药股份有限公司重庆401121
陈 博,张 莉,周 维,兰昌云,徐 飞(重庆华邦制药股份有限公司,重庆 401121)
异福片收载于2010年版《中国药典》(二部)[1],是治疗肺结核病的临床常用药,主要成分为利福平和异烟肼。因利福平和异烟肼在水分影响下会快速降解,故目前大多数药厂采用干法制粒工艺制备异福片,但该工艺存在生产效率低、粉尘污染严重等问题。笔者采用熔融制粒工艺替代干法制粒工艺,试验发现采用前者制备产品,对其质量无显著影响,并明显改善了生产效率,且工艺稳定、重现性良好,避免了干法制粒带来的粉尘污染问题,有利于生产操作人员的健康。由于原工艺对主药含量进行了严格控制,故此笔者主要考察利福平及醌式利福平、N-氧化利福平、利福霉素SV、异烟腙5种物质的情况。
1 材料
1.1 仪器
DHG-9245A型电热恒温鼓风干燥箱(浙江新丰医疗器械有限公司);FG-15B型沸腾干燥器、LYK-160型摇摆制粒机(重庆南方制药械厂);ZPS008型旋转式压片机(上海天祥健台制药机械有限公司);BG10D型高效包衣机(北京航空制造工程研究所);岛津LC-2010A高效液相色谱仪及紫外检测器[岛津企业管理(中国)有限公司]。
1.2 药品与试剂
异福片[原干法工艺,自制,批号:2012005、2012008,规格:0.45g(含利福平0.3g、异烟肼0.15g)];异福片[新工艺,自制,批号:20120601、20120602、20120701,规格:0.45g(含利福平0.3g、异烟肼0.15g)];利福平原料药(沈阳抗生素厂,批号:201204007,纯度:98.8%);异烟肼原料药(天津汉德威药业有限公司,批号:T2012033,纯度:99.3%);聚乙二醇4000(PEG4000)、聚乙二醇6000(PEG6000)(南京威尔化工有限公司);共聚维酮(深圳市优普惠药品有限公司);交联聚乙烯吡咯烷酮(PVPP)(上海昌为医药辅料技术有限公司);硬脂酸镁(湖州展望药业有限公司);利福平对照品(批号:130496-200702,纯度:98.0%)、异烟肼对照品(批号:100578-200401,纯度:99.7%)、醌式利福平对照品(批号:130413-201104,纯度:>99.0%)、N-氧化利福平对照品(批号:130522-201102,纯度:>99.0%)、利福霉素SV对照品(批号:0333-200006,纯度:>99.0%)均来自中国食品药品检定研究院;异烟腙对照品(自制,纯度:99.1%)。
2 处方工艺研究
2.1 处方研究
参考原干法工艺处方设计处方,重点对熔融黏合剂种类及用量进行了筛选及优化,主要以片剂脆碎度及溶出度为考察指标。处方筛选结果见表1。
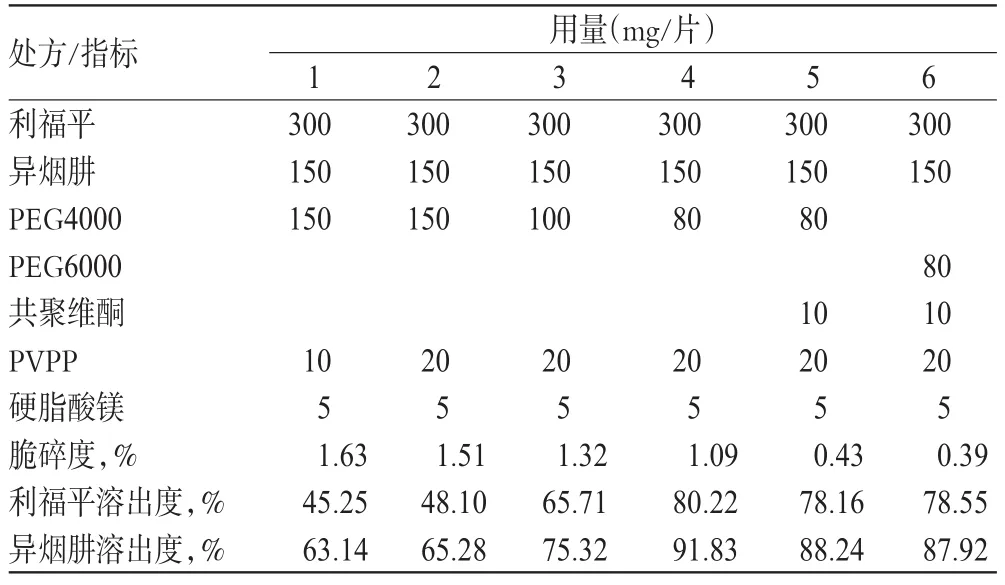
表1 处方筛选结果Tab 1 Results of formulation optimization
预试前期片剂脆碎度和溶出度均不合格,分析由于处方中PEG黏性不足,导致片剂刚性较差,且PEG用量越多刚性越差。因此加入共聚维酮作为辅助黏合剂,同时适当减少PEG4000用量,并增加PVPP用量,解决了脆碎度和溶出度不合格的问题。因采用PEG4000制备的素片包衣过程中出现变软现象,故选择了具有更高熔点的PEG6000予以改善。
最终确定的基础处方为:每片含利福平300mg,异烟肼150mg,PEG600080mg,共聚维酮10mg,PVPP 20mg,硬脂酸镁5mg,制成100片。
2.2 工艺研究
熔融制粒工艺主要原理是采用固体黏合剂与物料混合,具体为黏合剂在制备过程中受热产生黏合力,从而黏合物料制成颗粒[2]。选择熔融制粒工艺,主要看重该工艺可以黏合物料,避免制备过程中物料粉尘飞扬及设备吸附,同时整个过程无水参与,对产品稳定性有利。
熔融制粒最重要的环节就是固体黏合剂受热熔融,初期采用烘箱干燥方式加热物料。在试验中发现,若控制温度在60℃时,主药与PEG6000(熔点:53~58℃)的混合粉末温度上升缓慢,2h也未见完全熔融;而升高温度至80℃,需45min可完全熔融;继续升温至100℃,20min即可完全熔融。虽然高温可以加快熔融速度,提高生产效率,但过高的温度对产品质量可能存在一定影响,所以选择适宜的熔融温度是该工艺的研究重点。
取主药与PEG6000适量,混合均匀,分别置于80℃和100℃加热1h,制粒压片,用聚氯乙烯(PVC)硬片+PTP铝箔+双铝复合膜包装后置于60℃下考察。温度考察试验结果见表2。
由表2可见,过高温度进行熔融制粒对样品质量确有一定影响,因此宜将熔融时温度控制在不超过80℃。但采用烘箱干燥有两个问题,一是不仅熔融时间过长,而且为避免物料受热不均匀,加热时需不时翻动物料,操作麻烦且不安全;二是批量增大以后,不适合大生产。因此将工艺微调,由烘箱干燥改为沸腾干燥,因后者热效率高,不仅可以降低加热温度,而且还缩短了熔融时间,便于大生产操作。
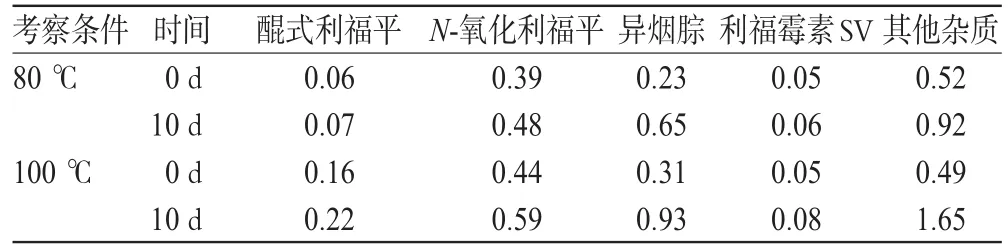
表2 温度考察试验结果(%)Tab 2Results of temperature experiments(%)
最终确定工艺为(每片质量):将活性成分利福平300mg、异烟肼150mg与黏合剂PEG600080mg充分混合均匀后,置于沸腾干燥器中;设置风机频率30~40Hz,进风温度设置为70℃,加热使PEG6000熔融;待物料温度达到60℃时,停止进风加热,趁热过16目筛制粒,放冷后整粒;再加入崩解剂PVPP 20mg、黏合剂共聚维酮10mg及润滑剂硬脂酸镁5mg得中间品颗粒,压片包衣即得成品,共5000片。
3 方法与结果
3.1 色谱条件
色谱柱:Kromasil C18(150mm×4.6mm,5μm);流动相:磷酸盐缓冲液(0.01mol/L磷酸二氢钾溶液,用0.01mol/L氢氧化钠调节pH值至7.0)-甲醇(40∶60),流速:1.0ml/min;检测波长:254nm;进样量:20μl[3]。
3.2 溶液的制备
对照品溶液的制备:精密称取利福平对照品适量,置于50ml量瓶中,加入流动相稀释制成每1ml中约含20μg利福平的溶液,作为对照品溶液;另精密称取醌式利福平、N-氧化利福平、利福霉素SV及异烟腙对照品适量,加流动相溶解并制成每1ml中约含各成分各10μg的混合溶液,作为杂质对照品溶液(临用新制,避光操作)。
供试品溶液的制备:取同一批号的样品10片,除去薄膜衣,研细,精密称取约含利福平40mg的细粉,置于100ml量瓶中,取流动相溶解并稀释至刻度,迅速摇匀,滤过,取续滤液作为供试品溶液(临用新制,避光操作)。
空白溶液的制备:按处方量称取不含利福平及异烟肼的其余辅料,照“2.2”项下最终确定工艺制备片剂,按供试品溶液的制备方法制备空白溶液。
3.3 系统适用性试验
分别取利福平、醌式利福平、N-氧化利福平、利福霉素SV以及异烟腙对照品适量,按“3.2”项下制备方法制成杂质对照品溶液,作为系统适用性试验溶液,按“3.1”项下色谱条件测定。结果,除N-氧化利福平峰与异烟腙峰外,其余各相邻杂质峰分离度均>1.5,理论板数以利福平峰计不低于3000。
3.4 方法学考察
3.4.1 专属性试验。精密称取利福平对照品适量,按“3.2”项下制备对照品溶液和空白溶液,各取20μl注入液相色谱仪,照“3.1”项下色谱条件测定。结果,在利福平保留时间相应的位置无其他色谱峰出现,溶剂和辅料对测定无干扰,异烟肼在此色谱条件中不出峰。高效液相色谱见图1。
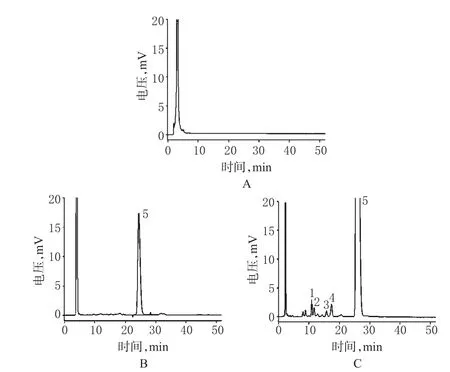
图1 高效液相色谱图A.空白溶液;B.利福平对照品溶液;C.供试品溶液;1.N-氧化利福平;2.异烟腙;3.利福霉素SV;4.醌式利福平;5.利福平Fig 1 HPLC chromatogramsA.blank solution;B.rifampicin control solution;C.test sample solution;1.N-oxide rifampicin;2.isoniazone;3.rifamycin SV;4.rifampicin quinone;5.rifampin
精密称取同一批号的样品细粉适量(约相当于利福平10mg),置于10ml量瓶中,按下列方法进行破坏性试验:加入1mol/L盐酸溶液0.5ml,混匀,80℃水浴锅中放置1h,取出,放冷,加入2mol/L氢氧化钠中和至pH值7.0,加流动相稀释至刻度,滤过,取续滤液作为酸降解溶液;加入1mol/L氢氧化钠溶液0.5ml,混匀,80℃水浴锅中放置1h,取出,放冷,加入2mol/L盐酸中和至pH值7.0,加流动相稀释至刻度,滤过,取续滤液作为碱降解溶液;加入20%过氧化氢溶液1ml,80℃水浴锅中放置1h,取出,放冷,加流动相稀释至刻度,滤过,取续滤液作为氧化降解溶液;置于80℃水浴中加热1h,取出,放冷,加流动相稀释至刻度,滤过,取续滤液作为高温降解溶液;置于照度为(4500±500)lx的强光下照射10d后,置于10ml量瓶中,加流动相溶解并稀释至刻度,作为光降解溶液。同法制备空白溶液。吸取上述各降解溶液20μl,注入液相色谱仪测定。结果表明,该法能有效检测出各破坏性试验产生的降解物,且溶剂和辅料对有关物质测定无干扰。降解溶液高效液相色谱见图2(因高温和碱降解试验中未见明显降解杂质峰,故图略)。
3.4.2 线性关系考察。分别精密称取利福平、醌式利福平、N-氧化利福平、利福霉素SV和异烟腙对照品各20mg,置于100ml量瓶中,加流动相溶解并稀释至刻度,摇匀,精密量取各溶液5ml,置于50ml量瓶中,加流动相稀释至刻度,摇匀,制成每1ml中含各成分20μg溶液作为对照贮备液。精密量取上述利福平对照贮备液0.1、0.5、1、5和10ml,分别置于10ml量瓶中,加流动相溶解并稀释至刻度,制成质量浓度分别为0.2、1、2、10和20mg/L的系列标准溶液。
精密量取上述醌式利福平、N-氧化利福平、利福霉素SV和异烟腙对照贮备液0.1、0.5、1、2和5ml,分别置于10ml量瓶中,加流动相溶解并稀释至刻度,制成质量浓度分别为0.2、1、2、4和10mg/L的系列标准溶液。

图2 降解溶液高效液相色谱图A.氧化降解溶液;B.光降解溶液;C.酸降解溶液;1.N-氧化利福平;2.异烟腙;3.利福霉素SV;4.醌式利福平;5.利福平Fig 2 HPLC chromatograms of degraded solutionA.degraded by oxidation solution;B.degraded by illumination solution;C.degraded by acid solution;1.N-oxide rifampicin;2.isoniazone;3.rifamycin SV;4.rifampicin quinone;5.rifampin
取上述系列标准溶液适量,按质量浓度从低到高的顺序,照“3.1”项下色谱条件进样,记录色谱图。以质量浓度(x)为横坐标、峰面积(y)为纵坐标进行回归,得线性方程如下:醌式利福平为y=1024.1x-11.8(r=0.99990);利福霉素SV为y=1435.3x-23.6(r=0.99994);N-氧化利福平为y=2013.2x-12.3(r=0.99995);异烟腙为y=1142.2x-54.1(r=0.99991);利福平为y=3214.2x-215.1(r=0.99993)。表明利福平检测质量浓度在0.2~20mg/L范围内与其峰面积积分值呈良好的线性关系。醌式利福平、利福霉素SV、N-氧化利福平和异烟腙检测质量浓度在0.2~10mg/L范围内与其峰面积积分值呈良好的线性关系。
3.4.3 定量限及检测限确定。精密称取利福平、醌式利福平、利福霉素SV、N-氧化利福平和异烟腙对照品适量,加流动相逐步稀释至信噪比约为10,进样20μl。结果,利福平、醌式利福平、利福霉素SV、N-氧化利福平和异烟腙定量限分别为0.26、0.30、0.31、0.22和0.23mg/L。继续稀释至信噪比约为3,进样20μl。结果,利福平、醌式利福平、利福霉素 SV、N-氧化利福平和异烟腙检测限分别为0.12、0.15、0.15、0.11和0.11mg/L。
3.4.4 精密度试验。配制对照品溶液适量,各6份,分别进样20μl。结果,利福平、醌式利福平、利福霉素 SV、N-氧化利福平和异烟腙的RSD分别为1.73%、2.12%、1.54%、2.33%和2.67%(n=6),表明仪器精密度良好。
3.4.5 稳定性试验。取同一供试品溶液及对照品溶液适量,在0、2、4、8、12、24h时分别进样20μl,记录利福平峰面积。结果,RSD分别为0.63%和0.47%(n=6),表明供试品溶液和对照品溶液在室温放置24h内均稳定。
3.4.6 回收率试验。精密称取同一批号的样品细粉适量(约相当于利福平50mg),置于100ml量瓶中,加流动相溶解并稀释至刻度,摇匀,制成每1ml中约含利福平0.2mg的溶液,滤过,取续滤液作为供试品溶液。取该供试品溶液2ml,共9份,每组3份,分别加入质量浓度为2、4和8mg/L的醌式利福平、利福霉素SV、N-氧化利福平和异烟腙对照品溶液各1ml,进样测定,计算3个质量浓度的平均回收率。结果平均回收率分别为:醌式利福平99.5%、利福霉素SV 99.8%、N-氧化利福平100.3%和异烟腙100.4%,RSD依次分别为2.11%、0.98%、1.37%和1.54%(n=9)。
3.5 影响因素试验
取2批原干法工艺制备的异福片(批号:2012005、2012008)与3批新工艺制备的异福片(批号:20120601、20120602、20120701)置于高温(60℃)中进行10d影响因素试验(PVC硬片+PTP铝箔+双铝复合袋包装),试验结果见表3。
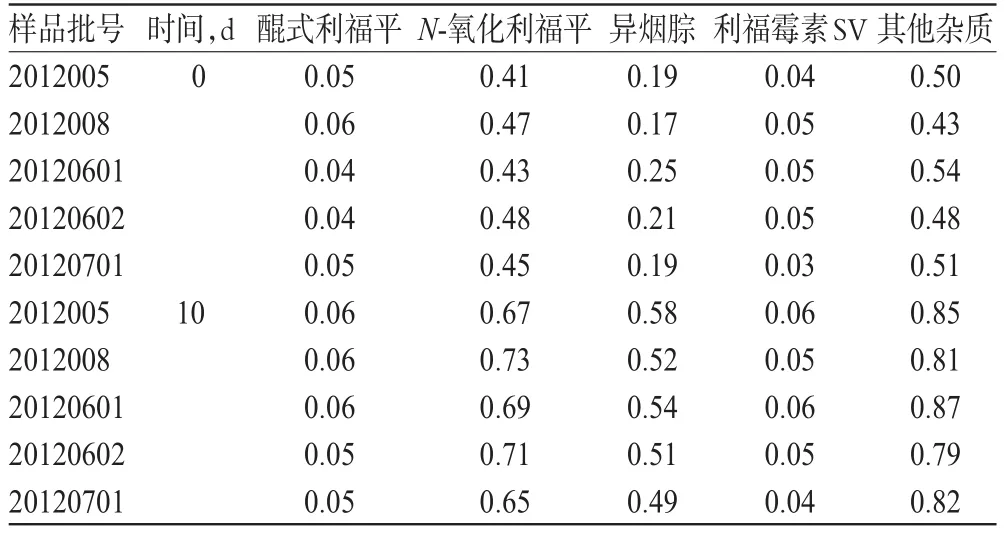
表3 影响因素试验结果(%)Tab 3Results of influential factor test(%)
由表3可见,两种工艺所制备的产品质量无明显差异。
3.6 稳定性试验
为进一步考察两种工艺制备的产品质量,将“3.5”项下5批异福片置于40℃中进行6个月加速稳定性试验(PVC硬片+PTP铝箔+双铝复合袋包装),结果详见表4。
由表4可见,两种工艺所制备产品质量无明显差异。
4 讨论
(1)干法制粒粉尘污染很大程度上是由于国内现有干法制粒设备设计不合理造成。这些设备设计过于简单,未过多考虑粉尘问题,特别是在筛分环节,粉尘量巨大。由于异福片处方中多为细粉,生产过程中极易扩散,且随着生产过程中设备的振动,又进一步加大了粉尘产生及扩散。大量细粉不仅影响车间环境,而且对操作人员健康不利,因此笔者进行了工艺改进。当然,选用优良的干法设备,控制干法制粒系统处于完全密封的环境,也可以减少生产过程中的粉尘污染,但鉴于目前较高的设备更换费用,生产企业全面更换并不现实。熔融制粒为企业提供了多一种选择。因此笔者认为在目前环境下熔融制粒工艺是有其优越性的。
(2)本次试验采用的是中试规模压片机(8冲),且批量较小(5000片)。因PEG6000的熔点为53~58℃,所以大生产规模长时间压片后,高速压片机(40冲)发热有可能会导致PEG出现微熔现象,从而引起黏冲,这还需在今后大生产中进一步考察优化。
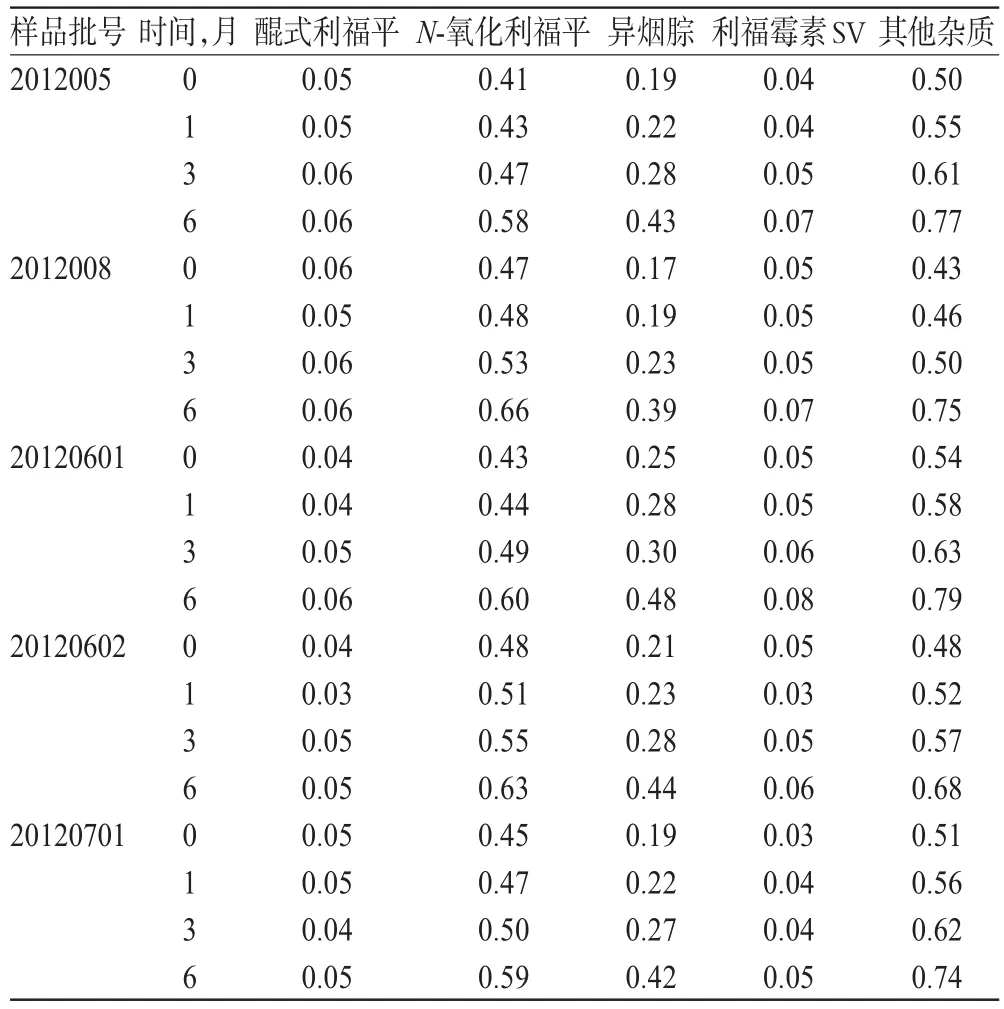
表4 稳定性试验结果(%)Tab 4Results of stability test(%)
(3)除异福片外,异福酰胺片同理也可采用此工艺。该工艺不仅可作为此类品种的通用制备方法,也可适用于其他无热敏性物料干法工艺品种的改进。
(4)由于该制剂对湿不稳定,所以生产一直采用铝塑加双铝复合袋方式包装。
根据我公司以往质量研究经验,本品主药易降解,自身稳定性较差,因此将有关物质作为本文研究的重点。虽然试验同时对水分、含量、溶出度等其他质量指标也进行了研究,但鉴于篇福未一一列出。本次试验旨在改进制备工艺,并不对包材进行筛选,因此仍然延用生产包装进行考察,此包装条件可有效隔绝湿度对制剂的影响,故本次试验未考虑高湿条件对制剂的影响。
[1] 国家药典委员会.中华人民共和国药典:二部[S].2010年版.北京:中国医药科技出版社,2010:297-298.
[2] 朱海彦,方增军,孙杰,等.热熔制粒在口服固体制剂中的应用[J].中国现代应用药学,2011,28(7):623.
[3] 毕秀玲,钱小平,赵迎春,等.高效液相色谱法测定异福片中利福平含量[J].中国药业,2013,22(2):17.
