黑火药烟雾致吸入性肺损伤大鼠模型的建立与评价
2013-08-28刘一凡唐红卫吴小利谢尹晶张洪瑞段晋燕向代军兰晓梅李绵洋王成彬李登清
刘一凡,唐红卫,吴小利,谢尹晶,张洪瑞,段晋燕,向代军,兰晓梅,李绵洋,王成彬,李登清
在战争或军事演习的特殊环境中,火药通常被用于掩护我方﹑攻击敌方或模拟实战环境。火药在爆炸﹑燃烧过程中会释放大量的有毒气体﹑粉尘及颗粒,军事人员极易因长期暴露于此环境而引发急性呼吸道和肺损伤,如化学性肺水肿﹑吸入性肺炎等,严重者甚至发展为呼吸衰竭[1]。黑火药是军事活动中常用的弹药材料,因其烟雾的致伤因素复杂,目前其致伤机制研究仅限于体外实验[2],若要进一步探索黑火药烟雾导致的肺部损害的发病机制﹑药物预防及治疗效果评价,尚需构建稳定﹑可靠的动物模型。为此,本研究在火药烟雾吸入毒理学分析平台的基础上改进装置[3],构建火药烟雾致吸入性肺损伤的大鼠模型,并对该模型进行评价。
1 材料与方法
1.1 实验动物 健康雄性Wistar大鼠,体重210~230g,由解放军总医院实验动物中心提供,合格证号SCXK(京)2012-0001。大鼠于动物中心清洁房中饲养,温度21~24℃,湿度50%~60%,昼夜12h节律,自由进食﹑饮水。
1.2 仪器及设备
1.2.1 火药烟雾发生装置 由烟雾发生室和动物烟熏室两部分组成,材质均为聚乙烯。烟雾发生室内径32cm×28cm×34cm ,内置遥控电磁加热器﹑发烟盘﹑气泵(输出功率150W),其顶盖距边线10cm处分别接有3个直径为5cm的导烟管,其中1个导烟管一端与缓冲袋相连,另外2个导烟管与气泵两端相连,作为推动两室气体循环流动的通道。动物烟熏室内径32cm×24cm×34cm,侧壁有供气体检测仪和温度检测仪采样的端口(图1)。

图1 火药烟雾发生装置模型示意图Fig. 1 Schematic layout of smog-generating device
1.2.2 火药成分 依据民用黑火药国家标准GB18450-2001配制火药,即按质量百分比将75%硝酸钾(分析纯,北京化学试剂公司)﹑10%硫黄粉(纯度99.9%,200目,北京西四化工原料公司)﹑15%碳粉(分析纯,国药集团化学试剂公司)分别研磨后混匀,并经100目筛过滤,37℃干燥24h后收集于洁净塑料盒中密封保存。
1.2.3 气体成分及温度检测 采用一氧化碳检测仪CO-180(北京金泰科仪检测仪器有限公司)检测CO浓度,泵吸式红外二氧化碳气体分析仪(北京宝云兴业科贸有限公司)检测CO2浓度,GDYK-402S空气现场二氧化硫测定仪(长春吉大小天鹅仪器有限公司)检测SO2浓度,GDYK-101S空气现场硫化氢速测仪(长春吉大小天鹅仪器有限公司)检测H2S浓度,温度快速检测仪(长春吉大小天鹅仪器有限公司)测定烟雾温度。
1.3 实验设计
1.3.1 火药剂量﹑暴露时间与死亡率的关系 ①将大鼠在固定烟熏时间(21min)的条件下分别暴露于不同火药剂量(5﹑7.5﹑9﹑10﹑11﹑12.5﹑15g)所产生的烟雾中;②将大鼠在固定烟雾浓度(火药剂量为10g)的条件下分别放置不同时间(8﹑9﹑10﹑15﹑21min)。记录并分析整个烟熏过程中及烟熏处理后连续4d内大鼠的死亡情况。
1.3.2 肺损伤模型 42只Wistar大鼠随机分为对照组和建模后1﹑2﹑6﹑24﹑48﹑96h组(n=6),建模组大鼠置于密闭的动物烟熏箱并在10g火药产生的烟雾中暴露8min,然后依据分组在相应时间点处死。对照组大鼠暴露于动物烟熏箱的空气中8min,于暴露后96h处死。
“专业发展环境”主要用来衡量学校的整体氛围对教师专业发展的影响。有关要素包括:学校领导对教师专业发展的重视程度和其他管理层的态度;学习与研修场所;外聘专家来校指导;教师外出学习、经费等。其中,除了“外出学习机会与经费”的认可度接近高,其他要素的认可度均为高。
1.4 烟熏处理 称固定质量的火药放入发烟室的不锈钢发烟盘中,置于遥控电磁加热器上,上方扣上安全网盖,每次于动物烟熏室中放入装有2只待处理大鼠的动物笼,盖紧,打开两室内风扇,并关闭装置顶盖,检查气密情况,使用遥控装置将电磁加热器调至功率最大挡位,火药燃尽至无明火后,关闭电磁加热器,并启动气泵。待暴露时间到达后,打开烟熏箱取出大鼠,置于空气中。
1.5 观测指标
1.5.1 烟雾中CO﹑CO2﹑SO2﹑H2S浓度及温度 检测火药燃烧后3﹑9﹑12min时各气体成分的浓度及烟雾的温度。
1.5.2 临床表现 观察大鼠在吸入烟雾过程中及烟熏结束后的呼吸情况﹑活动情况及精神状态﹑发绀程度等。
1.5.3 动脉血气 在相应时间点用4%水合氯醛(1ml/kg)腹腔注射麻醉大鼠,暴露分离腹主动脉,取血1ml后放血处死大鼠,于半小时内进行动脉血气分析。
1.5.4 肺湿/干比(W/D) 取右肺前叶﹑中叶,用滤纸拭干表面血液,以电子天平称重(湿重),然后放入60℃烘箱烘烤48h至恒重,电子天平称重(干重),计算W/D值。
1.5.5 支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)白细胞计数及蛋白含量测定 腹主动脉放血处死大鼠后,打开胸腔,分离主支气管,夹闭右主支气管,在主支气管切开处置入自制灌洗针并结扎固定,用4℃生理盐水2.5ml行左肺灌洗,重复3次,记录回收量。BALF经1500r/min离心10min,收集上清液,BAC法测定总蛋白含量,取沉淀重悬于1ml生理盐水,进行白细胞计数。
1.5.6 肺组织病理学检查 打开胸腔后观察肺组织大体病理改变,取右肺后叶浸入4%中性甲醛溶液中固定24h,石蜡包埋,4μm连续切片,常规HE染色后光镜下观察。
1.6 统计学处理 采用SPSS 17.0软件进行统计分析。符合正态分布及方差齐性的计量资料以±s表示,组间比较采用单因素方差分析(One-way ANOVA),建模组与对照组比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 火药剂量﹑暴露时间与死亡率的关系 将暴露时间固定为21min,火药剂量为5g时未见大鼠死亡,火药剂量从7.5g增高到10g时,大鼠死亡率自12.5%增至77.8%,当火药剂量为15g时,死亡率达到100%。当固定火药剂量为10g时,死亡率随暴露时间延长而增加,暴露时间为8min时,烟熏处理后4d内未见大鼠死亡,而当时间增至21min时,4d内大鼠死亡率达到77.8%。
2.2 烟雾中CO﹑CO2﹑SO2﹑H2S浓度及温度测定结果 10g黑火药完全形成烟雾后3﹑9﹑12min,动物烟熏箱中CO﹑CO2﹑SO2﹑H2S浓度及温度差异无统计学意义(P<0.05,表1)。
表1 烟雾形成后不同时间点气体浓度﹑温度变化(±s,n=10)Tab. 1 Smog concentration and temperature at each time point after smog emergence (±s, n=10)
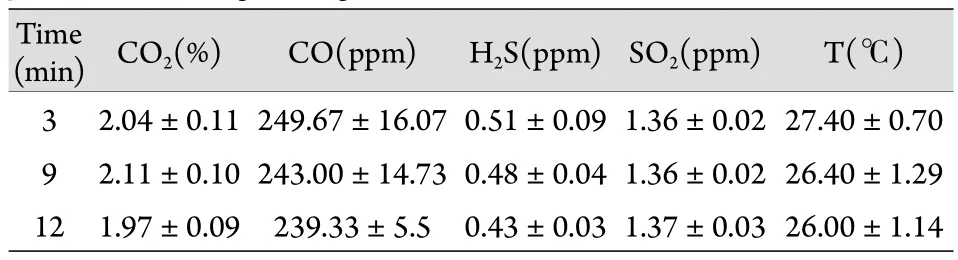
表1 烟雾形成后不同时间点气体浓度﹑温度变化(±s,n=10)Tab. 1 Smog concentration and temperature at each time point after smog emergence (±s, n=10)
CO. 1ppm=2.86×10-8mol/L; H2S. 1ppm=1.94×10-8mol/L; SO2.1ppm=5.47×10-9mol/L
Time(min)CO2(%) CO(ppm) H2S(ppm)SO2(ppm) T(℃)3 2.04±0.11 249.67±16.07 0.51±0.09 1.36±0.02 27.40±0.70 9 2.11±0.10 243.00±14.73 0.48±0.04 1.36±0.02 26.40±1.29 12 1.97±0.09 239.33±5.5 0.43±0.03 1.37±0.03 26.00±1.14
2.3 临床表现 对照组大鼠至实验结束时无异常,精神可,反应灵活,活动正常,体毛光滑,呼吸平稳。建模组大鼠在烟熏处理后立即出现呼吸急促﹑张口呼吸并伴随口鼻分泌物增多,可闻及因呼吸困难产生的呜咽声,四肢﹑口唇处可见发绀。烟熏处理1h后,建模组大鼠呼吸由急促变深大,呼吸困难及发绀症状稍减轻,至烟熏后96h均表现为精神萎靡,反应差,活动少,毛发无光泽并伴有深大呼吸。
2.4 动脉血气分析结果 对照组大鼠PaO2为83.27±4.99mmHg,烟雾吸入1h后,建模组大鼠PaO2迅速降至47.79±13.28mmHg,6h后逐渐升高至64.10±12.61mmHg,但仍显著低于对照组(P<0.05),至96h仍未恢复至对照组水平。PaCO2在烟熏处理后24h内呈升高趋势,至24h达最高值(60.56±8.42mmHg),此后逐渐降低,96h恢复至对照组水平。对照组COHb水平为0.60%±0.11%,建模组大鼠烟熏后1 h C O H b水平迅速增至11.22%±4.98% (P<0.05),烟熏后6h恢复至对照组水平,SO2%﹑O2Hb变化趋势与COHb相反(表2)。
表2 各组大鼠烟雾吸入前后PaO2﹑PaCO2﹑SO2的变化(±s,n=6)Tab. 2 Changes of PaO2, PaCO2 and SO2 before and after smog inhalation (±s, n=6)

表2 各组大鼠烟雾吸入前后PaO2﹑PaCO2﹑SO2的变化(±s,n=6)Tab. 2 Changes of PaO2, PaCO2 and SO2 before and after smog inhalation (±s, n=6)
(1)P<0.05 compared with NC group; (2)P<0.05 compared with I-1h group; (3)P<0.05 compared with I-2h group; (4)P<0.05 compared with I-6h group; (5)P<0.05 compared with I-24h group; (6)P<0.05 compared with I-48h group
Group PaO2(mmHg) PaCO2(mmHg) SO2(%) COHb(%) O2Hb(%)NC group 83.27±4.99 42.42±3.27 91.45±3.43 0.60±0.11 90.90±3.40 I-1h group 47.79±13.28(1) 54.28±3.67(1) 67.82±16.30(1) 11.22±4.98(1) 60.29±15.51(1)I-2h group 51.67±10.11(1) 46.18±6.06(2) 72.53±9.90(1) 7.87±3.82(1) 69.23±10.48(1)I-6h group 64.10±12.61(1)(2)(3) 55.98±9.97(1)(2) 77.90±13.23 1.33±0.42 76.75±13.32(2)I-24h group 62.30±9.60(1)(2) 60.56±8.42(1)(2) 77.25±13.98 0.90±0.15 76.43±13.90(2)I-48h group 78.53±7.05(2)(3)(4)(5) 53.28±5.93(1) 90.63±5.12(2)(3) 0.90±0.17 89.83±5.04(2)(3)(5)I-96h group 65.00±11.21(1)(2)(3)(6) 48.30±2.01(5) 80.90±8.82 1.00±0.12 80.02±8.81(2)F value 10.318 5.327 3.923 18.792 6.464 P value <0.05 <0.05 <0.05 <0.05 <0.05
2.5 W/D及BALF白细胞计数﹑蛋白含量测定结果 烟雾吸入后1﹑2﹑6﹑96h时间点建模组大鼠W/D显著高于对照组(P<0.05),并于2h时达最高值。各组BALF回收量均达80%以上,BALF中白细胞数自烟雾吸入后2h开始上升,至24h时达峰值,为(39.00±15.67)×105/ml,随后降低。BALF中蛋白含量于烟雾吸入后1h达最高值,随后逐渐下降,至48h恢复至对照组水平(表3)。
表3 肺W/D及BALF白细胞计数﹑总蛋白含量的变化(±s,n=6)Tab. 3 Changes of W/D, leukocytes and protein before and after smog inhalation (±s, n=6)
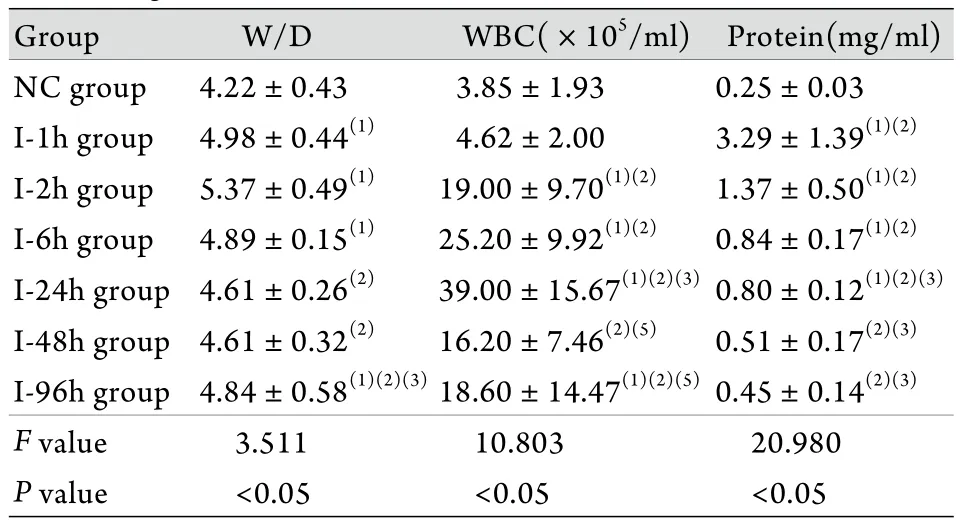
表3 肺W/D及BALF白细胞计数﹑总蛋白含量的变化(±s,n=6)Tab. 3 Changes of W/D, leukocytes and protein before and after smog inhalation (±s, n=6)
(1)P<0.05 compared with NC group; (2)P<0.05 compared with I-1h group; (3)P<0.05 compared with I-2h group; (4)P<0.05 compared with I-6h group; (5)P<0.05 compared with I-24h group; (6)P<0.05 compared with I-48h group
Group W/D WBC(×105/ml) Protein(mg/ml)NC group 4.22±0.43 3.85±1.93 0.25±0.03 I-1h group 4.98±0.44(1) 4.62±2.00 3.29±1.39(1)(2)I-2h group 5.37±0.49(1) 19.00±9.70(1)(2) 1.37±0.50(1)(2)I-6h group 4.89±0.15(1) 25.20±9.92(1)(2) 0.84±0.17(1)(2)I-24h group 4.61±0.26(2) 39.00±15.67(1)(2)(3)0.80±0.12(1)(2)(3)I-48h group 4.61±0.32(2) 16.20±7.46(2)(5) 0.51±0.17(2)(3)I-96h group 4.84±0.58(1)(2)(3)18.60±14.47(1)(2)(5)0.45±0.14(2)(3)F value 3.511 10.803 20.980 P value <0.05 <0.05 <0.05
2.6 肺组织病理观察结果 肺组织大体观:对照组大鼠肺组织颜色均匀,呈肉粉色,组织质地柔软,弹性好,未见肿胀﹑出血及坏死。建模组大鼠在吸入烟雾24h内,肺组织正面及背面均明显充血水肿,呈暗红色,肺表面可见多处斑片状出血,气管腔内含有乳白色泡沫,至吸入后96h可见肺组织恢复至淡红色,肺叶边缘出现斑片状暗红色梗死灶,弹性差(图2)。光镜下观察:对照组大鼠肺泡腔结构清晰﹑完整,腔内无渗出液,肺泡间隔均匀一致;烟雾吸入1h后血管外即出现明显出血﹑水肿,至6h可见毛细血管扩张,肺泡腔内可见透明膜及漏出红细胞,24h后可见炎性细胞浸润,48h后肺泡腔明显增宽,肺泡间隔明显增厚,炎性细胞浸润增多,96h可见大量肺泡间隔断裂,大量炎性细胞浸润,以单核﹑巨噬细胞为主(图3)。
3 讨 论
既往研究构建吸入性肺损伤模型所采用的发烟材料主要为煤油及干燥的松木屑,但这种方法产生的烟雾成分及燃烧方式与实战环境差别较大[4-5]。本研究采用战争中常用的黑火药,保证了燃烧材料的单一,既利于致伤因素分析,又能准确模拟战场环境。
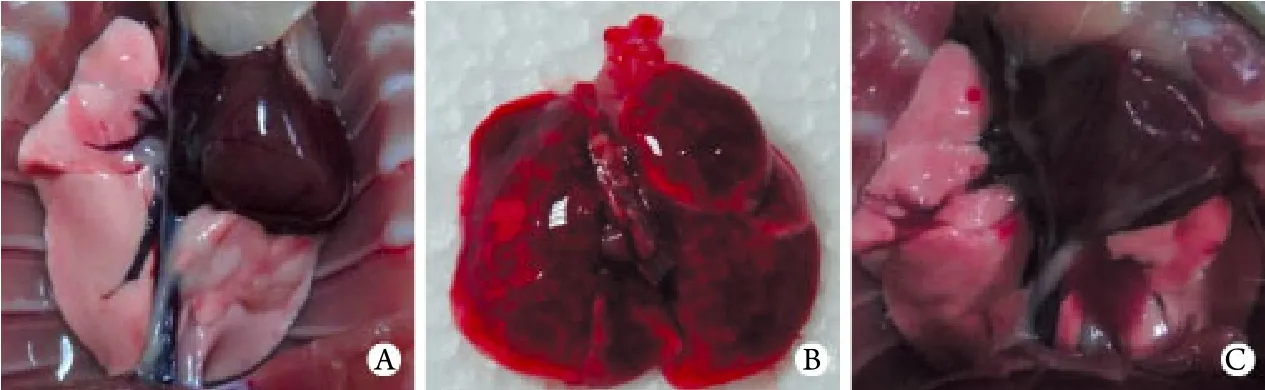
图2 肺组织大体观Fig. 2 Gross examination of the rat lungs

图3 肺组织病理学观察(HE ×100)Fig. 3 Histopathological observation of the lung tissues (HE ×100)
本研究在火药烟雾吸入毒理学分析平台的基础上进行改装,制作了适合建立动物吸入性肺损伤模型的发烟装置。装置中烟雾在风泵产生的气流推动下形成闭合回路,形成浓度分布均匀的烟雾环境。该装置中发烟室与动物烟熏室相互独立,排除了火药可能导致的烧伤﹑冲击伤等复合致伤因素,保证了吸入性损伤为单一致伤因素。气体浓度和温度的检测与监控确保了构建模型条件的一致性和可靠性。此外,本装置在确保重复性和可靠性的条件下,体积小,组装简单,便于推广应用。本研究的不足之处是未能进行烟雾成分中相关颗粒物的成分及粒径检测。
本研究分别改变火药燃烧剂量和烟雾暴露时间,观察大鼠在4d内的生存情况,发现其死亡率随火药剂量增加及暴露时间延长而升高,与文献报道趋势一致[5-6],但火药剂量为11.0~12.5g时大鼠死亡率低于剂量为10g时,分析原因可能与动物个体差异及数量较少有关。暴露时间为21min时,半数致死剂量在8~10g之间,取10g火药燃烧,暴露10min时4d内死亡率为40%,接近半数死亡率,而暴露8min时,4d内未见动物死亡,因此选择10g火药燃烧﹑暴露10min为致伤条件。
黑火药燃烧原理为硝酸钾分解放出的氧气,使碳和硫剧烈燃烧,瞬间产生大量N2﹑CO2等气体。本研究表明,在烟雾产生12min内,CO2﹑CO﹑SO2﹑H2S气体浓度及烟熏室中温度均保持稳定。CO2及CO浓度远高于空气中的正常含量,CO是一种常见的窒息性毒物,同时有研究表明高浓度CO2也可能是导致肺部损伤的因素[7-8]。动脉血气分析结果显示大鼠在烟熏处理后即出现低氧血症,随后PaO2逐渐恢复,PaCO2先升高,至吸入后48h逐渐降低。COHb是由CO与血红蛋白相结合而形成,可使血红蛋白失去输氧能力,肺部因缺氧致伤,其含量通常被认为是判断CO中毒的可靠指标[9]。本研究大鼠动脉血中COHb含量在烟雾吸入1h后即达到峰值,6h后恢复至正常水平,因此推测烟雾吸入后早期的低氧血症可能是由大量吸入CO引起的。
W/D是评价肺水肿严重程度的良好指标,而BALF中蛋白含量与肺微血管通透性呈正比[10]。本模型中,W/D和BALF蛋白含量在烟雾吸入后均迅速升高,提示大鼠经烟雾刺激后肺部微血管通透性增加,并出现肺水肿。BALF中白细胞计数是反映气道及肺部炎症的重要指标,本研究结果显示,烟雾暴露后大鼠BALF中白细胞计数呈进行性增加,至吸入后24h达峰值,96h仍未恢复至正常水平,与人类及其他动物模型烟雾吸入后变化趋势一致[6],提示烟雾吸入可致肺局部炎症细胞聚集,继而活化并释放相关炎性因子﹑氧自由基等,最终导致炎症反应的发生。病理组织学观察结果与上述指标变化趋势一致,至烟雾暴露后96h仍表现出典型的急性肺损伤的病理学特征。
综上所述,采用本研究中的发烟装置引燃10g火药,并使大鼠在所产生的烟雾中暴露8min能够成功构建吸入性肺损伤大鼠模型,且在实验观察时相内出现典型的急性肺损伤病理学特征,同时未见动物因窒息而死亡。本模型的成功构建为进一步研究火药烟雾所致吸入性肺损伤的发病机制及防治措施奠定了基础。
[1] Huang KL, Chen CW, Chu SJ, et al. Systemic inflammation caused by white smoke inhalation in a combat exercise[J]. Chest,2008, 133(3): 722-728.
[2] Feng L, Yue JX, Lan YT, et al. The role of ROS in human bronchial epithelial cell injury caused by gunpowder smoke[J].Labeled Immunoassays Clin Med, 2010, 17(1): 27-29.[冯亮, 乐家新, 兰亚婷, 等. ROS在火药烟雾致人支气管上皮细胞损伤中的作用[J]. 标记免疫分析与临床, 2010, 17(1): 27-29.]
[3] Lan X, Feng L, Liu Y, et al. In vitro study of injury on human bronchial epithelial cells caused by gunpowder somg[J]. Inhal Toxicol, 2013, 25(2): 118-125.
[4] Zhou M, Yao B, Yan SX, et al. Establishment of a rat model of inhalation lung injury induced by powder combustion[J]. Med J Chin PLA, 2005, 30(8): 734-737. [周敏, 姚斌, 严尚学, 等. 爆炸及火药燃烧致吸入性肺损伤大鼠实验模型的建立[J]. 解放军医学杂志, 2005, 30(8): 734-737.]
[5] Zhu F, Qiu XC, Wang JJ, et al. A rat model of smoke inhalation injury[J]. Inhal Toxicol, 2012, 24(6): 356-364.
[6] Matthew E, Warden G, Dedman J. A murine model of smoke inhalation[J]. Am J Physiol Lung Cell Mol Physiol, 2001,280(4): 716-723.
[7] Abolhassani M, Guais A, Chaumet-Riffaud P, et al. Carbon dioxide inhalation causes pulmonary in fl ammation[J]. Am J Physiol Lung Cell Mol Physiol, 2009, 296(4): 657-665.
[8] Zhou Y, Lan XM, Wang CB. Study on the secretion of IL-8 and IL-6 by bronchial epithelial cells (BEAS-2B) injured by black[J].Med J Chin PLA, 2012, 37(3): 260-262.[周莹, 兰晓梅, 王成彬.葛根素对火药烟雾致支气管上皮细胞损伤的防护效应[J].解放军医学杂志, 2012, 37(3): 260-262.]
[9] Lange M, Cox RA, Enkhbaatar P, et al. Predictive role of arterial carboxyhemoglobin concentrations in ovine burn and smoke inhalation-induced lung injury[J]. Exp Lung Res, 2011, 37(4):239-245.
[10] Qiu X, Li H, Tang H, et al. Hydrogen inhalation ameliorates lipopolysaccharide-induced acute lung injury in mice[J]. Int Immunopharmacol, 2011, 11(12): 2130-2137.
