CD13+CD133+和CD13-CD133-肝癌细胞的生物学差异及临床意义
2013-08-28金世龙黄中荣陈华余天雾曹洪龙运全周健李鹤苟毅李远廖娟
金世龙,黄中荣,陈华,余天雾,曹洪,龙运全,周健,李鹤,苟毅,李远,廖娟
在肿瘤组织中,极少量致瘤性细胞亚群具有无限增殖的潜能,对化疗药物存在抗药性,它们在肿瘤组织中充当着干细胞的角色,并在启动肿瘤形成和维持生长中起决定性作用。研究显示,肿瘤复发和转移的根源可能与肿瘤干细胞(cancer stem cells,CSCs)有关,且越来越多的研究注意到了CSCs的重要性,并在分选基础上进行CSCs自我更新﹑分化,形成肿瘤球和移植成瘤能力等的分析[1-2]。肝细胞癌(hepatocellular carcinoma,HCC)为第五大常见癌症,病死率位居第三,治疗效果差且易复发和转移[3-5]。本研究采用CD13﹑CD133双抗体分选人肝癌HuH7细胞系,研究CD13+CD133+HCC和CD13-CD133-HCC细胞的生物学特征,为临床肝癌治疗提供依据。
1 材料与方法
1.1 主要材料及试剂 人肝癌HuH7细胞系由第三军医大学西南医院病理研究所提供。CD13荧光抗体(PE)购自BD公司;CD133荧光抗体(APC)购自美天尼公司;DMEM/F12(1:1)﹑DMEM培养基﹑胎牛血清(FBS)为Hyclone产品;RPMI 1640培养基为IVD产品。流式细胞仪BD FACS Aria Ⅱ和BD FACSCalibur,全波长酶标仪Thermo Multiskan Spectrum。
1.2 HuH7细胞培养 HuH7细胞在含10% FBS的DMEM培养液中于37℃﹑5%CO2﹑饱和湿度的培养箱中孵育,待细胞融合度达到70%~80%时以0.25%胰酶消化细胞。
1.3 CD13+CD133+HCC细胞的分选 常规消化HuH7细胞,制成单细胞悬液并计数,PBS洗1次,置于1.5ml EP管中,设置空白对照组和CD13/CD133双抗体组。每管中加入5μl抗体,4℃避光孵育30min,700r/min离心5min,弃上清,PBS洗3次,300μl PBS重悬细胞,流式细胞仪分选细胞。
1.4 CD13+CD133+﹑CD13-CD133-HCC细胞增殖情况 将分选后的HuH7细胞分别接种于96孔板,每孔加1×103个细胞,加入200μl含10%FBS的DMEM培养基,2~3d换液,每组设5个复孔及空白对照孔。培养24h后加入20μl MTT溶液(5mg/ml),孵育4h,吸出培养基,加入150μl DMSO,室温下振摇10min,在酶标仪上测定490nm处的吸光度(A)值,绘制细胞生长曲线。
1.5 CD13+CD133+﹑CD13-CD133-HCC对5-FU和吡柔比星的敏感性分析 细胞贴壁后分别加入不同浓度5-FU(5﹑10﹑20μg/ml)和吡柔比星(1﹑10﹑20μg/ml),每种浓度设5个复孔,设调零孔(不加细胞)和对照孔(不加药物),在37℃﹑5%CO2﹑饱和湿度的培养箱中分别孵育24﹑48﹑72h,弃培养液,每孔分别加入180μl DMEM培养基和20μl MTT溶液,继续培养4h;吸出培养液,分别加入150μl DMSO,室温下振摇10min,在酶标仪上测定490nm处的A值,计算细胞存活率,确定细胞对抗癌药物的敏感性。
1.6 裸鼠体内成瘤情况分析 将新分选的CD13+CD133+HCC细胞按1.0×103﹑5.0×103﹑1.0×104﹑5.0×104个细胞分为4组,采用PBS配成100μl细胞悬液,注射到裸鼠(清洁级)腹部皮下,每组5只。CD13-CD133-HCC细胞设1.0×104﹑1.0×105个细胞组做对照。每周观察成瘤情况。
1.7 HuH7细胞系两亚群的细胞周期测定 取HuH7细胞系两亚群各1×106个分选细胞制成悬液;加入-20℃乙醇500μl固定,PBS洗涤,重悬;加入5μl RNase(50μg/ml)室温放置20min,800r/min离心5min,细胞悬于95μl PBS;加入5μl PI溶液(5μg/ml),冰上放置30min,流式细胞仪检测DNA含量。
1.8 流式细胞术检测HuH7细胞系两亚群的分化情况 常规消化HuH7细胞,制成单细胞悬液并计数,PBS洗1次,置于1.5ml EP管中,设置空白对照管﹑CD13﹑CD133﹑CD13-CD133双抗体4组。每管中加入5μl抗体,4℃避光孵育30min,700r/min离心5min,弃上清,PBS洗3遍,300μl PBS重悬细胞,流式细胞仪检测CD13﹑CD133标志表达情况。
2 结 果
2.1 CD13+CD133+和CD13-CD133-HCC细胞生长曲线 CD13+CD133+HCC细胞增殖较快,最初2d为平台期,至第3天增殖明显;而CD13-CD133-HCC增殖较慢,到第7天增殖加快,但只有CD13+CD133+HCC的1/2(图1)。

图1 HuH7细胞亚群生长曲线比较Fig.1 The growth curves of subgroup of HuH7 cells
2.2 HuH7两种细胞亚群对5-FU和吡柔比星的敏感性分析 30μg/ml 5-FU持续作用48h后,CD13+CD133+HCC细胞存活率为70%,对5-FU抵抗;而CD13-CD133-HCC细胞较易被杀死,10μg/ml 5-FU作用48h后细胞存活率仅为40%,30μg/ml作用48h细胞存活率为10%(图2A),两亚群对5-FU的反应存在较大差异。不同浓度吡柔比星作用48h仍有10%~40%CD13+CD133+HCC细胞存活,耐受性强于CD13-CD133-HCC(图2B),提示CD13+CD133+HCC细胞具有抗化疗特征。
2.3 CD13+CD133+HCC细胞在裸鼠体内的成瘤情况 1×103个CD13+CD133+HCC细胞在裸鼠体内即可成瘤(1/5),1×104个CD13+CD133+HCC细胞可使4只裸鼠成瘤(4/5);而1×104个CD13-CD133-HCC不能成瘤(0/5),1×105个CD13-CD133-HCC细胞才能成瘤(2/5)。提示CD13+CD133+HCC细胞具有分化成癌细胞以及自我更新的能力,具备CSCs的特征。
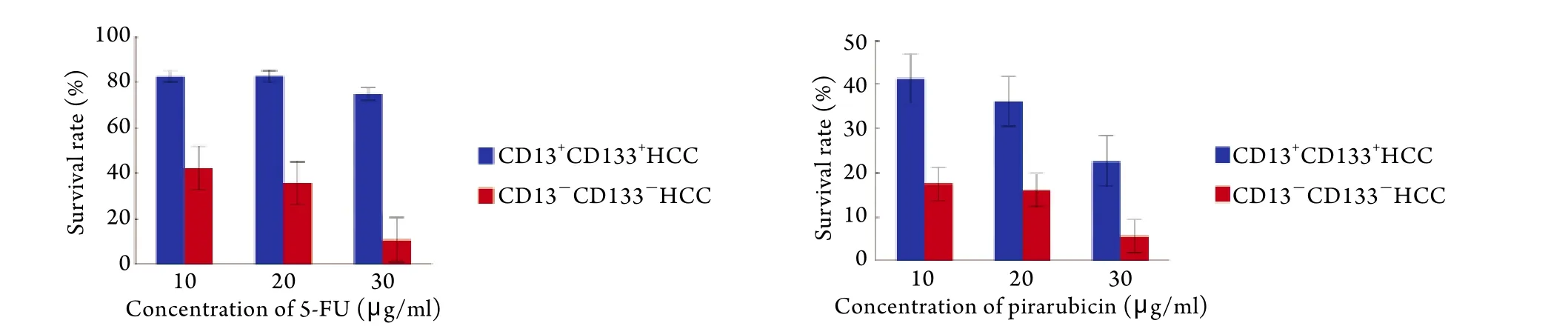
图2 5-FU(A)及吡柔比星(B)处理48h后CD13+CD133+和CD13-CD133-HCC细胞存活率比较Fig.2 Comparison of survival rate between CD13+CD133+and CD13-CD133-HCC cells treated by 5-FU (A) or pirarubicin (B) for 48h
2.4 流式细胞仪检测HuH7细胞系两亚群的细胞周期差异 细胞周期检测结果显示,78.45%的CD13+CD133+HCC细胞处于G0/G1期(图3A),2.19%处于G2/M,19.36%处于S期,G2/G1为2.0。62.18%的CD13-CD133-HCC细胞处于G0/G1期(图3B),11.88%处于G2/M期,25.94%处于S期。
2.5 流式细胞仪检测HuH7细胞系两亚群的分化情况 HuH7细胞系按CD13﹑CD133表达情况分为4个亚群,即CD13+CD133+﹑CD13+CD133-﹑CD13-CD133+和CD13-CD133-HCC细胞,其中以CD13+CD133+HCC亚群居多(图4A)。培养10d后,CD13+CD133+HCC亚群细胞的CD13﹑CD133标志表达与HuH7细胞系相近(图4B),有重建HuH7细胞的趋势;而CD13-CD133-HCC细胞亚群分化后以表达CD133标志为主(图4C),不能完全重建HuH7细胞系的肿瘤状态。

图3 HuH7细胞系两亚群的细胞周期分布Fig.3 The cell cycle of CD13+CD133+HCC cells(A) and CD13-CD133-HCC cells (B)

图4 培养10d后CD13﹑CD133表达情况检测Fig.4 CD13 and CD133 expression 10 days after cultivation
3 讨 论
国内外研究表明,肝癌细胞系(Hep3B﹑HuH7﹑PLC/PRF/5)和肝癌组织中存在CD133+HCC细胞,这部分细胞对5-FU和阿霉素等化疗药物存在抵抗,细胞增殖较CD133-HCC细胞快,干细胞培养条件下具有形成肿瘤球的能力,裸鼠移植能够成瘤,被视为肝CSCs[6-7]。CD13是半休眠的CSCs标志物,具有减轻放化疗后DNA损伤和抗凋亡的作用,在肝癌组织和细胞中均有表达,CD13+HCC主要处于G0/G1期,可形成癌中心细胞克隆[8-9]。
本研究采用CD133﹑CD13标志,从HuH7细胞系分选出CD13+CD133+HCC细胞,占HuH7细胞总数的23.8%,且78.45%的CD13+CD133+HCC细胞处于G0/G1期,2.19%处于G2/M期,19.36%处于S期,G2/G1为2.0,具备CSCs的特征;而62.18%的CD13-CD133-HCC细胞处于G0/G1期,11.88%处于G2/M期,25.95%处于S期。两细胞亚群所处的细胞周期有明显差异。目前国内尚未见采用CD133﹑CD13标志分选肝癌干细胞(liver cancer stem cells,LCSCs)的研究报告。
常规培养CD13+CD133+HCC细胞,可见其增殖明显快于CD13-CD133-HCC细胞,CD13+CD133+HCC细胞多数处于G0/G1期,但增殖曲线显示快速增长,可能与新分选的CD13+CD133+HCC细胞多数处于G0/G1期,在加血清培养后部分LCSCs细胞分化成HCC细胞,部分LCSCs细胞增殖更新,而后者可以分泌HGF等因子促进HCC增殖,重建HuH7细胞系原有的细胞体系等因素有关[10-12],而CD13-CD133-HCC细胞处于G1/G2,有追踪研究显示CD13-CD133-HCC细胞有破碎及凋亡改变[8-9]。
F A C S分选的C D 1 3+C D 1 3 3+H C C和CD 1 3-CD 1 3 3-H CC细胞经过1 0 d培养后,CD13+CD133+HCC亚群的CD13﹑CD133标志表达与HuH7细胞系相近,提示其可分化出其他3个亚群的肝癌细胞,且具有自我更新能力,有重建HuH7细胞的趋势,而CD13-CD133-HCC亚群分化后以CD133标志为主,不能维持或重建HuH7细胞系的肿瘤状态。1×103个CD13+CD133+HCC细胞在裸鼠体内即可成瘤,而CD13-CD133-HCC需要105个细胞才能成瘤,提示前者具有更强的分化成癌细胞及自我更新能力,具有CSCs的特征。CD13+CD133+HCC细胞对5-FU和吡柔比星具有抵抗特性,而CD13-CD133-HCC亚群易于杀灭,CD13+CD133+HCC细胞可减轻放化疗后的DNA损伤并具有抗凋亡作用,提示临床化疗难以彻底杀灭肝CSCs。
分析两种亚群细胞的差异性具有重要的临床意义,CD13+CD133+HCC细胞具有LCSCs的特征,可以称为CD13+CD133+LCSCs,残存CSCs可以形成转移癌灶,是肝癌治疗的靶细胞,这些LCSCs可能是肝癌复发和转移的根源,在临床治疗中应重点杀灭LCSCs,而少量CD13-CD133-HCC细胞易于被化疗药物杀灭。
[1] Tomuleasa C, Soritau O, Rus-Ciuca D, et al. Isolation and characterization of hepatic cancer cells with stem-like properties from hepatocellular carcinoma[J]. J Gastrotestin Liver Dis,2010, 19(1): 61-67.
[2] Terris B, Cavard C, Perret C. EpCAM, a new marker for cancer stem cells in hepatocellular carcinoma[J]. J Hepatol, 2010,52(2): 280-281.
[3] Chen C, Jia KF, Yu CL. The utility of large dosage lipiodol treatment in huge primary hepatic carcinoma[J]. Acta Acad Med CPAF, 2011, 20(6): 449-451. [陈晨, 贾科峰, 于长路. 大剂量碘油治疗原发性巨块型肝癌的疗效分析[J]. 武警医学院学报, 2011, 20(6): 449-451.]
[4] Xu BL, Yuan L, Gao QL, et al. Therapeutic effects of retronectin activated autologous CIK combined IFN-α on advanced hepatocellular carcinoma[J]. J Zhengzhou Univ (Med Sci),2011, 46(5): 694-696. [徐本玲, 袁龙, 高全立, 等. 重组纤维连接蛋白诱导自体CIK联合IFN-α治疗晚期肝癌疗效[J]. 郑州大学学报(医学版), 2011, 46(5): 694-696.]
[5] Bai XF, Wang PY, Wu YJ. Value of combined determination of tumor markers based on two discriminative models in facilitating diagnosis of hepatic carcinoma[J]. Med J Chin PLA, 2012,37(11): 1019-1022. [白雪峰, 王平瑜, 吴拥军. 基于两种判别模式的肿瘤标志物联合检测对肝癌辅助诊断的价值[J]. 解放军医学杂志, 2012, 37(11): 1019-1022.]
[6] Kohga K, Tatsumi T, Takehara T, et al. Expression of CD133 confers malignant potential by regulating metalloproteinases in human hepatocellular carcinoma[J]. J Hepatol, 2010, 52(6);872-879.
[7] Pallini R, Ricci-Vitiani L, Montano N, et al. Expression of the stem cell marker CD133 in recurrent glioblastoma and its value for prognosis[J]. Cancer, 2011, 117(1): 162-174.
[8] Haraguchi N, Ishii H, Mimori K, et al. CD13 is a therapeutic target in human liver cancer stem cells[J]. J Clin Invest, 2010,120(9): 3326-3339.
[9] Christ B, Stock P, Dollinger MM. CD13: Waving the fl eg for a novel cancer stem cell target[J]. Hepatology, 2011, 53(4): 1388-1390.
[10] Meguro M, Mizuguchi T, Kawamoto M, et al. The molecular pathogenesis and clinical implications of hepatocellular carcinoma[J]. Int J Hepatol, 2011, 2011: 818672.
[11] Inagaki Y, Tang W, Zhang L, et al. Novel aminopeptidase N (APN/CD13) inhibitor 24F can suppress invasion of hepatocellular carcinoma cells as well as angiogenesis[J].Bioscience Trends, 2010, 4(2): 56-60.
[12] Ding W, You H, Dang H, et al. Epithelial-to-mesenchymal transition of murine liver tumor cells promotes invasion[J].Hepatology, 2010, 52(3): 945-953.
