PKC/NADPH氧化应激途径对大鼠心脏微血管内皮细胞eNOS脱偶联的影响
2013-08-28成永霞刘贵波冯玉宽郭素芬王宏伟杨向红
成永霞,刘贵波,颜 彬,冯玉宽*,郭素芬,王宏伟,杨向红
(牡丹江医学院1.病理教研室;2.解剖教研室,黑龙江牡丹江157011;3.中国医科大学附属盛京医院病理科,辽宁沈阳100011)
现在的观点认为,组织中氧化应激的爆发是内皮型一氧化氮合酶 (endothelial NO synthese,eNOS)脱偶联发生的最主要原因[1]。关于其具体机制,有研究者认为依赖蛋白激酶C(protein kinase C,PKC)的烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶激活在介导糖尿病患者内皮细胞氧化应激发生和并发症形成中起重要作用[2]。糖基化终末产物 (advanced glycaton end products,AGEs)可以通过糖基化终末产物受体 (receptor for AGE,RAGE)激活PKC,从而使肾脏微血管内皮细胞内的NADPH氧化酶表达增加[3]。而NADPH氧化酶使细胞内活性氧 (reactive oxygen species,ROS)增加,ROS又能导致eNOS脱偶联的发生,进而引起内皮细胞功能紊乱[4]。
然而,糖尿病性心肌病作为一种心脏微血管病变,AGEs是否引起心脏微血管内皮细胞内的ROS产生增加从而引起eNOS脱偶联及其分子机制仍然不清晰。以往的实验研究采用大血管内皮细胞功能紊乱来阐述糖尿病心肌病的发病机制,这种准确性尚存在质疑。因此,本实验将心脏微血管内皮细胞作为研究主体,观察PKC/NADPH氧化应激途径在其中的作用。
1 材料与方法
1.1 实验材料
清洁级 Wistar大鼠,2~3周龄(体质量20~30 g),雌雄不限,由中国医科大学动物部提供(合格证:SCXKR12008-0005)。
1.2 实验试剂和药物
DMEM培养基(Gibco公司);肝素、HEPES、Ⅱ型胶原酶和 BSA(Sigma公司);兔抗大鼠vWF抗体、兔抗大鼠eNOS多克隆抗体和荧光二抗(Santa Cruz公司);NO及O2-产生检测试剂盒(南京建成生物试剂公司)。
1.3 心脏微血管内皮细胞的培养
剪去左、右心房及右心室,剖开左心室,去除心脏外1/4层,Ⅱ型胶原酶与胰蛋白酶37℃消化1 h,孵育箱内培养,隔天换液。
1.4 BSA-AGEs的制备[3]
20 g/L BSA与500 mmol/L葡萄糖溶于pH 7.4的PBS中混匀,并加入终浓度为0.5 mmol/L的EDTA,滤器过滤,避光孵育90 d,荧光光谱扫描检测。
1.5 实验分组
对照组、AGEs 100 mg/L+DPI(2.5、5 和10 μmol/L)组和 AGEs 100 mg/L+LY33531(2.5、5和10 μmol/L)组。对照组加无血清培养液培养。
1.6 NO及O2-测定
按照实验分组加入刺激因素孵育,收集上清液备测定NO和O2-。具体步骤按照试剂盒说明书操作,721分光光度计测定各组吸光度。
1.7 免疫细胞化学法测定eNOS
实验操作参照S-P法,具体步骤略。实验结果采用灰度扫描值A value表示。
1.8 HPLC法测定BH4
将培养细胞中放入300 μL预冷的提取液,离心后收集上清加入等体积比的1.5 mol/L HClO4和2 mol/L H3PO4析出蛋白,离心弃去蛋白,取上清。分别在酸性条件和碱性条件下氧化,离心收集上清。分别对酸性条件下氧化和碱性条件下氧化的标本进行测定。酸性条件下氧化的标本检测出总生物喋呤包括BH4、BH2(二氢生物喋呤)和B(氧化型生物喋呤);在碱性条件下氧化的标本可以检测BH2和B。将BH2和B从总生物喋呤中除去即BH4含量。
1.9 2,7二氯荧光黄双乙酸盐(DCFH-DA)荧光染色检测ROS
DCFH-DA本身没有荧光,但可以自由穿过细胞膜,进入细胞内后,细胞内的ROS可以氧化无荧光的DCFH生成有荧光的DCF。用无血清的培养基清洗细胞两次,再加入 DCFH-DA(1∶1 000稀释),37℃孵育箱中孵育20 min后胰蛋白酶消化,1 mL无血清的培养基重悬细胞,荧光显微镜观察细胞内ROS的荧光强度。
1.10 Western blot 测定P47phox
具体步骤略。实验结果采用 eNOS/β-actin%表示。
1.11 统计学分析
2 结果
2.1 心脏微血管内皮细胞的形态
贴壁细胞以大小相对均一的梭形细胞为主。细胞多呈集落生长,7 d后汇合成内皮细胞单层,呈典型的铺路石样形态(图1)。

图1 大鼠心脏微血管内皮细胞原代培养Fig 1 The primary culture of cardiac microvascular endothelial cells(×200)
2.2 NADPH氧化酶抑制剂-DPI对AGEs引发的心脏微血管内皮细胞eNOS脱偶联的影响
2.2.1 DPI对AGEs引发心脏微血管内皮细胞NO和O2-变化的影响:心脏微血管内皮细胞用NADPH氧化酶抑制剂-DPI(2.5、5 和10 μmol/L)作用30 min后,加入 AGEs(100 mg/L)再孵育24 h,无血清培养基处理组做空白对照,观察各组NO、O2-生成的变化。AGEs组较空白组NO明显降低(P<0.05),而O2-生成明显增加(P<0.05)。随着DPI浓度的增加,NO生成逐渐增加(P<0.05),而O-2生成逐渐减少(P<0.05)(表1)。
DPI对AGEs引发心脏微血管内皮细胞eNOS变化的影响:AGEs组eNOS表达较空白组明显增高(P<0.05)。随着 DPI浓度增加(2.5、5和10 μmol/L),eNOS 表达较 AGEs组逐渐减少(图 2,表1)。
2.2.3 DPI对AGEs引发心脏微血管内皮细胞BH4含量变化的影响:AGEs组较空白组BH4含量明显降低(P <0.01)。应用 DPI(2.5、5 和10 μmol/L)后,而BH4随着 DPI浓度增加而逐渐增加(P<0.01)(表1)。
2.3 DPI对AGEs引发心脏微血管内皮细胞内ROS变化的影响
AGEs组较空白组 ROS表达明显增加(P<0.05)。随着DPI浓度的增加,ROS表达逐渐减少(P<0.05)(表1)。
2.4 PKC特异性抑制剂-LY33531对AGEs引发的心脏微血管内皮细胞eNOS脱偶联的影响
2.4.1 LY33531对AGEs引发心脏微血管内皮细胞NO和O2-变化的影响:心脏微血管内皮细胞用PKC 特异性抑制剂-LY33531(2.5、5和10 μmol/L)分别作用30 min后,加入AGEs(100 mg/L)再孵育24 h,无血清培养基处理组做空白对照。AGEs组生成NO较空白组减少(P<0.05),而O2-生成明显增加(P<0.05)。随着LY33531浓度的增加,NO生成逐渐增加(P<0.05),而O2-生成逐渐减少(P<0.05)(表2)。
表1 DPI 对AGEs引发心脏微血管内皮细胞NO2-/NO3-,O2-,eNOS,ROS,BH4,变化的影响Table 1 Effects of AGEs and DPI on NO2-/NO3-,O2-,eNOS,BH4,generation in cardiac microvascular endothelial cells(,n=3)

表1 DPI 对AGEs引发心脏微血管内皮细胞NO2-/NO3-,O2-,eNOS,ROS,BH4,变化的影响Table 1 Effects of AGEs and DPI on NO2-/NO3-,O2-,eNOS,BH4,generation in cardiac microvascular endothelial cells(,n=3)
*P <0.05 compaired with control;#P <0.05 compaired with AGEs.
ROS control 167.0±0.3 121.0±2.3 108.0±2.7 group NO2-/NO3- O2- eNOS BH4 537.0±0.1 40.0±0.6 AGEs 100 mg/L 91.0±0.3* 180.0±0.4* 126.0±3.5* 214.0±0.1* 61.0±0.8*DPI 2.5 μmol/L 100.0±0.7 167.0±0.6 123.0±2.8* 299.0±0.1* 49.0±0.5 5 μmol/L 154.0±0.3 131.0±0.6 118.0±1.4 409.0±0.1# 47.0±0.6 10 μmol/L 161.0±0.6# 126.0±0.7# 114.0±1.8 481.0±0.1# 43.0±0.6#
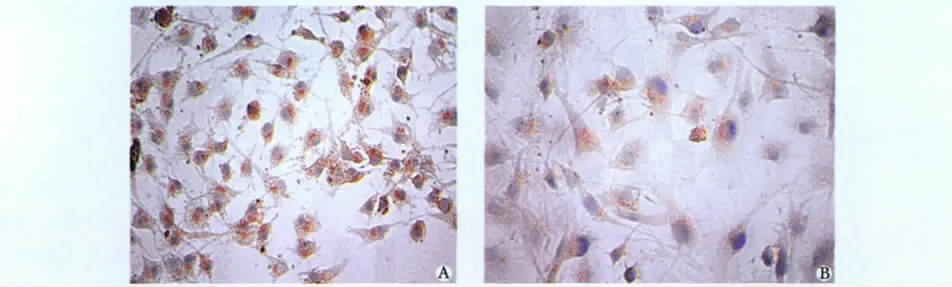
图2 AGEs和DPI对心脏微血管内皮细胞eNOS表达的影响Fig 2 Effects of AGEs and DPI on eNOS protein expression in cardiac microvascular endothelial cells
表2 LY33531对AGEs引发心脏微血管内皮细胞NO2-/NO3-,O2-,eNOS,BH4,变化的影响Table 2 Effects of AGEs and LY33531on NO2-/NO3-,O2-,eNOS,BH4,generation in cardiac microvascular endothelial cells ± s,n=3)

表2 LY33531对AGEs引发心脏微血管内皮细胞NO2-/NO3-,O2-,eNOS,BH4,变化的影响Table 2 Effects of AGEs and LY33531on NO2-/NO3-,O2-,eNOS,BH4,generation in cardiac microvascular endothelial cells ± s,n=3)
**P<0.05,与对照组相比较;#P <0.05,与 AGEs组比较;*P <0.05 compaired with control;#P <0.05 compaired with AGEs.
group NO2-/NO- O2- eNOS BH4 control 167.0±0.3 121.0±2.3 107.0±2.7 536.0±0.1 AGEs 100 mg/L 121.0±2.3 179.0±0.4* 126.0±3.5* 214.0±0.1#LY33531 2.5 μmol/L 107.0±2.7 160.0±0.6 124.0±5.7 285.0±0.1*5 μmol/L 536.0±0.1 128.0±0.5 120.0±2.4 378.0±0.2#10 μmol/L 123.0±0.3# 126.0±0.6# 113.0±1.7# 435.0±0.1#
2.4.2 LY33531对AGEs引发心脏微血管内皮细胞eNOS表达变化的影响:观察到AGEs组eNOS表达较空白组明显增高(P<0.05)。应用LY33531(2.5、5 和10 μmol/L)后,eNOS 表达较 AGEs组逐渐减少(P<0.05)(表2)。
2.4.3 LY33531对AGEs引发的心脏微血管内皮细胞BH4含量变化的影响:AGEs组BH4较空白组明显降低,差异显著(P<0.01)。应用 LY33531(2.5、5 和10 μmol/L)后,BH4随着 LY33531 浓度增加而增加,差异显著(P<0.01)(表2)。
2.5 LY33531对AGEs引发心脏微血管内皮细胞NADPH氧化酶亚基-P47phox表达、ROS生成变化的影响
2.5.1 LY33531对AGEs引发心脏微血管内皮细胞ROS生成变化的影响:AGEs组内ROS生成较空白组明显增加(P<0.05)。应用LY33531(2.5、5和10 μmol/L)后,ROS逐渐降低 (P<0.01)(图3)。
2.5.2 LY33531对AGEs引发心脏微血管内皮细胞P47phox表达变化的影响:P47phox蛋白表达在AGEs组较空白组明显增加(P<0.05),随着LY33531浓度的增加P47phox减少(P<0.05)(图4)。
3 讨论
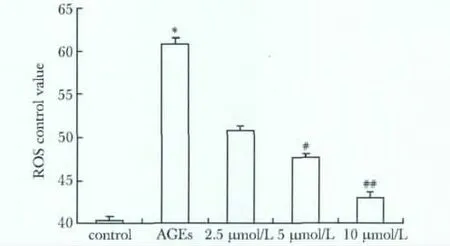
图3 AGEs和LY33531对心脏微血管内皮细胞ROS表达的影响Fig 3 Effects of AGEs and LY33531 on ROS expression in cardiac microvascular endothelial cells
生理及病理情况下,血管平滑肌细胞和内皮细胞产生ROS的主要来源是NADPH氧化酶[5]。在糖尿病动物模型和患者的血管、视网膜和肾脏的组织中,均发现ROS的增高伴随着NADPH氧化酶的活性上调和P47phox亚基的高表达[6-7]。本实验结果也发现AGEs(100 mg/L)作用24 h后,P47phox表达和ROS生成均较空白组有明显升高,同时出现NO生成减少、eNOS表达增加、O2-生成增加和BH4含量减少等eNOS脱偶联表现。实验中应用NADPH氧化酶抑制剂-DPI后,P47phox表达和ROS生成均减少,而eNOS脱偶联表现得到改善。这就可以也证明AGEs引发的以ROS增高为特征的氧化应激是心脏微血管内皮细胞eNOS脱偶联的主要原因,并且NADPH氧化酶在其中发挥重要作用。
高糖激活的NADPH氧化酶主要是依赖PKC的激活[8-9],研究认为中性粒细胞中的 NADPH氧化酶的亚型P47phox的激活必须依赖PKC的激活[9]。本实验应用 PKC抑制剂-LY33531后,观察到P47phox表达和ROS生成均减少,同时eNOS脱偶联表现也得到改善。提示NADPH氧化酶的表达增加是依赖PKC的,同时根据实验结果可知AGEs激活了心脏微血管内皮细胞内PKC/NADPH氧化应激途径。
综合以上结果,提示在心脏微血管内皮细胞内,AGEs引发的PKC/NADPH氧化应激途径是eNOS脱偶联发生的重要原因,而这种氧化应激和eNOS脱偶联导致了NO生物利用度的减少,从而发生内皮依赖性舒张功能紊乱,可能导致糖尿病性心肌病的发生,并成为其重要发病机制。
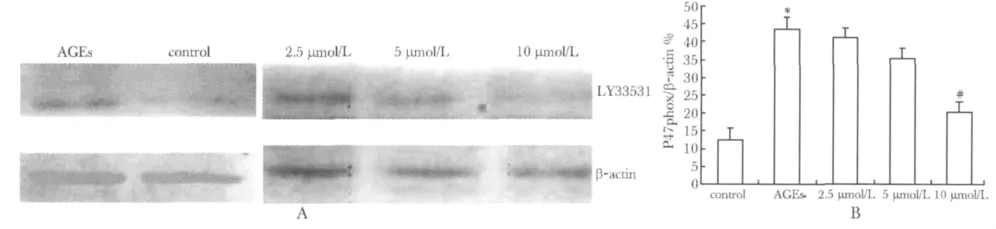
图4 AGEs和LY33531对心脏微血管内皮细胞P47phox蛋白表达的影响Fig 4 Effects of AGEs and LY33531 on P47phox expression in cardiac microvascular endothelial cells
[1]Dikalova AE,Góngora MC,Harrison DG,et al.Upregulation of Nox1 in vascular smooth muscle leads to impaired endothelium-dependent relaxation via eNOS uncoupling[J].Am J Physiol Heart Circ Physiol,2010,299:673 -679.
[2]Antoniades C,Shirodaria C,Leeson P,et al.Association of plasma asymmetrical dimethylarginine(ADMA)with elevated vascular superoxide production and endothelial nitric oxide synthase uncoupling:implications for endothelial function in human atherosclerosis[J].Eur Heart J,2009,30:1142-1150.
[3]Warboys CM,Toh HB,Fraser P.Advanced glycation end products rapidly increase retinal microvascular permeability via RAGE activation of NADPH oxidase[J].Invest ophthalmol vis sci,2009,50:1319 -1328.
[4]Xia N,Daiber A,Habermeier A,et al.Resveratrol reverses endothelial nitric-oxide synthase uncoupling in apolipoprotein E knockout mice[J].J Pharmacol Exp Ther,2010,335:149 -154.
[5]Muller G,Morawietz H.Nitric oxide,NAD(P)H oxidase,and atherosclerosis[J].Antioxid Redox Signal,2009,11:1711-1731.
[6] Wautier M-P,Chappey O,Corda S,et al.Activation of NAD(P)H oxidase by AGE links oxidant stress to altered gene expression via RAGE[J].Am J Physiol Endocrinol Metab,2001,280:685 -694.
[7]Ray R,Shah AM.NADPH oxidase and endothelial cell function[J].Clin Sci,2005,109:217 - 226.
[8]Srivastava AK.High glucose-induced activation of protein kinase signaling path-ways in vascular smooth muscle cells:a potential role in the pathogenesis of vascular dysfunction in diabetes[J].Int J Mol Med,2002,9:85 -89.
[9]Inoguchi T,Li P,Umeda F,et al.High glucose level and free fatty acid stimulate reactive oxygen species production through protein kinase C-dependent activation of NAD(P)H oxidase in cultured vascular cells[J].Diabetes,2000,49:1939-1945.
