短期高脂喂养诱导脂肪肝的肝胰岛素敏感性和炎性因子变化
2013-08-28任路平胡志娟宋光耀陈树春魏立民
任路平,胡志娟,宋光耀*,陈树春,魏立民
(河北省人民医院1.内分泌一科;2.肾内科,河北石家庄050051)
非酒精性脂肪肝(non-alcholic fatty liver disease,NAFLD)的发生发展与胰岛素抵抗(insulin resistance,IR)密切相关。脂肪肝和IR的发生发展均与两条重要的炎性反应通路相关[1-2],一条通路是c-Jun氨基末端激酶(JNK)途径,另一条炎性反应通路是 I kappa B 激酶 α/β(IKK-α/β)-核因子 κB(NF-κB)途径,目前关于脂肪肝发生早期炎性反应通路的改变的相关研究尚少。既往的研究表明,短期高脂喂养后即可诱导啮齿类动物发生肝内脂质沉积[3],本实验通过3 d高脂喂养诱导小鼠肝脏脂质沉积,检测高脂饮食诱导脂肪肝出现早期时肝胰岛素敏感性和炎性反应通路的变化,从而探讨高脂喂养诱导脂肪肝的发生机制及其与肝IR的关系。
1 材料与方法
1.1 材料
1.1.1 实验动物:清洁级雄性C57BL/J6小鼠(体质量25~27 g)(北京华阜康生物科技股份有限公司,合格证号0225653)分为对照组及高脂组。对照组进食普通饲料;高脂组脂类占总热量59%,其中脂类主要由猪油(主要成分为棕榈酸)提供;2组每日进食热量基本相等,喂养3 d后行相关指标测定并处死小鼠,留取组织。
1.1.2 试剂:兔抗鼠 p-Akt、t-Akt、p-GSK-3α/β、t-GSK-3α/β、 p-JNK (Thr183/Tyr185)、 t-JNK、p-IKKα/β、IKKα/β 和 NF-κB 抗体(Cell Signaling公司),内参抗体Pan14-3-3(ABCAM公司)。
1.2 检测指标及方法
1.2.1 血液学指标检测:空腹血糖(FBG)用葡萄糖氧化酶法测定,血三酰甘油(TG)和谷丙转氨酶在全自动生化分析仪(Beckman X20)测定。
1.2.2 肝脏TG测定:取肝脏组织30 mg经氯仿/甲醇抽提TG后,加入0.6%氯化钠分离水相和有机相,吸取有机相待干燥后溶于100%乙醇500 μL,应用GPO-PAP试剂盒测定TG含量(Boehringer Mannheim,Mannheim Germany)。1.2.3 肝胰岛素敏感性评估:于喂养3 d后每组随机取12只小鼠,禁食10 h过夜,每组小鼠随机选取6只小鼠注射0.9%氯化钠注射液,另向6只小鼠腹腔内注射含有葡萄糖(3 g/kg BW)、胰岛素(2 U/kg.BW)的混合溶液,于注射后40 min处死小鼠,其后留取肝脏组织,冻存于-70℃[4]。应用本研究1.2.4所述Western blot方法测定前述胰岛素葡萄糖混合溶液注射后40 min小鼠肝脏组织的两个重要胰岛素信号传导因子Akt和GSK-3α/β总蛋白和磷酸化蛋白的表达。通过比较各组注射与未注射胰岛素溶液的小鼠 p-Akt/t-Akt和 p-GSK-3α/β/t-GSK-3α/β表达变化评估胰岛素敏感性,比值减少代表肝细胞内胰岛素信号传导通路蛋白 Akt和GSK-3α/β的磷酸化减少,提示肝脏胰岛素敏感性下降。
1.2.4 Western blot方法检测蛋白表达:肝脏组织匀浆中加入10倍裂解液,13 000 r/min离心15 min,取上清用BCA法测蛋白含量。取25 μg蛋白进行9%聚丙烯凝胶电泳,电转移至硝酸纤维素膜,5%脱脂奶粉室温封闭45 min后,加入1∶1 000稀释的抗体,室温孵育2 h,TTBS缓冲液洗膜后加入1∶10 000稀释的辣根过氧化物酶标记的山羊抗兔抗体,室温孵育1 h,最后用ECL化学发光法检测,经X胶片曝光显影。用IMAGEJ软件分析,其中NF-κB以目的蛋白的吸光度值除以内参Pan14-3-3的吸光度值以校正误差,所得结果代表某样品的目的蛋白相对含量。每组选6例样本进行蛋白表达分析。
1.3 统计学分析
在SPSS11.0软件上进行数据分析。数据用均数±标准差表示。组间数据进行单因素方差分析。
2 结果
2.1 喂养3 d后两组小鼠指标检测结果
高脂组小鼠肝脏TG水平显著高于对照组(P<0.01)(表1)。
表1 两组小鼠喂养3 d后的资料Table 1 Comparison of parameters in 2 groups after 3-day feeding

表1 两组小鼠喂养3 d后的资料Table 1 Comparison of parameters in 2 groups after 3-day feeding
*P < 0.01 compared with control.
group n body weight(g) FBG(mmol/L)plasma TG(mmol/L)serum ALT(IU/L) liver weight(g) liver TG content(μmol/g)control 20 26.0±0.2 6.1±0.2 1.09±0.02 36.2±3.8 0.99±0.08 11.03±0.29 HF 19 26.2±0.3 6.2±0.3 1.11±0.04 36.4±5.1 1.02±0.19 24.92±2.98*
2.2 肝脏胰岛素敏感性评估
胰岛素注射40 min后,高脂组 p-Akt/t-Akt和p-GSK-3α/β/t-GSK-3α/β 的比值显著少于对照组(P <0.01)(图1,表2)。
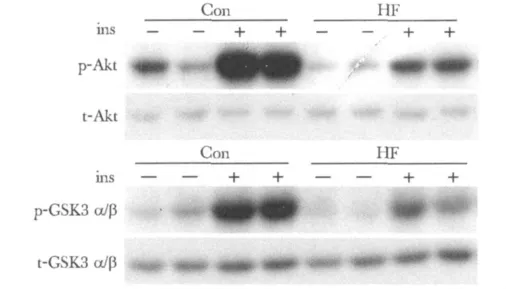
图1 胰岛素刺激后小鼠肝脏Akt和GSK-3α/β的磷酸化变化Fig 1 The change in phosphorylation of Akt and GSK-3 α/β in mice liver after insulin stimulation
表2 胰岛素刺激后小鼠肝脏p-Akt/t-Akt和p-GSK3 β/t-GSK3β蛋白表达Table 2 Semi-quantitative data of protein expressions of p-Akt/t-Akt and p-GSK3β/t-GSK3β in liver after insulin stimulation,n=6)
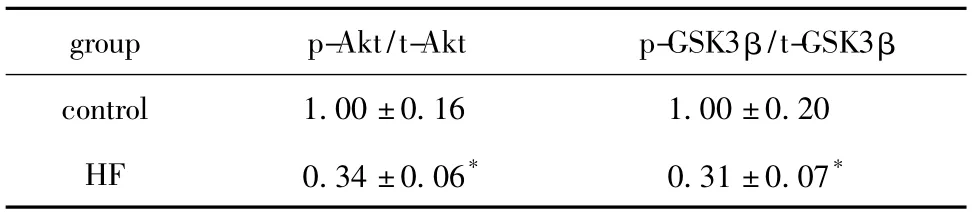
表2 胰岛素刺激后小鼠肝脏p-Akt/t-Akt和p-GSK3 β/t-GSK3β蛋白表达Table 2 Semi-quantitative data of protein expressions of p-Akt/t-Akt and p-GSK3β/t-GSK3β in liver after insulin stimulation,n=6)
*P <0.01 compared with control;Data were represented as fold change.
group p-Akt/t-Akt p-GSK3β/t-GSK3β control 1.00±0.16 1.00±0.20 HF 0.34±0.06* 0.31±0.07*
2.3 小鼠肝脏炎性反应通路标志物蛋白表达变化
高脂组小鼠肝脏的磷酸化JNK显著高于对照组(p-JNK/tJNK)(P <0.01)(图2,表3)。
3 讨论
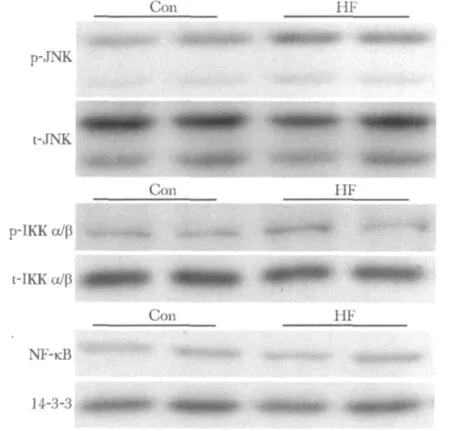
图2 两组小鼠肝脏两条炎性反应通路标志物蛋白表达变化Fig 2 Protein expression changes in markers of two inflammatory pathways in liver in 2 groups
表3 两组小鼠肝脏两条炎性反应通路标志物蛋白表达变化Table 3 Semi-quantitative data of protein expressions in markers of two inflammatory pathways in liver in 2 groups,n=6)

表3 两组小鼠肝脏两条炎性反应通路标志物蛋白表达变化Table 3 Semi-quantitative data of protein expressions in markers of two inflammatory pathways in liver in 2 groups,n=6)
*P <0.01 compared with control;Data were represented as fold change.
group p-JNK/t-JNK p-IKKα/β/t-IKKα/β NF-κB/Pan14-3-3 1.05±0.13 1.02±0.12 control 1.00±0.11 1.00±0.18 1.00±0.16 HF 1.59±0.13*
研究表明,NAFLD的发生发展和 IR密切相关[5]。本研究首先证明了3 d高脂喂养即可引起小鼠肝脏脂质沉积,表明肝脏对外源脂质过量摄入具有非常迅速的反应。造模成功后,进一步评价了高脂喂养小鼠肝脏的胰岛素敏感性。本研究选用胰岛素信号通路中的蛋白激酶B(PKB/亦称为Akt)和糖原合成激酶-3α/β(GSK-3α/β)作为评价小鼠肝脏胰岛素敏感性的指标[6],经胰岛素注射40 min后,高脂喂养小鼠的肝脏胰岛素信号通路的下游因子Akt和GSK-3α/β的磷酸化蛋白表达较对照组显著降低,提示3 d高脂喂养小鼠出现了肝脏IR。肝TG沉积与肝脏IR并行出现,提示脂肪肝和肝IR密切相关。
两条主要炎性反应通路的标志物——JNK途径(磷酸化-JNK/总 JNK)和 IKKα/β-NF-κB(磷酸化-IKKα/β/总 IKKα/β,总-IκBα)途径均与 NAFLD 和IR的发生发展密切相关。JNK通路在IR的发生发展中发挥核心的介导作用,通过对IRS-1和IRS-2的丝氨酸磷酸化抑制胰岛素信号传导[7];JNK通路也被证明与NAFLD的发生发展有关[7-9],研究表明JNK介导了慢性高脂喂养小鼠脂肪肝的发展[10],但是尚缺乏脂肪肝发生早期JNK通路变化的研究,本研究提示高脂喂养3d诱导的小鼠肝内p-JNK蛋白表达增加,提示JNK通路激活介导了高脂喂养诱导的脂肪肝和肝IR早期的发生发展。
IKK-α/β-NF-κB 途径是另一个非常重要的介导IR和脂肪肝发生发展的途径[11]。慢性高脂喂养小鼠出现脂肪肝的同时,IKK-α/β和 NF-κB激活,NF-κB炎性反应通路的特异性抑制可改善脂肪肝[12-13]。本研究提示,高脂喂养3 d后,小鼠肝脏内NF-κB通路未激活,提示此通路没有介导高脂饮食诱导的 NAFLD和 IR的早期发生,而可能是在NAFLD进展的过程中发生并促进了其进一步的病理生理改变。
综上所述,高脂饮食喂养3 d即可诱导小鼠肝脏脂质沉积和肝IR,并伴有JNK通路激活,提示JNK通路介导了短期高脂饮食诱导的脂肪肝和肝IR的发生,具体机制需进一步深入研究。
[1]Hotamisligil GS.Inflammation and metabolic disorders[J].Nature,2006,444:860-867.
[2]Kodama Y,Brenner DA.c-Jun N-terminal kinase signaling in the pathogenesis of nonalcoholic fatty liver disease:Multiple roles in multiple steps[J].Hepatology,2009,49:6 -8.
[3] Moore JB.Non-alcoholic fatty liver disease:the hepatic consequence of obesity and the metabolic syndrome[J].Proc Nutr Soc,2010,69:211 -220.
[4]Ozcan U,Yilmaz E,Ozcan L,et al.Chemical chaperones reduce ER stress and restore glucose homeostasis in a mouse model of type 2 diabetes[J].Science,2006,313:1137 -1140.
[5]Day CP,James OF.Steatohepatitis:a tale of two“hits”?[J].Gastroenterology,1998,114:842 -845.
[6]Leng S,Zhang W,Zheng Y,et al.Glycogen synthase kinase 3 beta mediates high glucose-induced ubiquitination and proteasome degradation of insulin receptor substrate 1[J].J Endocrinol,2010,206:171 -181.
[7]Hirosumi J,Tuncman G,Chang L,et al.A central role for JNK in obesity and insulin resistance[J].Nature,2002,420:333-336.
[8]Kodama Y,Brenner DA.c-Jun N-terminal kinase signaling in the pathogenesis of nonalcoholic fatty liver disease:Multiple roles in multiple steps[J].Hepatology,2009,49:6-8.
[9]Tilg H,Moschen AR.Inflammatory mechanisms in the regulation of insulin resistance[J].Mol Med,2008,14:222-231.
[10]Schattenberg JM,Singh R,Wang Y,et al.JNK1 but not JNK2 promotes the development of steatohepatitis in mice[J].Hepatology,2006,43:163-172.
[11]Luedde T,Schwabe RF.NF-kappaB in the liver-linking injury,fibrosis and hepatocellular carcinoma[J].Nat Rev Gastroenterol Hepatol,2011,8:108 -118.
[12]Cai D,Yuan M,Frantz DF,et al.Local and systemic insulin resistance resulting from hepatic activation of IKK-beta and NF-kappaB[J].Nat Med,2005,11:183 -190.
[13]Boden G,She P,Mozzoli M,et al.Free fatty acids produce insulin resistance and activate the proinflammatory nuclear factor-kappaB pathway in rat liver[J].Diabetes,2005,54:3458-3465.
