GATA-4过表达增加大鼠骨髓间充质干细胞分化为心肌细胞
2013-08-28李红霞周亚峰杨向军蒋文平
李红霞,周亚峰,杨向军,蒋文平
(苏州大学附属第一医院心内科,江苏苏州215006)
细胞移植治疗为不可逆性心脏疾病提供了全新的治疗策略,骨髓间充质干细胞(bone marrow mesenchymal stem cells,MSCs)由于其高度的扩增能力和向心肌细胞分化的潜能,成为治疗各种不可逆性心脏疾病的一个全新的选择[1]。研究发现,MSCs通过5-氮胞苷诱导或心肌细胞共培养等方法均可分化为心肌样细胞[2-3],但其心肌细胞分化率低。GATA-4是GATA锌指蛋白转录因子家族中一员,该因子是心脏前体细胞的最早期标志之一,是心脏细胞分化、发育过程中的重要转录因子。研究发现,GATA-4可以促进P19胚胎癌性细胞系向心肌分化[4]。最近报道也显示,转染了Wnt11真核表达质粒的MSCs(MSCWnt11)与心肌细胞(CM)共培养后,能显著促进MSCs向心肌分化;而用GATA-4-siRNA敲除MSCWnt11中GATA-4的活性后,心肌分化明显降低[5]。可见GATA-4对于MSCs的心肌分化起着至关重要的作用。
本实验将GATA-4基因转染MSCs或与CM共培养两种方法进行体外诱导,观察GATA-4基因转染MSCs后分化为心肌细胞及表达心肌细胞特异性标记物BNP、Islet-1和α-actinin的能力,为今后进一步研究MSCs分化的机制以及应用于临床移植治疗急性心肌梗死等心肌疾病提供充分的理论依据和技术手段。
1 材料与方法
1.1 材料与动物
清洁级Sprague-Dawley(SD)大鼠,体质量180~200 g,雌雄不限,由苏州大学试验动物中心提供(合格证号:syxk苏 2007-0035),用于分离培养MSCs。同种新生1~3 d乳鼠,用于分离和培养CM。胰蛋白酶、IMDM培养基、DMEM培养基、胎牛血清 (Gibco公司),兔抗 GATA-4多克隆抗体和anti-brain natriuretic peptide(BNP)抗体(Abcam公司),小鼠抗α-actinin单克隆抗体和小鼠抗Islet-1单克隆抗体 (Santa Cruz公司),抗 β-actin(Cell Signaling公司);Fugene6转染试剂盒(Roche公司),原代心肌细胞分离试剂盒(Washington公司)。核蛋白提取试剂盒 (Thermo Scientific公司)。常规生化试剂为国产或进口分析纯产品。
1.2 方法
1.2.1 MSCs体外分离、培养及纯化:参考文献[6]。即无菌条件下,用含20%FBS的IMDM从大鼠股骨和胫骨髓腔中冲洗骨髓细胞,离心、弃上清得细胞沉淀。在细胞沉淀中加入20%胎牛血清、100 U/mL青霉素和100 mg/L链霉素的IMDM,接种并置37℃、5%CO2饱和湿度的CO2孵箱内培养,两天后换液,弃掉未贴壁造血细胞,以后每3~4天更换培养基1次,细胞达80%汇合后胰蛋白酶消化,1∶3传代扩增纯化。3~5代细胞用于实验。用流式细胞仪检测CD90(干细胞表面标志)和CD45(白细胞分化抗原)的表达。
1.2.2 新生大鼠CM培养及纯化:使用Washington心肌细胞分离试剂盒,按照说明书操作。简言之,无菌条件下取出1~3 d大鼠心脏,取心室并剪碎,加入胰蛋白酶消化,4℃过夜。次日加胰蛋白酶抑制剂终止消化,然后加胶原蛋白酶,于振荡器上37℃振荡40 min,收集细胞沉淀,然后接种于含10%胎牛血清、100 U/mL青霉素和100 mg/L链霉素的DMEM中。培养2 h后,将悬浮细胞重新接种、培养,次日换液。
1.2.3 GATA-4基因转染 MSCs:GFP(对照)、GATA4-GFP质粒为本实验前期构建于反转录表达系统 (pMSCV)。参考方法[7],用Fugene6转染试剂盒(Roche公司)按照说明书转染包装细胞GP2-293,收集培养上清;用无菌、0.45 μm醋酸纤维素滤器过滤,替换MSCs的培养基,加入聚凝胺10 mg/L提高转染率。转染后的MSCs加入嘌呤霉素来筛选阳性细胞。荧光显微镜下观察GFP绿色荧光。对照组为只转染GFP没有目的基因的空质粒细胞(MSCNull),MSCGATA-4转染组为转染GFP和GATA-4的细胞。
1.2.4 GATA-4基因在MSC中表达及鉴定:通过Real-time PCR、Western blot和免疫荧光组织化学分析检测GATA-4的表达
Real-time PCR测定GATA-4的mRNA表达:用Trizol试剂从培养的 MSCNull和 MSCGATA-4提取总RNA,酶标仪定量。将相等量的RNA样品反转录cDNA,再经定量 PCR扩增。反应体系共25 μL:cDNA 1 μL,上下游引物各0.5 μL,dNTP 1 μL,Taq DNA 聚合酶0.5 μL,MgCl2缓冲液2.5 μL,SYBR Green 2 μL和 ddH2O 17 μL。反应条件:变性95 ℃、15 min;扩增 45 个循环94℃、15 s,55℃、30 s,72℃、15 s;熔解曲线72℃至95℃、0.1℃/s。经分析系统进行相关表达的定量,引物序列见表1。
Western blot测定GATA-4蛋白的表达:收集培养MSCNull和MSCGATA-4细胞,按照试剂盒说明书提取核蛋白。相等量核蛋白60 μg行12%丙烯酰胺凝胶电泳,5%脱脂牛奶室温封闭1 h,一抗4℃封闭过夜,HRP标记二抗室温封闭2 h。洗膜后用ECL试剂盒(GE Healthcare)发光,吸光度分析法定量。
免疫荧光组织化学分析:预先培养细胞在玻片上,PBS洗1次,甲醛溶液固定细胞15 min;清洗2次;丙酮处理细胞10 min,洗3次。10%血清室温封闭细胞30 min。加封闭液配置的抗GATA-4的一抗(1∶50)70 μL,37 ℃ 湿盒孵育1 h;洗 3 次。加封闭液配置的二抗100 μL,37℃湿盒孵育1 h;洗4次,风干。滴加含DAPI的荧光增强剂后封片,荧光显微镜下观察摄像。
1.2.5 MSC与CM体外共培养实验:采用嵌套式共培养[2]:CM 接种在孔径为3 μm聚碳酸酯膜分开的Transwell®嵌套培养皿的上层,而MSCs接种于下层。Ⅰ组:MSCNull与CM共培养组(对照组);Ⅱ组:MSCGATA-4与 CM共培养组。分别消化 MSCNull与MSCGATA-4,吹打成细胞悬液,按1×105个/mL接种于6孔板;与培养第3天的CM按细胞数量1∶2混匀,进行共培养。共培养1周后,收集下层MSC,提取总RNA和总蛋白,分别做实时定量PCR和Western blot分析,检测不同组MSC的心肌特异蛋白BNP、Islet-1和α-actinin的mRNA和蛋白的表达,从而鉴定MSCGATA-4心肌分化能力。Real-time PCR和Western blot的方法同上,引物序列见表1。
采用混合共培养[2]:MSC和CM按细胞数量1∶10混合共培养,Ⅰ组:MSCNull与 CM共培养组(对照组);II组:MSCGATA-4与CM共培养组。混合共培养1周后,用荧光显微镜下观察MSCs,并用免疫组化检测α-actinin的表达。另外用0.25%的胰蛋白酶消化收集细胞,制成含有1.0×106个/mL MSCs的单细胞悬液,用流式细胞仪检测α-actinin的阳性率,从而检测GATA-4对MSCs的心肌分化率的影响。
1.3 统计学分析
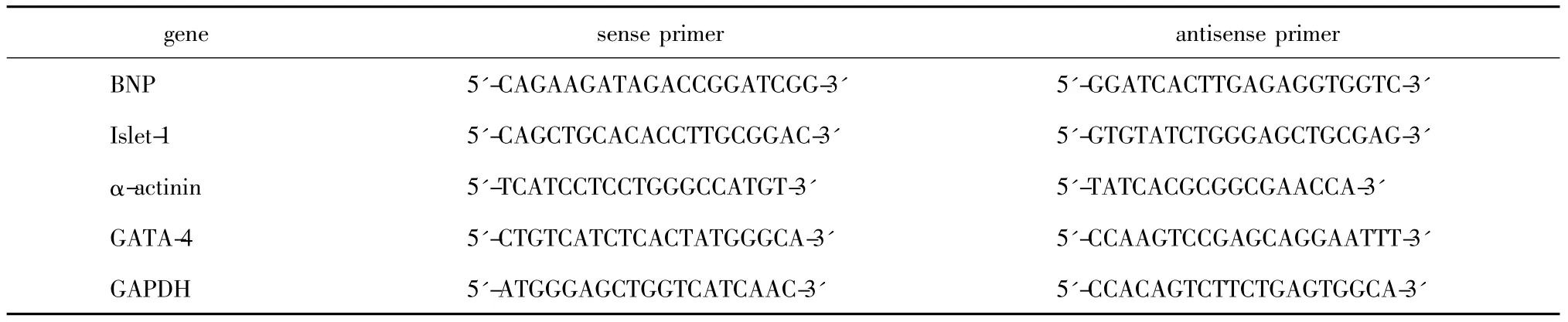
表1 引物的序列Table 1 The sequence of primers
2 结果
2.1 乳鼠心肌细胞的一般特征
心肌细胞在分离培养后4~6 h贴壁生长,相互有伪足交联,但不融合。20 h后可见单个细胞的搏动,搏动频率 42~78 beat/min。至72 h时,可见细胞伸出伪足交织成网,形成细胞簇,呈放射排列的同心圆状,搏动同步性,收缩明显,搏动频率50~100 beat/min。免疫组化显示95%以上细胞为α-actinin阳性(图1)。
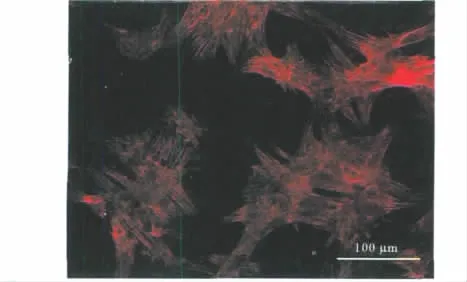
图1 培养的心肌细胞α-actinin染色Fig 1 α-actinin staining of cultured CM(×200)
2.2 MSCs体外培养及表面抗原的表达
MSCs分离后约24 h贴壁,2~3 d细胞开始汇合,5~7 d汇合达80%。消化传代细胞增殖更加迅速,4~6 d可长满整个瓶底。随着换液与传代,MSCs逐渐得到纯化。第3代细胞生长均匀一致,方向较规律,呈平行或旋涡状生长。用流式细胞仪检测MSCs表面抗原特性,MSCs表达CD90,其阳性率达95%;不表达CD45。
2.3 MSCs转染GATA-4的表达
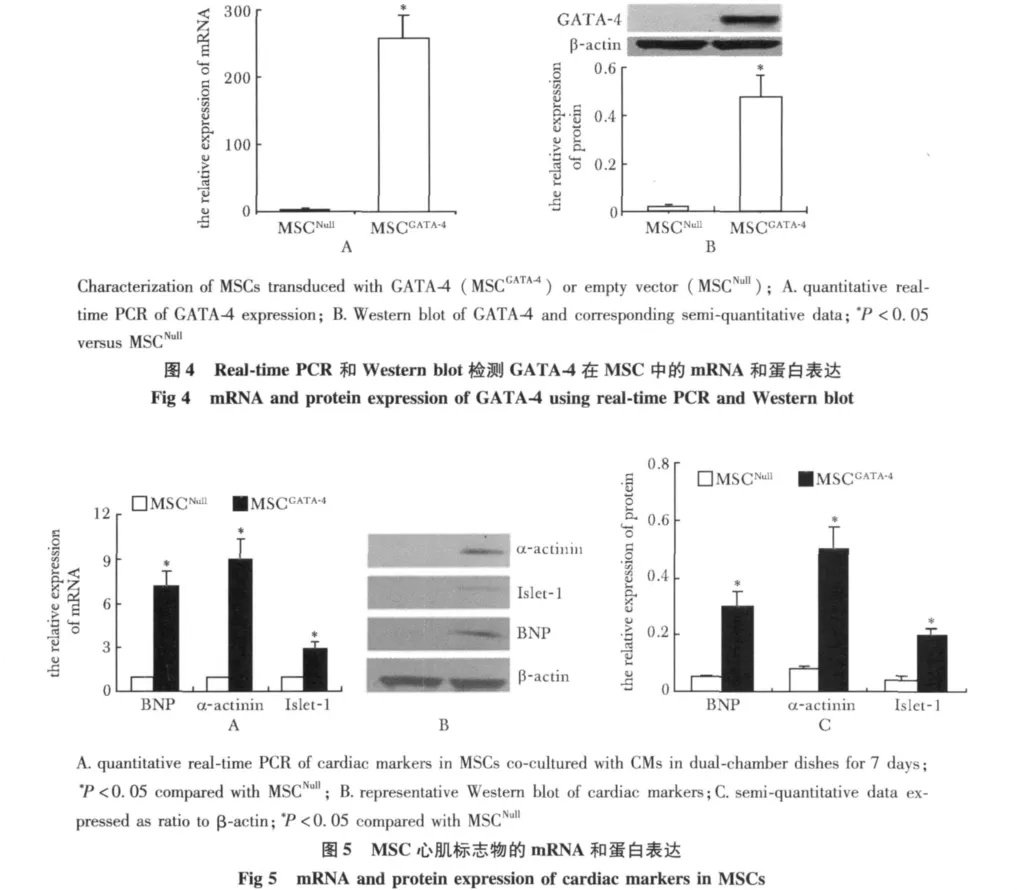
GATA-4转染MSCs后,在荧光显微镜下,细胞成绿色荧光(图2),转染效率达到98%以上。MSCGATA-4的细胞核GATA-4表达阳性,细胞核呈现红色荧光(图3A),而对照组(MSCNull)虽然细胞呈现绿色荧光,但细胞核的 GATA-4表达阴性(图 3B)。MSCGATA-4组GATA-4 mRNA的表达明显高于对照组MSCNull(图4A)(P<0.05)。MSCGATA-4组 GATA-4蛋白的表达明显高于对照组MSCNull(图4B)(P<0.05)。可见GATA-4成功转染到MSCs中。

2.4 MSCs与CM共培养后心肌基因的表达
单独培养MSC,GATA-4组与对照组相比,心肌细胞标记基因BNP、α-actinin和Islet-1有所增加。当MSC与 CM嵌套共培养1周后,BNP、α-actinin和Islet-1的表达在MSCGATA-4中明显高于对照组(P<0.05)(图5A)。通过Western blot分析蛋白(图5B),发现BNP、α-actinin和Islet-1的蛋白表达在MSCGATA-4组中也明显高于对照组(P<0.05)(图5C)。
2.5 MSCs与CM混合共培养后心肌分化
MSCs与CM混合共培养1周后,荧光显微镜下可见搏动的 MSCs,搏动的细胞数 MSCGATA-4组(26% ±3%)明显高于对照组MSCNull(14% ±1%)。用免疫组化染色可见部分MSCsα-actinin染色阳性。用流式细胞仪检测 α-actinin准确表达,发现MSCGATA-4组(34% ±4%)明显高于对照组 MSCNull(14% ±1%)(P<0.05)。可见MSCGATA-4组心肌分化率明显高于对照组。
3 讨论
GATA-4是GATA锌指蛋白转录因子家族中一员,该因子是心脏前体细胞的最早期标志之一,是心脏细胞分化、发育过程中的重要转录因子;在心脏生长发育、分化、心肌肥厚和抗凋亡等方面发挥着重要的调节作用。GATA-4作为一种特定的细胞核转录因子,涉及基因调节的不同环节;控制着基因的表达和功能的调节。它可以调控许多心脏结构基因的表达,包括ANP、BNP、α-MHC等。另外它可以通过其锌指结构与其他心脏特异性的转录因子如Nkx2.5、TBX5、MEF2等相互作用形成复合物发挥转录调控作用,从而调节心脏发育。
近年有研究证实,GATA-4直接或间接地在心肌梗死修复中扮演着重要的调节作用[8]。它可以促进血管生成,增加细胞存活和分化[8-10]。在1997年Grepin C报道,在 P19胚胎癌性细胞系中,GATA-4过度表达可以促进其向搏动的心肌细胞分化,而用反义寡核苷酸抑制GATA-4因子的表达,则可阻断心肌细胞分化。可见GATA-4可以促进P19胚胎癌性细胞系向心肌分化。对GATA-4的乙酰化修饰,也可上调心肌细胞特异性基因的表达。本研究人员最近发现[7],转染了GATA-4真核表达质粒的MSCs,能显著促进MSCs释放生长因子如VEGF和IGF;增加人脐静脉内皮细胞HUVEC的生长,促进毛细血管样结构的形成,在此实验的基础上,研究人员进一步研究了GATA-4对MSCs的促心肌分化作用。
本研究结果发现,转染GATA-4基因后,把转基因的MSCs与新生大鼠CM共培养7 d,MSCGATA-4心肌基因BNP、Islet-1、α-actinin的mRNA表达与对照组相比明显增加。用Western blot检测发现BNP、Islet-1和α-actinin蛋白表达也明显增加。当把转基因的MSCs与新生大鼠CM混合共培养7 d后,发现MSCGATA-4的搏动增加,α-actinin免疫组化染色也增加。用流式细胞仪检测发现MSCGATA-4组α-actinin的阳性率明显增加。可见MSCGATA-4组的心肌分化率高于对照组。这些结果提示,与对照组比较,转染了GATA-4后可以明显增加MSCs转化为心肌样细胞,促进MSCs向心肌分化。这为寻找更有效的MSCs治疗方案提供理论和实验依据,为不可逆性心脏疾病的生物学治疗开辟新的途径。
总之,细胞移植在心血管疾病组织工程研究中应用前景广阔,但细胞的分化是一个非常复杂的过程。该研究将有助于人们更好地认识GATA-4对MSCs调节作用及心肌分化作用,其具体机制还需进一步探讨。这将为研究MSCs分化的机制并应用于临床移植提供充分的理论依据。
[1]Shi RZ,Li QP.Improving outcome of transplanted mesenchymal stem cells for ischemic heart disease[J].Biochem Biophys Res Commun,2008,376:247-250.
[2]Xu M,Wani M,Dai YS,et al.Differentiation of bone marrow stromal cells into the cardiac phenotype requires intercellular communication with myocytes[J].Circulation,2004,110:2658-2665.
[3]赵艳梅,钟国强,柯红红,等.体外不同诱导条件对大鼠骨髓间充质干细胞分化为心肌细胞的影响[J].基础医学与临床,2010,30:561-565.
[4]Hu DL,Chen FK,Liu YQ,et al.GATA-4 promotes the differentiation of P19 cells into cardiac myocytes[J].Int J Mol Med,2010,26:365-372.
[5]He Z,Li H,Zuo S,et al.Transduction of Wnt11 promotes mesenchymal stem cells transdifferentiation into cardiac phenotypes[J].Stem Cells Dev,2011,20:1771 -1778.
[6]李红霞,杨向军,赵欣,蒋彬,等.大鼠骨髓基质干细胞起搏电流基因的表达及转染人HCN2的表达及鉴定[J].中华心血管病杂志,2006,34:917-921.
[7]Li H,Zuo S,He Z,et al.Paracrine factors released by GATA-4 overexpressed mesenchymal stem cells increase angiogenesis and cell survival[J].Am J Physiol Heart Circ Physio,2010,299:H1772-1781.
[8]Rysa J,Tenhunen O,Serpi R,et al.GATA-4 is an angiogenic survival factor of the infarcted heart[J].Circ Heart Fail,2010,3:440 -450.
[9]Heineke J,Auger-Messier M,Xu J,et al.Cardiomyocyte GATA4 functions as a stress-responsive regulator of angiogenesis in the murine heart[J].J Clin Invest,2007,117:3198-3210.
[10]Wang HH,Li PC,Huang HJ,et al.Peritoneal dialysate effluent during peritonitis induces human cardiomyocyte apoptosis by regulating the expression of GATA-4 and Bcl-2 families[J].J Cell Physiol,2011,226:94 -102.
