5-氮-2'-脱氧胞苷逆转膀胱癌细胞hepaCAM基因的表达及对其生长的抑制
2013-08-28潘翠翠张彦懿吴小候罗春丽
刘 琪,潘翠翠,徐 新,张彦懿,吴小候,罗春丽*
(重庆医科大学1.检验医学院临床检验诊断学教育部重点实验室重庆市重点实验室;2.附属第一医院泌尿外科,重庆400016)
肿瘤发生的分子机制主要有3种类型:基因突变、基因缺失和表观遗传学改变[1]。而表观遗传学改变又主要包括DNA甲基化、组蛋白乙酰化和组蛋白甲基化[2]。其中DNA甲基化改变分为全基因组水平的低甲基化和 CpG岛 DNA高甲基化[3];CpG岛的异常高甲基化主要发生于抑癌基因启动子区域。故抑癌基因在肿瘤中的失活可归结于其基因启动子区域CpG岛的异常高甲基化。
DNA甲基化由DNA甲基转移酶(DNMT)催化形成,是在不改变核酸序列的情况下,调节基因表达的不可逆过程[4]。5-氮-2'脱氧胞苷(5-aza-2'-deoxycytidine,5-aza-CdR)是DNMT的抑制剂,可以逆转抑癌基因的甲基化,使其重新表达[5]。在很多其他肿瘤研究中,例如结肠癌[6]、前列腺癌[7]等,5-aza-CdR都可在一定程度上逆转抑癌基因的甲基化并抑制肿瘤生长。肝细胞黏附分子(hepatocyte cell adhesion molecule,hepaCAM),作为一个抑癌基因,在膀胱癌中表达低下,并且在体外研究中发现hepaCAM具有抑制膀胱癌生长的作用[8-9]。因此,本研究以hepaCAM为出发点,探究5-aza-CdR是否也能逆转hepaCAM基因在膀胱癌细胞中的表达,并与hepaCAM一起发挥抑制肿瘤生长的作用。
1 材料与方法
1.1 材料
人膀胱癌细胞T24(重庆医科大学传染病研究所惠赠),BIU-87细胞系(武汉大学细胞库)。5-aza-CdR、MTT试剂和二甲基亚砜(DMSO)(Sigma公司);RNA提取试剂盒Trizol和RT-PCR试剂盒(大连宝生物工程);PCR引物(Invitrogen公司);细胞培养基RPMI1640和新生牛血清(Gibco公司);细胞凋亡检测试剂(重庆医科大学儿研所流式细胞实验室提供)。
1.2 方法
1.2.1 细胞培养:T24和BIU-87细胞培养于含有10%新生牛血清的RPMI1640培养基中,37℃、5%CO2饱和湿度条件下培养。将细胞以1×106个/孔的密度种于6孔板中,待细胞生长汇合度达到80%~90%,按照总 RNA提取步骤提取 RNA,保存于-80℃,为后续实验准备。
1.2.2 四甲基偶氮唑盐比色法(MTT法)检测5-aza-CdR对T24和BIU-87细胞增殖的影响:取对数期生长的T24和BIU-87细胞,经胰蛋白酶消化制成细胞悬液,调整细胞浓度为1×104个/mL,接种于96孔板中,最后补充培养基至200 μL。每组设5个复孔,同时接种3个96孔板,37℃、5%CO2恒温培养箱中培养24 h。实验分为6组:T24(调零组、未处理组、0.3、1.0、3.0 和10.0 μmol/L),BIU-87(调零组、未处理组、0.1、0.5、1.0 和5.0 μmol/L)。加药后3个板分别继续培养24、48和72 h。弃上清,每孔加入20 μL的MTT(5 g/L)继续培养4 h后,小心吸去上清,加入 DMSO 200 μL,振荡孵育15 min,全自动酶标仪(570 nm)检测各孔的吸光度(A值)。计算各组细胞生长抑制率,公式如下:抑制率(%)=[1-(A处理-A调零)/(A对照-A调零)] ×100%。
1.2.3 反转录-聚合酶链反应检测hepaCAM mRNA的表达:分别用不同浓度的5-aza-CdR处理T24和BIU-87细胞,未用药物处理作为对照,培养24、48和72 h后收集细胞,提取RNA,用反转录试剂盒将mRNA逆转为cDNA,RT-PCR检测5-aza-CdR处理前后T24和BIU-87细胞中hepaCAM表达的变化。PCR反应条件:hepaCAM:95℃预变性5 min;94℃变性30 s,56℃退火30 s,72℃延伸1 min共35个循环;72℃继续延伸5 min。β-actin:95℃预变性5 min;94℃ 变性30 s,56 ℃ 退火30 s,72℃ 延伸1 min,共30个循环;72℃继续延伸5 min。hepaCAM上游引物是5'-AGCGGGAAATCGTGCGTG-3',下游引物是5'-CTTCTGGTTTCAGGCGGTC-3',扩增产物为461 bp。β-actin上游引物是5'-ACGAGACCACCT TCAACTCCATC-3',下游引物是5'-TAGAAGCATTTG CGGTGGACGA-3',扩增产物片断为307 bp。
1.2.4 流式细胞术检测细胞凋亡:收集细胞,固定于70%冷乙醇(in PBS)中,4℃固定过夜,磷酸二氢盐缓冲液(PBS)洗涤,1 000 r/min离心10 min,RNase A(0.5 g/L)37℃ 消化30 min,加入 PI(50 g/L)染色,室温避光15 min,FACScan分析DNA亚2倍体的形成及细胞凋亡的变化。
1.3 统计学分析
2 结果
2.1 MTT法检测5-aza-CdR对T24和BIU-87细胞增殖的影响
5-aza-CdR呈剂量依赖性抑制了T24与BIU-87细胞的增殖。在T24与BIU-87细胞中,药物处理细胞72 h的抑制率明显高于24和48 h(P<0.05)(图1)。
2.2 RT-PCR检测5-aza-CdR处理T24和BIU-87细胞后hepaCAM mRNA的表达
经5-aza-CdR处理T24和BIU-87细胞后,hepaCAM表达呈剂量依赖性和时间依赖性 (图2,表1,2)。
2.3 流式细胞术检测5-aza-CdR对T24和BIU-87细胞凋亡的影响
5-aza-CdR处理T24和BIU-87细胞后,明显增加了凋亡细胞数,呈时间依赖性(P<0.05)(图3)。
3 讨论
2010年,全球新增35.7万个膀胱癌病例,并有14.5万个人死于膀胱癌。90%以上的膀胱癌为移行细胞癌(transitional cell carcinoma of the bladder,TCCB),5% 为鳞状细胞癌,2% 为腺癌[10-11]。75%的TCCB为非肌肉侵袭性的,具有高复发率,且容易发展为高度恶性肿瘤[12];而肌肉侵袭性 TCCB(25%)预后不良[13],经过2年治疗后,50%患者会发生肿瘤转移[14]。尽管外科手术治疗,膀胱内免疫、化学治疗,以及一些新型化疗方法(如酪氨酸激酶抑制剂、抗血管生成药物等)应用于膀胱癌,但患者的生存率并未提高[14]。而在过去十几年中,众多研究都致力于寻找一种无创伤,特异性强并具有靶
向性的分子生物学治疗方法。这个工程巨大、过程复杂、冗长,所以找到一种综合性的方法,更是亟待解决的问题。
表1 5-aza-CdR作用不同时间对T24和BIU-87细胞hepaCAM mRNA的影响Table 1 The effect of 5-aza-CdR on expression of hepaCAM mRNA of T24 and BIU-87 cells in different times,A value,n=4)

表1 5-aza-CdR作用不同时间对T24和BIU-87细胞hepaCAM mRNA的影响Table 1 The effect of 5-aza-CdR on expression of hepaCAM mRNA of T24 and BIU-87 cells in different times,A value,n=4)
*P <0.05 compared with blank,24 or 48 hours.
group T24(3 μmol/L 5-aza-CdR) BIU-87(5 μmol/L 5-aza-CdR)blank 0.027±0.003 0.146±0.002 24 hours 0.032±0.001 0.098±0.003 48 hours 0.036±0.002 0.104±0.000 72 hours 0.716±0.008* 0.536±0.002*
表2 72 h时不同药物浓度的5-aza-CdR对T24和BIU-87细胞hepaCAM mRNA的影响Table 2 The effect of different concentrations of 5-aza-CdR on expression of hepaCAM of T24 and BIU-87 cell lines for 72 hours,A value,n=5)
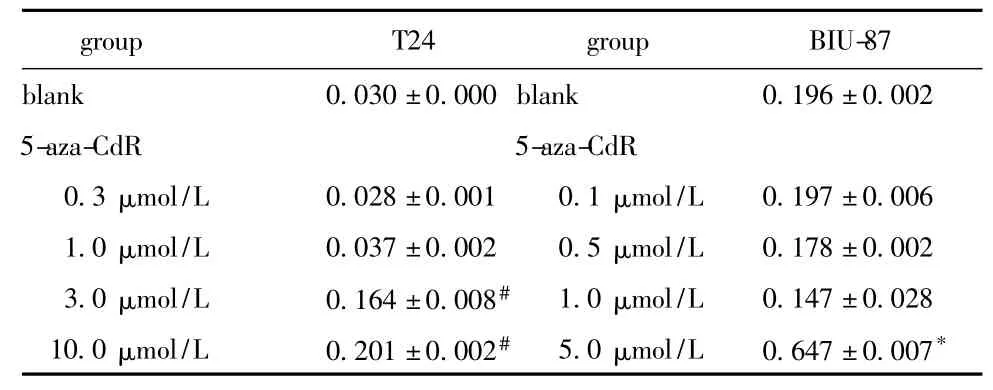
表2 72 h时不同药物浓度的5-aza-CdR对T24和BIU-87细胞hepaCAM mRNA的影响Table 2 The effect of different concentrations of 5-aza-CdR on expression of hepaCAM of T24 and BIU-87 cell lines for 72 hours,A value,n=5)
#P <0.05 compared with blank or 0.3 or 1.0 μmol/L 5-aza-CdR;*P <0.05 compared with blank or 0.1 or 0.5 or 1.0 μmol/L 5-aza-CdR.
group T24 group BIU-87 blank 0.030±0.000 blank 0.196±0.002 5-aza-CdR 5-aza-CdR 0.3 μmol/L 0.028 ±0.001 0.1 μmol/L 0.197 ±0.006 1.0 μmol/L 0.037 ±0.002 0.5 μmol/L 0.178 ±0.002 3.0 μmol/L 0.164 ±0.008# 1.0 μmol/L 0.147 ±0.028 10.0 μmol/L 0.201 ±0.002# 5.0 μmol/L 0.647 ±0.007*
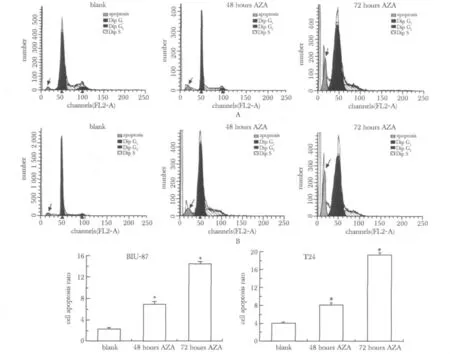
图3 流式细胞技术检测5-aza-CdR对T24和BIU-87细胞凋亡的影响Fig 3 The effect of 5-aza-CdR on apoptosis of T24 and BIU-87 cell lines was detected by FCM
5-aza-CdR是一种去甲基化药物,可以抑制抑癌基因的甲基化,使众多抑癌基因重新表达。迄今已有临床Ⅰ,Ⅱ期试验证实,在实体瘤中,如卵巢癌、雄激素依赖的前列腺癌、子宫颈癌等,5-aza-CdR难以达到预期的有效治疗作用,后续的药物效力仍在研究中;在血液的恶性肿瘤临床Ⅰ,Ⅱ期实验中,5-aza-CdR单剂量就对急性白血病有疗效,对进展中的慢性粒细胞白血病有中等的疗效[7]。但5-aza-CdR在膀胱癌中的研究和应用甚少,故本研究先从体外实验出发,用不同浓度的5-aza-CdR处理膀胱癌T24和BIU-87细胞,发现5-aza-CdR可以抑制体外膀胱癌细胞的增殖,并可促使细胞凋亡;另一方面,从抑癌基因hepaCAM角度出发,发现5-aza-CdR可使hepaCAM基因重新表达。hepaCAM自2005年发现以来,一直都在研究其结构和功能[8-9],至于它在肿瘤组织中表达低下或缺失的原因研究较少。本研究发现5-aza-CdR可逆转 hepaCAM基因表达,而5-aza-CdR又是DNA甲基转移酶的抑制剂,可逆转抑癌基因的甲基化,那么5-aza-CdR使hepaCAM重新表达的原因是否会由于5-aza-CdR逆转了抑癌基因hepaCAM的甲基化;5-aza-CdR对膀胱癌细胞的抑制作用也是否也源于hepaCAM基因的重新表达,或者是其单纯的抑制作用,又或者有两种机制一起作用,这些问题都需要进一步的研究。然而,5-aza-CdR应用于膀胱癌,可使很大一部分的抑癌基因得到重新表达,从另个方面又增强了抑制肿瘤生长的作用,故设想若结合精确的手术治疗,常规化疗,以及新型的药物治疗,比如5-aza-CdR,可能会给膀胱癌治疗带来新的前景。
[1]Hanahan D,Weinberg RA.The hallmarks of cancer[J].Cell,2000,100:57 - 70.
[2]Jones PA,Baylin SB.The fundamental role of epigenetic events in cancer[J].Nat Rev Genet,2002,3:415 -428.
[3]Tao L,Wang W,Li L,et al.DNA hypomethylation induced by drinking water disinfection by-produe in mouse and rat kidney[J].Toxieol Sci,2005,87:344 -352.
[4]Strahl BD,Allis CD.The language of covalent histone modifications[J].Nature,2000,403:41 -45.
[5]Tamer E.Fandy.Development of DNA methyltransferase inhibitors for the treatment of neoplastic diseases[J].Curr Med Chem,2009,16:2075-2085.
[6]刘丽乔,罗达亚,付晶晶,等.5-aza-CdR对人结肠癌Caco-2细胞系P16基因甲基化状态及其生物学表型的影响[J].基础医学与临床,2011,31:161-165.
[7]J.Goffin,E.Eisenhauer.DNA methltransferase inhibitorsstate of the art[J].Ann Oncology,2002,13:1699 -1716.
[8]Zhang QL,Luo CL,Wu XH,et al.HepaCAM induces G1phase arrest and promotes c-Myc degradation in human renal cell carcinoma[J].J Cell Biochem,2011,112:2910-2919.
[9]He Y,Wu X,Luo C,et al.Functional significance of the hepaCAM gene in bladder cancer [J].BMC Cancer,2010,10:83 -89.
[10]Ehdaie B,Smith SC,Theodorescu D,et al.Personalized medicine in advanced urothelial cancer:when to treat,how to treat and who to treat[J].Can Urol Assoc J,2009,3:232-236.
[11]文进,李汉忠,纪志刚,等.苹果酸舒尼替尼抑制膀胱癌T24细胞系的体外增殖[J].基础医学与临床,2011,31:988-990.
[12] Epstein JI,Amin MB,Reuter VR,et al.The World Health Organization/International Society of Urological Pathology consensus classification of urothelial(transitional cell)neoplasms of the urinary bladder[J].Bladder Consensus Conference Committee.Am J Surg Pathol,1998,22:1435-1448.
[13]Lee R,Droller MJ.The natural history of bladder cancer.Implications for therapy[J].Urol Clin North Am,2000,27:1-13.
[14]Plissonnier ML,Fauconnet S,Bittard H,et al.The antidiabetic drug ciglitazone induces high grade bladder cancer cells apoptosis through the up-regulation of TRAIL[J].PLoS One,2011,6:e28354.
