油酸调节人血管平滑肌细胞TLR4的增殖活性及炎性因子的表达
2013-08-28杨海静权金星李伟华邱明才
杨海静,陈 卫,权金星,李伟华,刘 静,邱明才
(1.兰州大学基础医学院生物化学与分子生物学研究所;2.甘肃省人民医院内分泌科;3.甘肃省人民医院中心实验室,甘肃兰州730000;4.天津医科大学总医院内分泌科,天津300052)
大血管病变是2型糖尿病常见的慢性并发症,动脉内皮细胞功能紊乱和血管平滑肌细胞增生是动脉粥样硬化形成和发展的重要病理机制。
TLR4是介导固有免疫和炎性反应的关键因子,有研究发现,低浓度的TLR4天然配体脂多糖(lipopolysaccharide,LPS)可激活人冠状动脉平滑肌细胞 TLR4 信号及其下游炎性因子的表达[1-2],提示人主动脉血管平滑肌细胞(human aortic vascular smooth muscle cells,HA-VSMC)TLR4信号的激活可诱导细胞产生炎性反应,可能在动脉粥样硬化的发生和发展过程中起重要作用。游离脂肪酸(free fatty acid,FFA)是2型糖尿病胰岛素抵抗和动脉粥样硬化形成和发展的重要致病因素,FFA通过多种途径诱导动脉内皮细胞功能紊乱和血管平滑肌细胞增生,促进动脉粥样硬化的发生和发展。有研究发现,FFA可激活人血管内皮细胞TLR4信号导致人血管内皮细胞产生炎性反应[3],但FFA能否诱导人血管平滑肌细胞产生炎性反应尚未见报道。
本研究通过研究油酸对HA-VSMC TLR4基因及其下游炎性因子表达的调节作用,以期进一步阐明2型糖尿病大血管并发症的发病机制,亦为今后将TLR4作为2型糖尿病抗炎治疗的靶点提供理论依据。
1 材料与方法
1.1 材料
DMEM培养基、胎牛血清和二甲基亚砜(Gibco公司),油酸和LPS(Sigma公司),Trizol RNA提取试剂盒(Invitrogen公司),反转录试剂盒(大连宝生物公司),SYBR® Green Master Mix(日本东洋纺株式会社),蛋白抽提试剂盒(普利莱基因技术有限公司),鼠抗人TLR4和兔抗人β-肌动蛋白多克隆抗体(CST公司),IL-6、IL-8和 MCP-1 ELISA试剂盒(R&D公司),HA-VSMC细胞系(ATCC公司),引物由上海生工生物工程公司合成。
1.2 方法
1.2.1 HA-VSMC培养和药物干预实验:将HA-VSMC细胞复苏后,于37℃、5%CO2条件下培养,待细胞生长至80% ~90%汇合时,用0.25%的胰蛋白酶消化传代。以1×105个/mL的浓度接种细胞,待细胞生长状态良好,换用含0.25%胎牛血清的DMEM培养基继续培养24 h后进行干预试验。不同浓度的油酸(50、100 和200 μmol/L)处理 HA-VSMC,未加药物组为对照组,LPS组作为阳性对照。在相应的时间点收获细胞提取总RNA和细胞蛋白,收集细胞培养上清用以检测TLR4、IL-6、IL-8及MCP-1mRNA和蛋白的表达水平。
1.2.2 四甲基偶氮唑蓝(MTT)法检测细胞增殖活性:收集对数期细胞,培养至细胞单层铺满孔底后,更换含0.25%胎牛血清的培养基培养24 h,加入油酸(浓度分别为 50、100、200 和300 μmol/L)继续培养24 h,然后每孔加入20 μL MTT溶液,孵育4 h后终止培养,吸弃培养液。每孔加入150 μL二甲基亚砜,低速振荡10 min,然后测量吸光度值。
1.2.3 实时荧光定量PCR法检测TLR4、IL-6、IL-8和MCP-1 mRNA表达:1)RNA提取和反转录:用Trizol提取HA-VSMC总RNA,紫外分光光度计测定其浓度和纯度,1%甲醛变性胶电泳鉴定总RNA完整性。每份标本取2 μg RNA,用反转录试剂盒将总RNA转录合成为 cDNA,将 cDNA产物贮存于-20℃备用,实验方法按试剂盒说明书操作。2)引物:TLR4:上游 5'-TGAGCAGTCGTGCTGGTATC-3',下游5'-CAGGGCTTTTCTGAGTCGTC-3';IL-6:上游5'-TACCCCCAGGAGAAGATTCC-3',下游 5'-TTTTCT GCCAGTGCCTCTTT-3';IL-8:上游 5'-GTGCAGTTTT GCCAAGGAGT-3',下游 5'-CTCTGCACCCAGTTTTCC TT-3';MCP-1:上游5'-AACACTCACTCCACAACCCA AG-3',下 游:5'-TGTGGTTCAAGAGGAAAAGCAAT-3';β-actin:上游 5'-GCACCACACCTTCTACAATGA G-3',下 游 5'-ATAGCACAGCCTGGATAGCAAC-3'。扩增片段长度分别为 167、175、196、230 和164 bp。3)反应体系:25 μL实时荧光定量PCR扩增体系包括上下游引物(10 μmol)各1μL,cDNA 5 μL,定量PCR反应混合物(SYBR® Green Master Mix)12.5 μL,ddH2O 5.5 μL。4)PCR 循环参数:扩增条件为95℃ 预变性5 min,95℃ 10 s,58℃ 20 s,72℃ 30 s,进行30个循环。采用β-actin做为内参照和2-△△Ct相对定量法[4]来评价目的基因 mRNA的表达水平。
1.2.4 Western印迹法检测TLR4蛋白表达水平:采用不同剂量的油酸或 LPS(10 μg/L)处理细胞24 h后,提取细胞总蛋白,牛碳酸酐酶(BCA)法测定蛋白浓度,经SDS-PAGE电泳,转膜封闭后,分别加入一抗、二抗孵育,电化学发光法(ECL)显色,X线胶片曝光。以TLR4蛋白与β-肌动蛋白的吸光度比值表示TLR4蛋白的相对表达水平。
1.2.5 ELISA法检测IL-6、IL-8、MCP-1蛋白表达:收集细胞培养上清液,采用ELISA试剂盒检测IL-6、IL-8、MCP-1蛋白含量,实验操作参照试剂盒说明书进行。
1.3 统计学分析
2 结果
2.1 油酸对HA-VSMC细胞增殖活性的影响
不同浓度的油酸处理HA-VSMC 24 h后吸光度值分 别 为 50μmol/L(0.45 ± 0.00)、100 μmol/L(0.79 ± 0.04)、200 μmol/L(1.22 ± 0.01)、300 μmol/L(1.03±0.01),与对照组(0.35 ±0.03)比较P<0.05。
2.2 油酸调节 HA-VSMC细胞 TLR4、IL-6、IL-8和MCP-1 mRNA表达
油酸调节HA-VSMC中TLR4和炎性因子IL-6、IL-8和MCP-1 mRNA的表达具有明显的时间-剂量依赖性。油酸上调 TLR4、IL-6、IL-8和 MCP-1 mRNA表达最大上调幅度分别为对照组的6.5、7.4、7.4和7.1 倍(P <0.05)(表 1,2,3,4)。10 μg/L LPS处理细胞24 h时后 TLR4、IL-6、IL-8和 MCP-1 mRNA的表达分别为对照组的5.9、6.5、6.9和6.8倍(P<0.05)(图1)。
2.3 Western印迹法检测TLR4蛋白表达水平结果
采用不同浓度的油酸(50、100和200 μmol/L)处理细胞24 h后,TLR4蛋白表达量呈增加趋势,其灰度值比值分别为(0.67±0.19)、(1.15±0.56)和(1.70 ±0.62),200 μmol/L组与对照组(0.29 ±0.22)比较P<0.05。LPS明显促进TLR4蛋白表达(1.93±0.87),与对照组比较P<0.01(图2)。
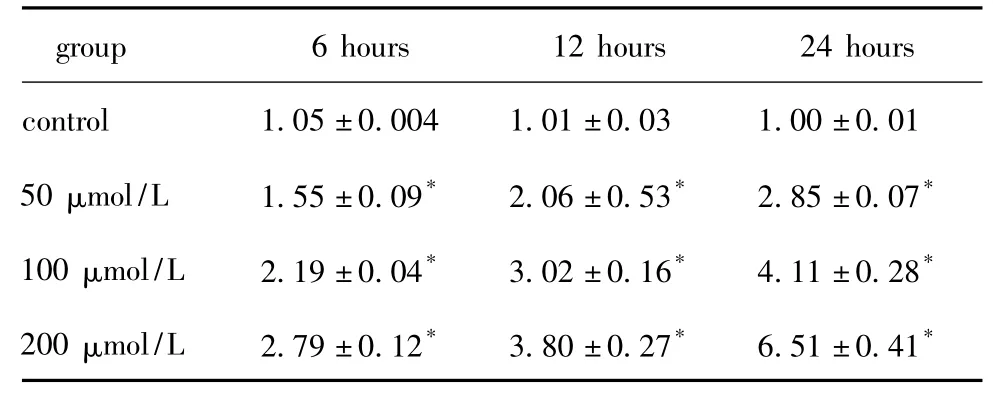
表1 油酸对HA-VSMC TLR4 mRNA表达水平的影响Table 1 Effects of oleic acid on TLR4 mRNA expression in HA-VSMC
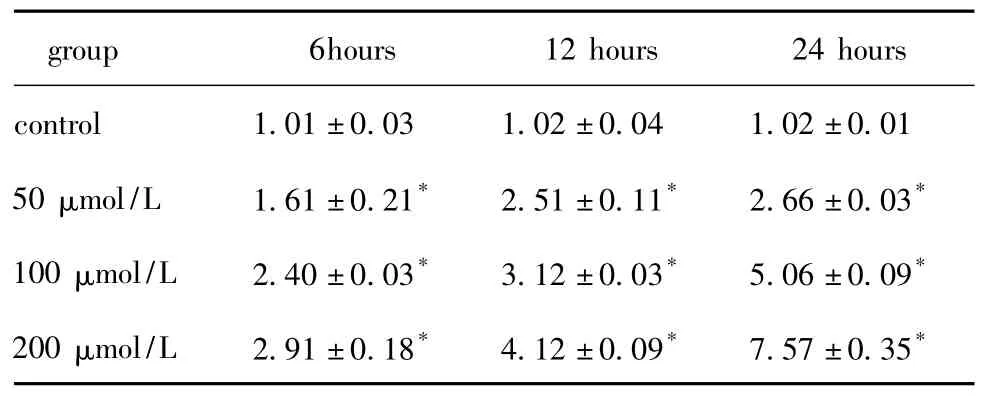
表2 油酸对HA-VSMC IL-6 mRNA表达的影响Table 2 Effects of oleic acid on IL-6 mRNA expression in HA-VSMC
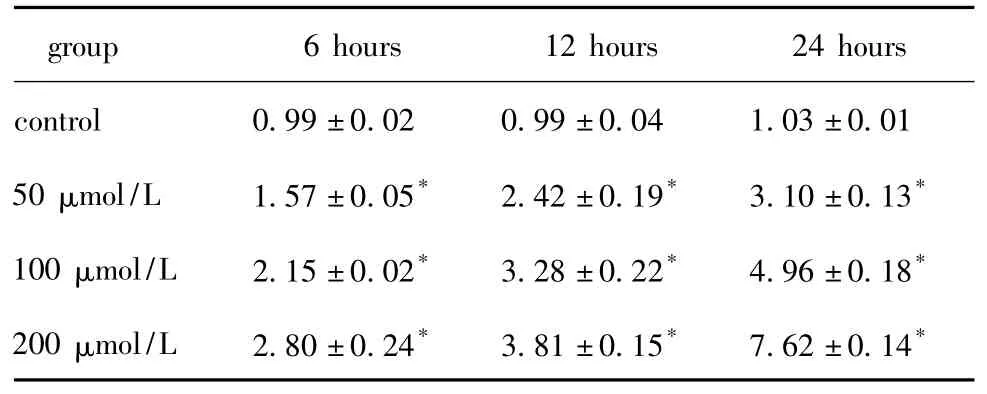
表3 油酸对HA-VSMC IL-8 mRNA表达水平的影响Table 3 Effects of oleic acid on IL-8 mRNA expression in HA-VSMC

表4 油酸对HA-VSMC MCP-1 mRNA表达水平的影响Table 4 Effects of oleic acid on MCP-1 mRNA expression in HA-VSMC
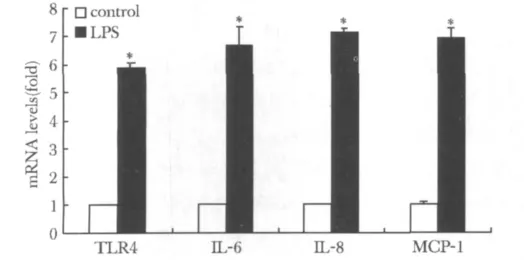
图1 LPS 干预 HA-VSMC 24 h 后 TLR4、IL-6、IL-8和MCP-1 mRNA表达水平Fig 1 The levels of TLR4、IL-6、IL-8 and MCP-1 mRNA in HA-VSMC by LPS for 24 hours

图2 油酸及LPS干预HA-VSMC细胞24 h后TLR4蛋白表达Fig 2 The expression of TLR4 protein in HA-VSMC by oleic acid and LPS for 24 hours(n=3)
2.4 油酸调节HA-VSMC细胞IL-6、IL-8、MCP-1蛋白含量
油酸促进HA-VSMC中IL-6、IL-8和MCP-1蛋白表达。IL-6、IL-8和MCP-1蛋白表达的最大上调幅度为对照组的2.16、1.9倍和2.06倍(P<0.05)。LPS处理细胞24 h时后可明显促进IL-6、IL-8和MCP-1蛋白水平的表达,分别为对照组的2.06、1.97和1.96倍(P <0.05)(表5,6,7)。
3 讨论
血管内皮细胞功能紊乱和平滑肌细胞增生是2型糖尿病动脉粥样硬化发生的重要病理机制。近年来的研究发现,血管内皮细胞和平滑肌细胞的炎性反应很可能参与了2型糖尿病动脉粥样硬化的发生发展。
表5 各组HA-VSMC中IL-6蛋白含量Table 5 The expression of IL-6 proteins in various groups of HA-VSMC(,ng/L,n=3)

表5 各组HA-VSMC中IL-6蛋白含量Table 5 The expression of IL-6 proteins in various groups of HA-VSMC(,ng/L,n=3)
*P <0.05,**P <0.01 compared with control group.
group 6 hours 12 hours 24 hours control 217±11 217±12 217±11 50 μmol/L 254 ±16* 311 ±20** 334 ±23**100 μmol/L 294±21** 344±21** 420±17**200 μmol/L 317±15** 397±25** 474±32**LPS(10 μg/L) 447 ±31**
表6 各组HA-VSMC中IL-8蛋白含量Table 6 The expression of IL-8 proteins in various groups of HA-VSMC,ng/L,n=3)
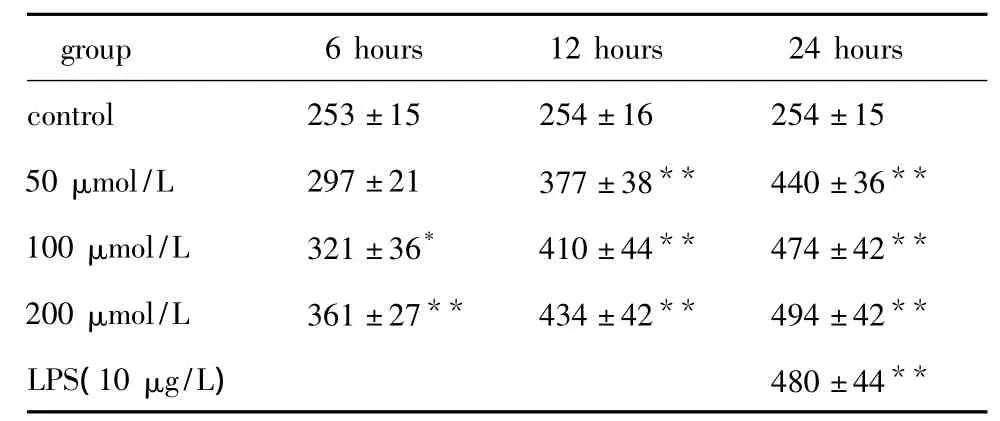
表6 各组HA-VSMC中IL-8蛋白含量Table 6 The expression of IL-8 proteins in various groups of HA-VSMC,ng/L,n=3)
*P <0.05,**P <0.01 compared with control group.
group 6 hours 12 hours 24 hours control 253±15 254±16 254±15 50 μmol/L 297 ±21 377 ±38** 440 ±36**100 μmol/L 321 ±36* 410 ±44** 474 ±42**200 μmol/L 361±27** 434±42** 494±42**LPS(10 μg/L) 480 ±44**
表7 各组HA-VSMC中MCP-1蛋白含量Table 7 The expression of MCP-1 proteins in various groups of HA-VSMC(,ng/L,n=3)

表7 各组HA-VSMC中MCP-1蛋白含量Table 7 The expression of MCP-1 proteins in various groups of HA-VSMC(,ng/L,n=3)
*P <0.05,**P <0.01 compared with control group.
group 6 hours 12 hours 24 hours control 122±7 122±8 122±7 50 μmol/L 140 ±4* 171 ±24* 188±11*100 μmol/L 152±6** 196±27** 229±13**200 μmol/L 168±11** 220±25** 266±37**LPS(10 μg/L) 238 ±43**
Toll样受体(Toll-like receptor,TLR)主要表达于单核细胞、巨噬细胞、淋巴细胞、血管内皮细胞及血管平滑肌细胞等细胞中,可识别病原体相关分子模式(pathogen associated molecular patterns,PAMP),诱导炎性因子释放,在天然免疫防御中起重要作用,同时也参与了多种慢性炎性反应疾病的病变过程。有研究发现,TLR4天然配体LPS可激活人冠状动脉平滑肌细胞TLR4信号及炎性因子MCP-1、IL-6和 IL-1的表达[1-2],提示 TLR4 信号的激活可诱导细胞产生炎性反应,可能在动脉粥样硬化的发生和发展过程中起作用。
游离脂肪酸(free fatty acid,FFA)是2型糖尿病和动脉粥样硬化形成和发展的重要致病因素,FFA通过多种途径诱导动脉内皮细胞功能紊乱和血管平滑肌细胞增生,促进动脉粥样硬化的发生和发展[5-9]。国外研究发现,FFA通过激活TLR4信号,诱发小鼠脂肪细胞和巨噬细胞产生炎性反应,而TLR4基因突变(TLR4-/-)则可显著抑制FFA诱导的炎性反应[10-11]。采用软脂酸刺激体外培养的小鼠主动脉或人微血管内皮细胞,通过激活TLR4信号途径诱导血管炎性反应,而TLR4基因敲除则可防止上述变化[12]。以上研究结果表明:TLR4信号很可能在FFA导致的血管内皮细胞功能紊乱中发挥了作用,FFA能否通过TLR4信号诱导HA-VSMC产生炎性反应则未见报道。
油酸是人体重要的不饱和游离脂肪酸,本研究发现:油酸对HA-VSMC的增殖具有双向调节作用,油酸在浓度为50~200 μmol/L之间促进细胞的增殖活性,增加油酸浓度,抑制了细胞增殖。本研究结果表明:油酸诱导HA-VSMC TLR4及炎性因子IL-6、IL-8和MCP-1的mRNA及蛋白表达呈时间剂量依赖性,证实FFA通过TLR4信号激活HA-VSMC产生炎性反应,可能在2型糖尿病动脉粥样硬化和大血管病变的发生和发展中起重要作用,为今后进一步研究炎性反应在2型糖尿病及动脉粥样硬化病理发生机制中的作用提供了依据。本研究仅初步证实了TLR4信号通路在FFA诱导HA-VSMC的炎性反应中的作用,但是其分子机制尚待进一步研究。
[1]Li HL,He Y,Zhang J,et al.Lipopolysaccharide regulates toll-like receptor 4 expression in human aortic smooth muscle cells[J].Cell Biol Int,2007,31:831 -835.
[2]Yang X,Coriolan D,Murthy V,et al.Proinflammatory phenotype of vascular smooth muscle cells:role of efficient Toll-like receptor 4 signaling[J].Am JPhysiol Heart Circ Physiol,2005,289:H1069 -1076.
[3]Kim F,Pham M,Luttrell I,et al.Toll-like receptor-4 mediates vascular inflammation and insulin resistance in dietinduced obesity[J].Circ Res,2007,100:1589 -1596.
[4]Kenneth J L,Thomas D S.Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△Ctmethod[J].Methods,2001,25:402 -408.
[5]Couloubaly S,Deloménie C,Rousseau D,et al.Fatty acid incorporation in endothelial cells and effects on endothelial nitric oxide synthase[J].Eur J Clin Invest,2007,37:692-699.
[6]Piro S,Spampinato D,Spadaro L,et al.Direct apoptotic effects of free fatty acids on human endothelial cells[J].Nutr Metab Cardiovasc Dis,2008,18:96 -100.
[7]Ciapaite J,van Bezu J,van Eikenhorst G,et al.Palmitate and oleate have distinct effects on the inflammatory phenotype of human endothelial cells[J].Biochim Biophys Acta,2007,1771:147 -154.
[8]Yun MR,Lee JY,Park HS,et al.Oleic acid enhances vascular smooth muscle cell proliferation via phosphatidylinositol 3-kinase/Akt signaling pathway[J].Pharmacol Res,2006,54:97 -102.
[9]Shuangtao Ma,Dachun Yang,De Li,et al.Oleic acid induces smooth muscle foam cell formation and enhances atherosclerotic lesion development via CD36[J].Lipids Health Dis,2011,10:53 -57.
[10]Yamaoda S,Miyake K,Aoe S,et al.Role of the Toll-like receptor 4/NF-κB pathway in saturated fatty acid-induced inflammatory changes in the interaction between adipocytes and macrophages[J].Arterioscler Thromb Vasc Biol,2007,27:84 -91.
[11]Shi H,Kokoeva MV,Inouye K,et al.TLR4 links innate immunity and fatty acid-induced insulin resistance[J].J Clin Invest,2006,116:3015 -3025.
[12]Kim F,Pham M,Luttrell I,et al.Toll-like receptor-4 mediates vascular inflammation and insulin resistance in diet-induced obesity[J].Circ Res,2007,100:1589 -1596.
